帕金森病(PD)是一种仅次于阿尔茨海默病与年龄相关的神经退行性疾病,1817年英国医生Parkinson首次提出[1],发病原因及发病机制目前仍不清楚。随着老龄化社会的到来,发病率呈逐年递增,我国每年将近有10 万以上的新发病人,多见于50~65 岁,平均年龄55岁,居民发病率约为1%~2%[2]。病理学研究表明,PD 与黑质纹状体内多巴胺能神经元丧失,多巴胺减少而产生运动功能障碍,运动迟缓,肌强直等症状,以及路易小体的形成,目前尚不能根治[3-4]。目前主要的治疗手段有:药物治疗如抗胆碱能药物、抗组胺药物、左旋多巴胺替代治疗等;外科手术治疗如立体定向神经核团损毁、脑深部电刺激术等。然而药物治疗存在各种缺陷及较多毒副作用,外科手术治疗手术要求高,术后并发症多,且两者均不能阻碍疾病发展[5-6]。干细胞移植成为神经退行性疾病的一个崭新的治疗手段,随着干细胞治疗逐渐应用于临床治疗,且取得较好的疗效[7],各种治疗手段均有利弊,但是目前神经干细胞移植治疗是最具前景的治疗方法,能够从根源解决问题。神经干细胞是最具潜力的基因工程细胞,NSCs是神经系统中的前体细胞,有较强的增殖、分化能力、整合宿主体内较容易,不容易发生免疫排斥反应,基因修饰敏感,不易成瘤等特点,被认为是一种理想的基因导入细胞的载体。是干细胞治疗理想的首选细胞之一[8-9]。NSCs存活、增殖、迁移、分化受复杂的内外源性环境条件因素影响[10]。向多巴胺神经元分化的细胞仅占2%~8%,体内移植实验mNSCs向DA分化也极少。干细胞诸多优点,但是需要保证移植后定植存活、分化,那么我们就需要为干细胞生存提供良好的微环境,打破单纯细胞移植的局限,一方面改善微环境,即niche,尽可能的保证多的神经干细胞能够定植存活,提高移植存活率,另一方面提高神经干细胞分化为多巴胺能神经元的数量。GDNF是胶质细胞源性生长因子,维持了神经元生长分化的良好微环境,并对多巴胺(DA)能神经元具有特异性的营养、支持、保护和损伤修复作用[11]。另外随着分子细胞生物学技术的发展,基因治疗为解决GDNF如何以载体方式导入宿主特定靶位提供了另一有效途径[12]。本研究拟主要探讨神经干细胞被基因(GDNF)修饰后移植治疗PD大鼠模型的作用,观察大鼠行为学变化,神经干细胞存活数量,分化为多巴胺能神经元数量的变化,提供实验有效性依据[13-14]。为进一步临床应用提供干细胞研究基础。
1 材料和方法 1.1 材料 1.1.1 实验动物与细胞雄性Sprague-Dawley大鼠购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2011-0003)。同批次青春期SD雌性大鼠与雄性大鼠合笼受孕,细胞取自孕14~15 d胎鼠中脑腹侧原代神经干细胞培养。
1.1.2 主要试剂及实验仪器DMEM/F12、HBSS购自HyClone;L-谷氨酰胺(200 mmol/L)、青链霉素购自BI;N2 Supplement (100X)、EGF储存液(20 μg/mL)、bFGF储存液(20 μg/mL)购自Peprotech;B27 购自Invitrogen;D-葡萄糖储存液(37%)购自大连美仑公司;TritonX-100购自Amresco;DAPI购自碧云天公司;山羊血清购自广州蕊特公司;PBS 购自Thermo、GFAPpolyclonal Antibody、Nestin polyclonal Antibody、THrabbit polyclonal IgG、Alex-Fluor 594-conjugated GoatAnti-Rabbit IgG、FITC-Goat Anti-Rabbit IgG 购自Protei-ntech;细胞培养箱、高速离心机(Thermo);微量取样器(Eppendorf);手术显微镜、荧光显微镜(Olympus);超净工作台(Hitachi)。
1.2 方法 1.2.1 原代NSCs培养2%戊巴比妥钠(0.6 mL/100 g)腹腔注射麻醉孕14~15 d的SD大鼠,取出胎鼠Hanks溶液漂洗两次,无菌条件下显微解剖分离胎鼠腹侧中脑组织;将组织剪碎≤1 mm3,加入NSCs完全培养液,火焰抛光吸管吹打后,经200目滤网过滤,制成单细胞悬液,离心收集细胞(1200 r/min,5 min),按2×105个/mL的细胞密度接种于培养瓶,37 ℃、5% CO2培养箱中培养,每天观察细胞生长情况,3~4 d半量换液。
1.2.2 GFP/GDNF 基因修饰大鼠胚胎mNSCs 的建立参考我们的方法[15-16],建立培养的大鼠胚胎mNSCs经基因修饰。大鼠GDNF基因由上海生工生物工程技术服务有限公司全基因合成,pCDH-MCS-T2A-copGFPMSCV慢病毒系统载体购于Biovector,由生工提供技术服务。我们摸索的感染复数MOI为5,取0.4 μg上述质粒用无血清培养基稀释至60 μL,加入AttracteneTransfection 高效转染试剂(Qiagen)1.5 μL充分混匀,静置15 min,将混合液小心滴入神经干细胞中(1×107个),细胞继续培养至48 h收获。
1.2.3 建立PD大鼠模型[17]依照大鼠George Paxinos & Charles Watson图谱(第六版),选取260~280 g(279±16.7)雄性SD大鼠2%戊巴比妥钠(0.6 mL/100 g)腹腔注射麻醉,麻醉成功后于大鼠脑立体定向仪正确固定,切开头皮,保持前囟后囟在同一水平。参照大鼠脑立体定位图,以右侧前脑内侧束MFB(A/P:-3.6 mm;L:+2.0 mm;V:-9.0 mm)及腹侧被盖区VTA(A/P:-6.0 mm;L:+0.5 mm;V:-8.0 mm)作为立体定向注射靶点,向靶点进针注入4 μL 6-OHDA(3 μg/μL),以1 μL/min缓慢注入,注射完毕停留微量进样器6 min,最后再缓慢退出针头。术后7 d,开始诱导大鼠向左侧旋转,腹腔注射APO(0.5 mg/kg)10 min后开始记录旋转圈数,每只计时30 min,以后每7 d 1次,连续测试6次。以向左侧旋转圈数大于或等于7圈/min的大鼠作为PD建模成功的大鼠。
1.2.4 细胞移植选取PD建模成功的大鼠36只并随机分为3组,12只/组:① 对照组(等体积PBS);② mNSCs经GFP基因修饰移植组;③ mNSCs经GDNF基因修饰移植组。移植前以1200 r/min离心收集细胞,以106/mL(最终将细胞浓缩成106/10 μL)细胞密度注射。细胞准备好后,PD大鼠腹腔注射2%戊巴比妥钠(0.6 mL/100 g)麻醉,待麻醉成功,固定于立体定向仪,于右侧纹状体(A/P:+0.5 mm;L:+3.0 mm;V:-5.0 mm)用微量注射器注入5×105个细胞(5 μL)。细胞移植不同的时间点诱导大鼠旋转,分别为14、28、42、56 d,腹腔注射APO(0.5 mg/kg)诱发大鼠旋转行为,同样在10 min后观察大鼠旋转行为并计数30 min。
1.2.5 移植细胞的存活、迁移和分化荧光显微镜观察(1)取材:细胞移植8周后灌注取材,按常规麻醉剂量麻醉大鼠,待麻醉成功后,开胸穿刺左心室剪开右心耳,以生理盐水灌注冲净血液,4%多聚甲醛固定30 min,浸泡6~8 h,最后不同浓度蔗糖溶液梯度脱水(20%,35%,45%,55%),沉底后OCT包埋剂包埋,速冻,右侧纹状体附近作冰冻切片(片厚10 μm);(2)免疫荧光组织化学:PBS漂洗,4%多聚甲醛固定,0.3%TritonX-100孵育20 min,10%血清室温封闭30 min,加一抗过夜(各抗体浓度:nestin(巢蛋白)抗体(1∶200)、TH(酪氨酸羟化酶)抗体(1∶200)、GFAP抗体(1∶100),PBS 漂洗3×5 min后加二抗FITC,594(1∶100)孵育30~45 min,PBS漂洗3×5 min,DAPI(1∶500)染核(可选),封片等处理后照相;(3)细胞计数:以细胞移植点为中心连续5张切片,计算每只动物该5张切片在100倍视野下GFP(+)细胞计数,GFP分别与nestin、TH、GFAP 双染(+)细胞数,还有nestin(+),TH(+),GFAP(+)细胞数。
1.2.6 数据统计学处理SPSS 17.0作统计处理,数据以均数±标准差表示,统计学检验方法用单因素方差分析,P<0.05表明存在统计学意义,基因修饰干细胞细胞移植有一定治疗作用。
2 结果 2.1 PD大鼠模型260~280 g SD大鼠立体定向注射六羟多巴胺后。术后观察5~10 d后部分大鼠开始出现运动迟缓,尾高抬僵直、身体偏斜。术后7 d开始,腹腔注射APO可诱导向健侧(左侧)旋转行为。随时间点后移,向左侧旋转的大鼠数量增加,每min旋转圈数有明显增多。至术后6周模型成功数量及转圈次数稳定,以每分钟向左侧旋转次数≥7圈作为PD模型成功大鼠(表 1)。
| 表 1 术后腹腔注射阿朴吗啡诱导大鼠旋转行为学评分 Table 1 Apomorphine-induced rotational behavior scores in therats after cell transplantation |
用细胞移植前后旋转次数相对值比较移植前后的行为学变化,两个移植组PD大鼠旋转行为次数评分比对照组有改善,有统计学差异(P<0.01),GDNF基因修饰NSCs组较其他两组有统计学差异(表 2)。
| 表 2 细胞移植后APO诱导PD大鼠旋转行为评分 Table 2 Induced rotational behavior of the PD rat models after cell transplantation |
荧光显微镜下观察各组移植细胞存活、迁移情况,细胞停留于移植原位占多数,能够向周围脑组织迁移的细胞仅少数。GDNF基因修饰组较GFP基因修饰组存活细胞数多(图 1)。
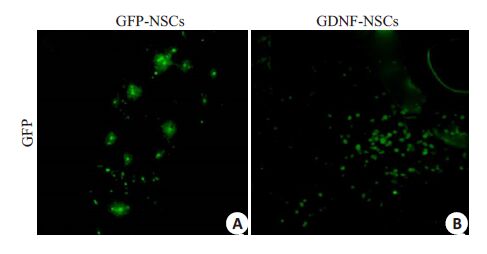
|
图 1 荧光显微镜观察移植细胞在纹状体内的存活及迁移 Figure 1 Fluorescence photomicrographs showing the survivaland migration of the transplanted cells in the striatum. Thetransplanted cells showed no obvious migration from thetransplantation site. A greater number of viable transplantedcells was found in the striatum in GDNF-NSCs group than inGFP-NSCs group (Original magnification: ×200). |
通过免疫组化染色可见,多数移植细胞未迁移也未分化(图 2),分化为胶质细胞较少(图 3),较少移植细胞能够分化为多巴胺能神经,相关文献也表明分化比例为3%~5%(图 4)。
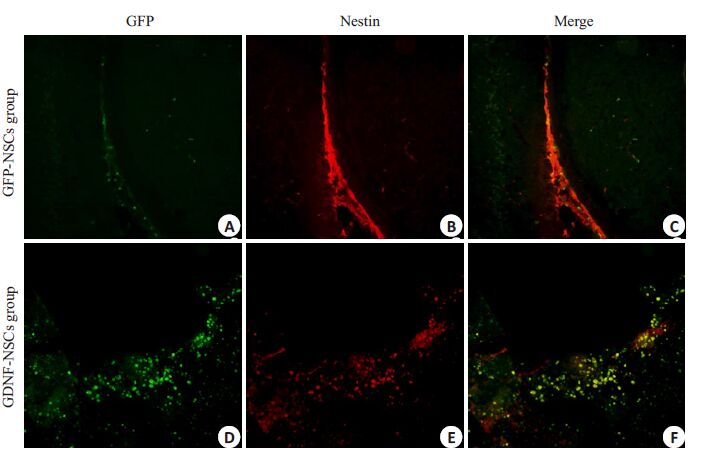
|
图 2 Nestin免疫荧光组织化学鉴定移植干细胞在纹状体内的定位 Figure 2 Nestin immunofluorescence staining showing the differentiation of the transplanted cellsin the striatum (Original magnification: ×200). Almost all the mNSCs remained undifferentiated(nestin positive,B,E) without migration (A,D). Te nestin-positive cells were more numerous inGDNF-NSCs group than in GFP-NSCs group. |
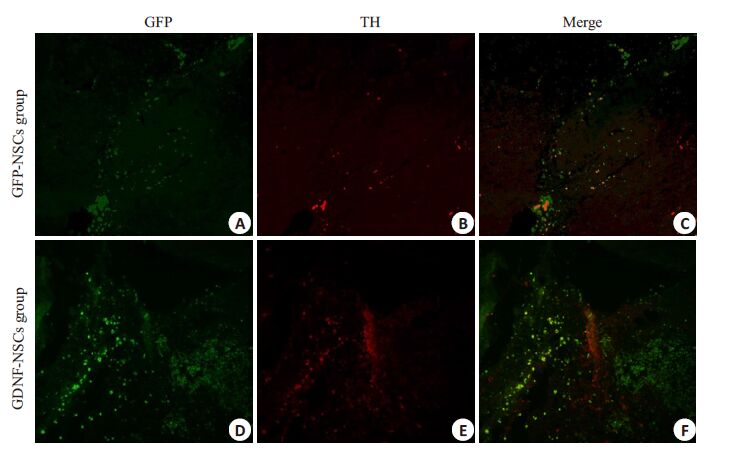
|
图 3 TH免疫荧光组织化学鉴定移植细胞在纹状体内的分化 Figure 3 TH immunofluorescence staining showing the differentiation of the transplanted cells inthe striatum (Original magnification: ×200). Only very few cells differentiated into dopaminergicneurons (TH positive,B,E),which were more numerous in GDNF-NSCs group than in GFPNSCsgroup. |
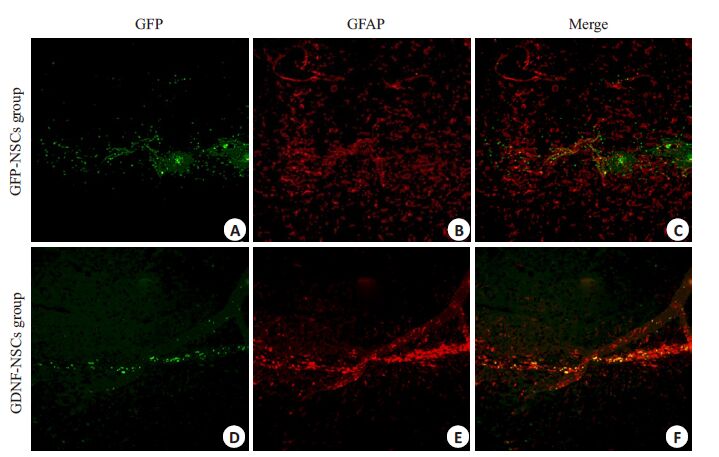
|
图 4 GFAP免疫荧光组织化学鉴定移植细胞在纹状体内的分化 Figure 4 GFAP immunofluorescence staining showing the differentiation of the transplanted cells inthe striatum (Original magnification: × 200). Some of the transplanted cells differentiated intoglial cells (GFAP positive,B,E). The number of GFAP-positive cells was greater in GFP-NSCsgroup than in GDNF-NSCs group. |
细胞计数处理,GDNF-NSCs 组GFP(+)、nestin(+)、TH(+)细胞数,均明显多于GFP-NSCs 组(P<0.01,表 3,4)。
| 表 3 纹状体区脑组织切片细胞计数结果 Table 3 Results of cell counting in the tissue sections of the striatum |
| 表 4 各组移植细胞分化情况 Table 4 Percentage of differentiation of the transplanted cells |
大鼠立体定向注射六羟多巴胺后建立帕金森病模型,并以阿朴吗啡诱导向左侧旋转,产生运动迟缓,肌强直,静止性震颤,步态和姿势异常,视为模型建立成功。帕金森病的发病机制,神经毒性备受关注,我们选择6-OHDA立体定向注射损毁DA与PD发病机制具有较高相似性,Daner等[18]研究表明GDNF本身除了对DA发育存活有特异保护作用外,还对神经元损毁物质比如6-OHDA,MPTP,甲基苯丙胺等有一定抵制作用,使GDNF成为重要目的基因。以下简述多巴胺能神经元损毁机制,6-OHDA 立体定向注射后对DA神经元具有选择性损毁作用,主要通过JNK/Bcl-2/Beclin-1信号途径损伤神经元[19-20]。帕金森病主要神经递质通路为黑质-纹状体DA通路,多巴胺能神经元损毁后引起受损侧多巴胺能神经递质水平下调,引起双侧调节不平衡。受损侧则发生代偿调节,主要是DA受体数量增加、敏感性增高。在多巴胺受体激动剂阿朴吗啡作用下,受损侧受体数量增多,高敏感造成对侧(健侧)肢体产生帕金森症状,运动迟缓,肌强直,双侧运动不能保持平衡引起向健侧旋转[21]。阿朴吗啡作为多巴胺能受体激动剂的一种,我们用APO诱导大鼠旋转作为PD大鼠模型建模成功以及给予相应治疗手段后治疗效果的一个行为学参考标准[22]。结果,术后7 d开始每周诱导,共诱导6周,大鼠旋转只数,及旋转次数有递增趋势,可能与神经元损毁有时间依赖有关。随时间推移帕金森病症状有加重趋势。也说明神经退行性疾病的不可逆性。3个细胞移植组,通过行为学观察,过表达GDNF基因组较其他两组旋转行为学有明显改善,随时间推移转圈次数有递减趋势,说明GDNF基因修饰过的mNSCs分泌GDNF为移植细胞存活并分化为多巴胺能神经元提供了良好的神经营养微环境,削弱损毁后残存于黑质-纹状体局部的DA神经元的进一步死亡,在神经元生长,分化,再生,突触形成发挥重要作用[23]。
神经干细胞表面无特异性标志物,因此主要通过特异性神经抗原的表达来鉴定:比如巢蛋白(nestin)、Musashi、转录因子、细胞粘附分子等,它的表达具有时序性,仅在胚胎发育早期神经上皮细胞中表达,即神经干细胞增殖形成神经球过程中表达,当分化为终末细胞时表达停止。因此我们选择nestin作为标志来鉴定神经干细胞[24]。多巴胺能神经元有多个表面标记,比如囊泡单胺转运体(VMAT2)、多巴胺转运体(DAT)、TH、Lmx1a 和Pitx3等,我们选用TH作为多巴胺能神经元的表面标记[25]。免疫光组织化学结果表明大多数移植的mNSCs,不发生迁移。推测mNSCs驻留于移植原位可能与PD大鼠纹状体局部分泌的细胞因子有关。此外,本研究还发现:大量巢蛋白免疫反应(+)GFP(-)细胞细胞移植部位,周围可以见到,我们推测内源性NSCs的可能性大,可能由纹状体或室管膜下区迁移而来,受纹状体局部以及移植细胞分泌的细胞因子诱导。GDNF-NSCs移植组Nestin(+)细胞数较GFP-NSCs移植组多,说明GDNF能够保证移植后的干细胞大部分存活,另外Nestin与TH特异细胞表面标记染色结果对比显示,仅有少量神经干细胞能够分化为多巴胺能神经元,但是令人感到欣慰的是,以GDNF过表达组多巴胺能神经元数量较其他两组明显。Du 等[9]用过表达GDNF的神经干细胞移植到猴的纹状体发现DA神经元重建,修复,分化均比单纯神经干细胞移植明显,我们的大鼠实验也证实了这个结论。在GDNF过表达组,GFAP(+)细胞数较GFP组少,GFAP是星形胶质细胞特异的细胞表面标记,也是神经胶质瘢痕的重要组成部分,Fitch等[26]人发现在龋齿动物中枢神经系统损伤实验中,Nogo-A ,GFAP等表达量增加,抑制了神经元轴突再生。也说明GDNF具有抑制胶质瘢痕形成,从而修复损伤,促进再生的作用。胶质细胞本身是一把双刃剑,不活化的胶质细胞可以分泌大量神经生长因子,激活的小胶质细胞在神经退化类疾病的发病机理中起到十分重要的作用,如帕金森病,多发性硬化和阿兹海默症等。他们是促炎因子和氧化应激的重要来源,如肿瘤坏死因子(TNF),一氧化氮,白介素等有神经毒性的物质,以加重神经损毁,相关研究表明可能与MAPK、JNK、PI3K 信号通路调节有关,最后启动炎症相关基因NF-kB的转导有关[27]。GDNF可以通过MAPK信号通路,降低缺氧损伤后水通道蛋白AQP4的表达,从而抑制细胞水肿,改善细胞活力,减少细胞死亡。GDNF还可以通过跨膜受体RET激活细胞内PI3K信号通路,调节多巴胺能神经元存活分化。说明在神经退行性疾病发生发展机制中,调节炎症信号的级联放大效应,GDNF发挥重要保护作用。
综上,本动物实验研究结果显示:GFP-mNSCs移植治疗PD大鼠模型效果明显,可明显改善运动障碍;GDNF-NSCs组与GFP-mNSCs组、对照组相比,有相对多的mNSCs 存活并分化为DA神经元;大多数移植mNSCs停留于移植原位,迁移很少;内源性NSCs向周围,移植区附近迁移,可能与移植的神经干细胞分泌一些相关细胞因子诱导有关,其机制还不清楚,有待研究。mNSCs移植治疗PD大鼠能够存活,也能够向多巴胺能神经元分化[28-29]。GDNF-NSCs组与GFP-NSCs组两组比较后,经过神经营养因子修饰后的神经干细胞在存活和分化数量上都比没有神经营养因子修饰过的干细胞多。说明局部微环境的重要性,GDNF是微环境中的重要成员,发挥作用如前所述。
神经干细胞移植微环境单靠GDNF改善远远不够,还有其他基因诸如TH、Nurr1、VHL基因等。神经干细胞移植受移植微环境,以及移植靶点周围胶质细胞介导的炎症反应,血管微环境变化,细胞本身存活再生能力,生长促进因子不足,生长抑制因子、炎症凋亡因子产生级联放大效应,使神经干细胞难以突破重重障碍而远期存活[7]。另外神经干细胞虽然具有极强分化潜能,但是向多巴胺能神经元分化极少。这使得干细胞移植面临巨大挑战,还有很长的路要走。
近年来,通过特异的神经元移植治疗神经系统退行性病变如PD病一直是国际研究热点。就联合细胞移植治疗来说,基因表达不稳定以及成瘤性,致癌问题尚不明确;移植后细胞在体内存活、分化、整合及排斥问题影响移植细胞长期存活的因素还有很多,比如胶质细胞微环境,移植细胞受定植部位胶质瘢痕影响分化生长受限炎症介质;相关级联放大效应等机制尚有待发现,多巴胺能神经元分化机制不明,干细胞分化受多基因影响,分化程度不一,很难达到理想分化为状态;另外移植物抗宿主或是宿主抗移植物,以及移植后细胞崩解坏死所诱发正常组织细胞产生死亡基因,影响正常组织细胞的存活。随着研究的深入,分子生物学的不断发展,相信在不远的将来,这些难题会迎刃而解,将会为PD的治疗提供一个全新的途径,给患者及家庭带来福音。
| [1] | Rinalduzzi S, Trompetto C, Marinelli L, et al. Balance dysfunctionin Parkinson's disease[J]. Biomed Res Int,2015, 15 (8) : 434683. |
| [2] | Lin CH, Lin JW, Liu YC, et al. Risk of parkinson's diseasefollowing anxiety disorders: a nationwide population-based cohortstudy[J]. Europ J Neurol,2015, 22 (9) : 1280-7. DOI: 10.1111/ene.2015.22.issue-9. |
| [3] | Johnson KE. Approach to the patient with Parkinson disease[J]. Prim Care,2015, 42 (2) : 205-15. DOI: 10.1016/j.pop.2015.01.005. |
| [4] | Vardy ER, Teodorczuk A, Yarnall AJ. Review of delirium in patientswith Parkinson's disease[J]. J Neurol,2015, 262 (11) : 2401-10. DOI: 10.1007/s00415-015-7760-1. |
| [5] | Jenner P. Treatment of the later stages of Parkinson's diseasepharmacologicalapproaches now and in the future[J]. TranslNeurodegener,2015, 4 (3) : 3. |
| [6] | Qureshi AA, Cheng JJ, Sunshine AN, et al. Postoperative symptomsof psychosis after deep brain stimulation in patients withParkinson's disease[J]. Neurosurg Focus,2015, 38 (6) : E5. DOI: 10.3171/2015.3.FOCUS1523. |
| [7] | Le Grand JN, Gonzalez-Cano L, Pavlou MA, et al. Neural stemcells in Parkinson's disease: a role for neurogenesis defects in onsetand progression[J]. Cell Mol Life Sci,2015, 72 (4) : 773-97. DOI: 10.1007/s00018-014-1774-1. |
| [8] | Deng X, Liang Y, Lu H, et al. Co-Transplantation of GDNFOverexpressingneural stem cells and fetal dopaminergic neuronsmitigates motor symptoms in a rat model of parkinson's disease[J]. PLoS One,2013, 8 (12) : e80880. DOI: 10.1371/journal.pone.0080880. |
| [9] | Du J, Gao X, Deng L, et al. Transfection of the glial cell linederivedneurotrophic factor gene promotes neuronal differentiation[J]. Neural Regen Res,2014, 9 (1) : 33-40. DOI: 10.4103/1673-5374.125327. |
| [10] | Cheng S, Ruan H, Yang Z, et al. Construction and identification ofrat GDNF gene recombinant retroviral vector and gene transfectionto NSC[J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2008, 25 (3) : 642-6. |
| [11] | Wang F, Kameda M, Yasuhara T, et al. GDNF-pretreatmentenhances the survival of neural stem cells following transplantationin a rat model of Parkinson's disease[J]. Neurosci Res,2011, 71 (1) : 92-8. DOI: 10.1016/j.neures.2011.05.019. |
| [12] | Nam H, Lee KH, Nam DH, et al. Adult human neural stem celltherapeutics: Current developmental status and prospect[J]. World JStem Cells,2015, 7 (1) : 126-36. DOI: 10.4252/wjsc.v7.i1.126. |
| [13] | Shi Y, Zhou L, Tian J, et al. Transplantation of neural stem cellsoverexpressing glia-derived neurotrophic factor promotes facialnerve regeneration[J]. Acta Otolaryngol,2009, 129 (8) : 906-14. DOI: 10.1080/00016480802468153. |
| [14] | Shamloo A, Heibatollahi M, Mofrad MR. Directional migration anddifferentiation of neural stem cells within three-dimensionalmicroenvironments[J]. Integr Biol (Camb),2015, 7 (3) : 335-44. DOI: 10.1039/C4IB00144C. |
| [15] | 邓兴力. 神经干细胞联合多巴胺神经元移植治疗帕金森病的实验研究: 昆明医学院[D], 2008. |
| [16] | 邓兴力, 王应莉, 杨智勇, 等. SPIO、EGFP双标GDNF基因修饰中脑神经干细胞移植治疗帕金森病[J]. 中风与神经疾病杂志,2010, 27 (2) : 109-13. |
| [17] | 邓兴力, 雷德强, 刘如恩, 等. 帕金森病大鼠模型的建立[J]. 广东医学,2012, 33 (3) : 313-5. |
| [18] | Tabu H, Aso T, Matsuhashi M, et al. Parkinson's disease patientsshowed delayed awareness of motor intention[J]. Neurosci Res,2015, 95 (5) : 74-7. |
| [19] | Zhang S, Gui XH, Huang LP, et al. Neuroprotective effects ofβ-Asarone against 6-Hydroxy Dopamine-Induced parkinsonism viaJNK/Bcl-2/beclin-1 pathway[J]. Mol Neurobiol,2014, 11 (18) : 0893-7648. |
| [20] | Im HJ, Hwang do W, Lee HK, et al. In vivo visualization andmonitoring of viable neural stem cells using noninvasivebioluminescence imaging in the 6-hydroxydopamine-inducedmouse model of Parkinson disease[J]. Mol Imaging,2013, 12 (4) : 224-34. |
| [21] | Zheng L, Wang H, Ba YY, et al. Protective effect of alkaloids fromPiper longum in rat dopaminergic neuron injury of 6-OHDAinducedParkinson's disease[J]. Zhongguo Zhong Yao Za Zhi,2014, 39 (9) : 1660-5. |
| [22] | Zhao L, Verhagen-Metman L, Kim JH, et al. EMG activity andneuronal activity in the internal globus pallidus (GPi) and theirinteraction are different between hemiballismus and apomorphineinduced dyskinesias of Parkinson's disease (AID)[J]. Brain Res,2015, 1603 (3) : 50-64. |
| [23] | Park HJ, Bolton EC. Glial cell line-derived neurotrophic factorinduces cell proliferation in the mouse urogenital sinus[J]. MolEndocrinol,2015, 29 (2) : 289-306. |
| [24] | Hoffman RM. Nestin-expressing hair follicle-accessible pluripotentstem cells for nerve and spinal cord repair[J]. Cells Tissues Organs,2014, 200 (1) : 42-7. |
| [25] | Arenas E, Denham M, Villaescusa JC. How to make a midbraindopaminergic neuron[J]. Development,2015, 142 (11) : 1918-36. DOI: 10.1242/dev.097394. |
| [26] | Fitch MT, Silver J: CNS injury, Glial S. And inflammation:inhibitory extracellular matrices and regeneration failure[J]. ExpNeurol,2008, 209 (2) : 294-301. |
| [27] | Hoang QQ. Pathway for parkinson disease[J]. Proc Natl Acad SciUSA,2014, 111 (7) : 2402-3. DOI: 10.1073/pnas.1324284111. |
| [28] | Tereshchenko J, Maddalena A, B?hr M, et al. Pharmacologicallycontrolled, discontinuous GDNF gene therapy restores motorfunction in a rat model of Parkinson's disease[J]. Neurobiol Dis,2014, 65 (4) : 35-42. |
| [29] | Tan KK, Tann JY, Sathe SR, et al. Enhanced differentiation ofneural progenitor cells into neurons of the mesencephalicdopaminergic subtype on topographical patterns[J]. Biomaterials,2015, 43 (8) : 32-43. |
 2016, Vol. 36
2016, Vol. 36

