随着对肝癌病理生理认识的深入,肝细胞肝癌沿肝段门静脉分支在荷瘤肝段内播散的特征决定解剖性肝切除成为肝癌肝切除最理想术式[1]。解剖性肝切除要求肝脏切除范围遵循门静脉三级分支的灌注区域以及一定的肝切除平面进行肝实质的离断,因此,术前对门静脉三级分支的深入了解是解剖性肝切除的前提[2]。左肝门静脉走形和分布较为简单,解剖性左肝病灶切除也较为容易,相比之下,右肝肝内血管结构复杂,变异多见,目前对右肝门静脉三级分支辅助肝切除研究较少,且肝切除主要基于Couniaud分段方法,划分出来的肝段并不是门静脉支配的基本单元,难以达到解剖性肝切除的要求[3-4]。随着三维重建虚拟软件的快速发展,人体器官的快速分割和重建实现了组织器官的三维可视化观察及量化分析,为肝内血管解剖和肝脏分段研究提供了全新的技术方法。基于三维可视化技术门静脉流域的肝脏分段方法可辅助解剖性肝切除术进行肿瘤肝段定位、肝段边界界定,有利于解剖性肝切除术的精准实施。本研究采用三维可视化软件MI-3DVS进行健康人体肝脏及其血管的三维重建,研究右半肝门静脉系统的立体分布规律并进行右肝门静脉的3D分型,为右肝内病灶的解剖性肝切除和个体化肝脏分段提供解剖学依据。
1 资料和方法 1.1 研究对象收集我院2015年3月~2015年5月226例体检人员上腹部增强CT影像资料。根据CT检查,纳入如下人群:(1)无肝脏占位性病变;(2)无门静脉栓塞;(3)CT成像质量较高,可观察到门静脉3~4级分支;(4)无罕见变异,如门静脉左支缺如或右支缺如。最终入选83例,其中男性45例,女性37例,年龄10~85岁,平均45.5岁。
1.2 CT扫描及数据采集方法所有数据采用256排螺旋CT扫描,采集患者平扫期、动脉期、门脉期、静脉期四期薄层CT数据,具体扫描参数及方法参见文献[5]。
1.3 三维重建将薄层CT数据导入笔者单位自行研发的三维可视化软件-腹部医学图像(MI-3DVS),以门静脉期数据分割重建门静脉和肝脏,静脉期数据重建肝静脉。三维可视化的多维观察右肝门静脉及其分支的数量、分布范围、立体走向,与肝右静脉和肝中静脉及其重要属支的空间位置关系,寻找右肝门静脉系统的分布规律,进一步统计分析后进行3D可视化分型。
1.4 个体化肝脏分段根据肝脏三级门静脉分支及其流域的边界,利用MI-3DVS软件自带的分段模块,采用最近邻域近似分割算法划分出各个门静脉三级分支所对应肝段在肝脏表面和内部的分布范围和界限[6]。
2 结果 2.1 三维重建结果门静脉3D模型结构清楚,形态逼真,立体感强,可精确显示到门静脉的4级分支。分布、走行以及与肝静脉相互关系清晰,能够真实反应个体化门静脉和肝静脉分支解剖结构。
2.2 全肝门静脉分型结果参考Cheng[7]和Atri[8]的分型标准:Ⅰ型,普通型,即门静脉主干分出左支、右支,右支再分为右前支和右后支,共有69例(83.1%);Ⅱ型,三叉型,即门静脉主干于肝门处呈三叉状分为左支,右前支和右后支,共有8例(9.6%);Ⅲ型,门静脉主干由肝门处先分出右后支,继续向上行分为右前支和左支,共有3例(3.6%);Ⅳ型,门静脉主干先分出右后支和左支,继续向左前的左支再分出右前支,共有3例(3.6%)。
2.3 门静脉右前支与肝右静脉和肝中静脉的空间关系门静脉P8 分支向右越过肝右静脉共有72 例(86.7%),未越过肝右静脉11例(13.3%),其中因出现粗大肝短静脉导致肝右静脉短小未越过共有5例(6%)。门静脉P8分支向左越过肝中静脉共有57例(68.7%)。
2.4 右半肝门静脉分支分型结果参考Couinaud肝脏分段的概念,将肝中静脉和下腔静脉连接面以及肝右静脉和下腔静脉连接平面之间为分界面,将右肝分为右前扇区和右后扇区。观察两个扇区内门静脉空间分布规律。根据门静脉右支主干横截面水平区分P5和P8,P6和P7,观察P5、P8、P6、P7的起源、数量及空间分布,进一步归纳分析,建立右肝门静脉的如下3D分型。
2.4.1 P5门静脉分支,分为5型A型(图 1A),P5来自于右前支主干,与P8共干,向前下方分布,由一支或几支粗大主干组成,其主干进一步分出分支分别供应S5腹侧段和背侧段,共有16例(19.3%);B型(图 1B),右前支主干向上前方走形一段距离后,部分分支折向下前方,供应S5血供。即P5无三级分支主干,全部来自于P8的腹侧段和或背侧段向前下方走形的分支,此型共有5例(6%);C型(图 1C),A型+B型,此型P5由两部分组成,一部分来自于右前支发出的向前下方走形的粗大主干,另一部分来自于P8的腹侧段或背侧段向前下方发出的分支,共有30例(36.1%);D型(图 1D):P5来自门静脉右支主干,分布于前扇区的下前方,P8与右后支共干分布于前扇区的上前方。即门静脉右支主干没有分出右前支,而是从主干发出向前下方走形的P5,共有7 例(8.5%);E型(图 1E):P5部分分支来自右后支,即来自于右后支主干的门静脉分支参与S5的肝段血液供应,共有25例(30.1%)。
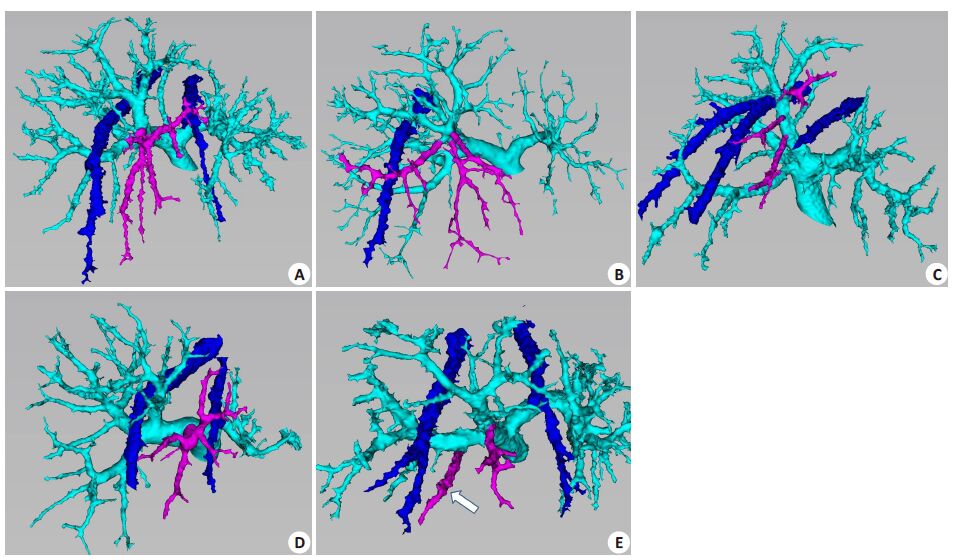
|
图 1 P5门静脉3D分型 Figure 1 3D classification of the P5 branches of the portal vein. The portal vein is tinted in green,the right and middle hepatic veins are tintedin blue,and the P5 branches in purple. A: P5 branches from the trunk of the right paramedian sector; B: P5 branches from the dorsal andventral branches of P8; C: P5 branches from the trunk of the RPMS and branches of P8; D: P5 branches directly from the trunk of the rightportal vein; E: P5 branches originating partly from the trunk of the right lateral sector (arrow). |
日本学者Takayssure[9]认为P8常有背侧支,腹侧支,前侧支,后侧支4个分支组成。前侧支发自背侧支,向前外方走形,后侧支发自门静脉右前支主干,直径较背侧支、腹侧支稍细,向后方走形。背侧支和腹侧支以前裂静脉(肝中静脉Ⅷ段分支)为界限,背侧支常向右越过并回流入肝右静脉。通过门静脉右前支的三维重建和各四级分支的立体走向观察,我们发现P8组成并非简单的背侧支和腹侧支,其组成多变。我们将其总结归纳为以下四种3D分型(图 2)。A型,背侧支+腹侧支,共有29例(34.9%);B型,背侧支+腹侧支+前侧支,共有29例(34.9%);C型,背侧支+腹侧支+后侧支,共有10例(12.1%);D型,背侧支+腹侧支+前侧支+后侧支,共有15例(18.1%)。A型为P8基本分型,B、C、D三型均在A型基础上构成。
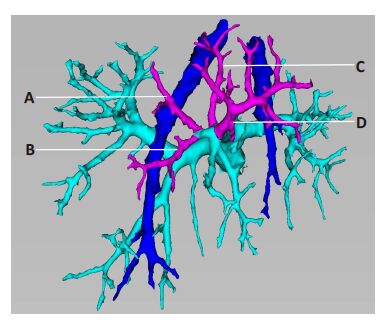
|
图 2 P8门静脉3D分型 Figure 2 3D branching types of the P8 branches. Portal veinis tinted in green,the right and middle hepatic veins inblue,and P8 branches in purple. A: Dorsal branch; B:Anterior branch; C: Posterior branch; D: Ventral branch. |
A型(图 3A),P6发自右后支主干,与P7共干,其四级分支分别向右下方、右上方分布,共有35例(42.2%);B型(图 3B),P6发自右支主干,与P7不共干,直接从门静脉右支主干发出,其四级分支分别向右下方、右上方分布,共有12例(14.5%);C型(图 3C),P6与P7共干组成的门静脉右后支主干呈弓状走向右外,向右下方发出数支尾侧分支组成P6,头侧分支组成P7,P6、P7无明显的界限,共有33例(39.7%);D型(图 3D),P6来自于向右下方走形的右前支分支,自肝右静脉前方跨越,分布于肝脏右后下方区域,而门静脉右后支无明显发往右后下方的分支,共有3 例(3.6%)。
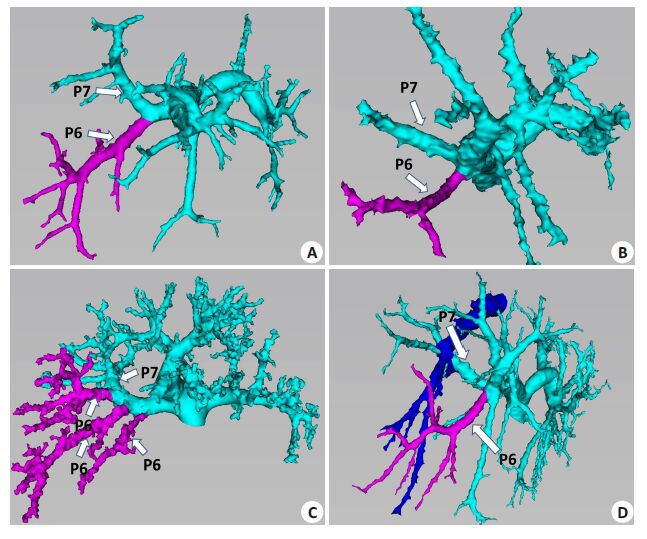
|
图 3 P6门静脉3D分型 Figure 3 3D branching types of P6 branches. The portal vein is tinted in green,the righthepatic vein in blue,and the P6 branches in purple. A: P6 branches from the trunk of theright lateral sector; B: P6 branches directly from the right portal vein without formation ofthe trunk of the right posterior portal vein; C: P6 were the caudal branches of the archingright posterior portal vein; D: P6 branches from the right paramedian sector. |
A型(图 4A),P7发自门静脉右后支主干,与P6共干,分别向右上方、右下方发出,共有27例(32.5%);B型(图 4B),P7发自门静脉右支主干,与P6不共干,P7、P6分两支直接从门静脉右支主干向右上方、右下方分别发出,共有11例(13.3%);C型(图 4C),P7、P6共干组成门静脉右后支主干,呈弓状走向右外,P7为向右上方走形的弓状右后支门静脉的头侧支,共有27例(32.5%);D型(图 4D),门静脉右后支主干在发出向右下方和右上方走形的P6、P7后,另有一发自右后支主干,向右后上方走形的较粗的分支,共同供应右后上区血供,即P7为不共干的两主要分支组成,有4例(4.8%);E型(图 4E),P7分为两主要分支,门静脉右后支主干在发出向右下方和右上方走形P6、P7后,仍有一发自该P7供应右后上区的直径较粗的分支,共同供应右后上区血供,即P7由共干的两主支组成,共有12例(14.5%);F型(图 4F),与D型类似,但组成右后上区血供的P7的其中一支发自门静脉左右支分叉处,共有2例(2.4%)。
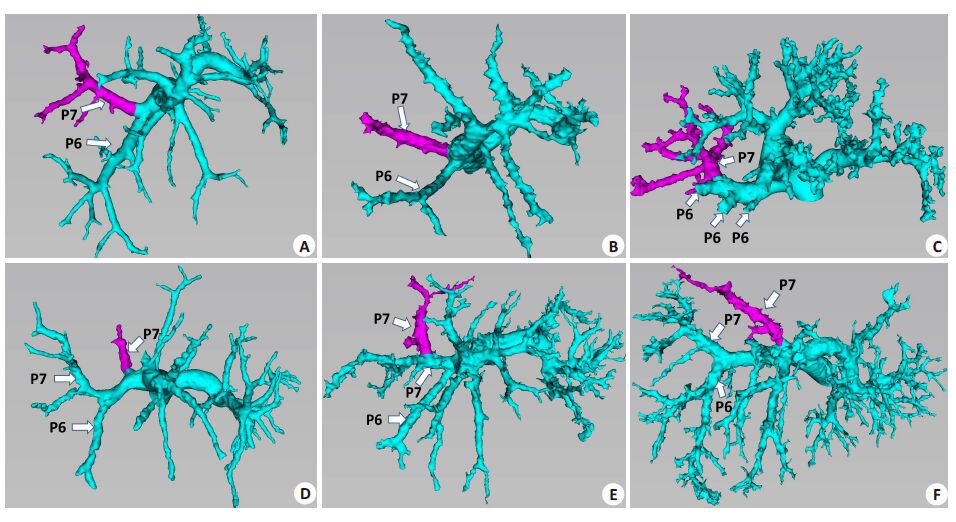
|
图 4 P7门静脉分支类型 Figure 4 3D branching types of P7. Portal vein is tinted in green and P7 branches in purple. A: P7 branches from the trunk of the right lateralsector; B: P7 branches from the trunk of the right portal vein. C: P7 were the headward branches of the arching right posterior portal vein;D: A P7 branch from the trunk of the right posterior portal vein; E: A P7 branch from P7; F: A P7 branch from the crotch of the left and rightportal vein. |
根据门静脉三级分支的立体走向及其属支所支配分布的肝内血流分布流域,完成了个体化的肝脏分段(图 5)。
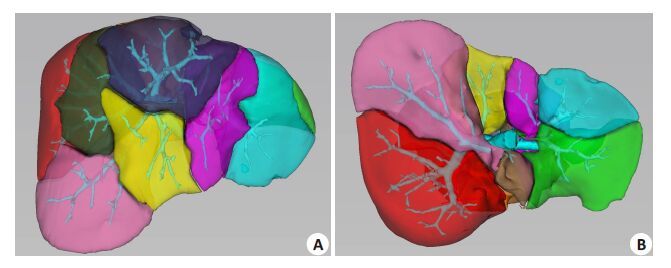
|
图 5 基于门静脉三级分支的计算机辅助肝脏分段 Figure 5 Computer-assisted liver segmentation based on the third-order portal branches. A:Diaphragmatic surface view; B: Visceral surface view. |
随着精准肝切除理念的深入和外科手术水平的提高,对肝段和亚肝段的解剖性肝切除已成为肝脏外科的理想术式。解剖性肝切除术是指在切除荷瘤肝段门静脉的前提下,切除肿瘤及其所在肝段,减少肿瘤沿门静脉播散同时减少术中出血,尽可能的保留功能性的肝组织[10-12]。除了术中精细操作和术中B超、美兰染色等辅助定位技术的应用外,术前对肝脏体积分析、病灶所在肝段位置、门静脉和肝静脉与病灶的三维解剖等更为重要,关系到手术能否实施,手术方案的制定及手术风险的防范等。因此,精准的术前影像学资料获取和评估是进行解剖性肝切除必不可少前提。肝脏及其血管的三维重建和可视化观察是目前最为先进的影像学评估手段,是精准肝切除必不可少的组成部分。
本组研究发现,全肝门静脉分型以Ⅰ型为主,共有69例(83.1%);三叉型即Ⅱ型有8例(9.6%),少见的门静脉变异情况即Ⅲ、Ⅳ型分别有3例。因此行Gllission蒂鞘外阻断法解剖性肝切除应注意Ⅲ、Ⅳ型变异的情况,避免造成灾难性后果,而Gllission鞘内解剖门静脉分支则相对安全。门静脉P8分支向右越过肝右静脉共有72例(86.7%),向左越过肝中静脉共有57例(68.7%),也提示行右前叶切除时,部分缺血线越过肝中或肝右静脉,对肝硬化患者需术前精确体积计算观察门静脉右前支与肝右静脉和肝中静脉的空间关系,预留足够肝脏体积,避免术后肝功能不全。
左肝门静脉解剖相对恒定,左肝门静脉横部向左后上行走至角部分出Ⅱ段分支,转向左前上的失状部分别向左右发出Ⅲ段和Ⅳ段分支。但右肝解剖位置深,表面无明显分界标志,且右肝门静脉分布、走形复杂,变异较多,因此解剖性右肝切除较左肝难度更大。而术前的门静脉3D分型,对手术方案的设计和手术入路的规划具有指导意义。
从我们对P5分支的情况观察可以发现,P5分型中最多的是C型,即来自右前支的粗大主干和来自于P8的分支组成,因此,在施行S8的切除时,很容易造成P5的损伤,导致术后S5段的缺血。对于P5分型为E型的病例,即P5分支来自于门静脉右后支的情况,若术前行右后叶切除而没有注意保留P5的分支,术后同样可能造成S5段的缺血。对于P5分型为D型的,即P5、P8分别从门静脉右支主干单独分出的病例,若拟行右前叶的肝切除,传统肝外Gllission蒂阻断右前支门静脉的方法则无法实现,需切开部分肝实质,分别阻断。对于从共干发出P6、P7(P6 A型,P7 A型)的施行右后叶切除相对较容易,但是对于P6和P7没有形成共干(P6 B型,P7 B型),特别是P7在肝门深部时,一并处理比较困难,只能分别结扎,增加了手术的难度。对于P6为D型,即P6门静脉分支呈放射状辐射发出的病例,从肝门方向采用结扎Gllission蒂的方法施行解剖性右后叶切除可行,但对解剖性S6和S7段的肝切除则基本无法实现,因为S6和S7无明显界限,需逐支结扎才能实现S6段切除,而S7段切除则更加困难。S8是进行解剖性肝段切除和肝亚段切除术较多的一个肝段,然而S8位置深,供应血管多且复杂,解剖性S8段肝切除实施的要求是肝切除后的切面需暴露肝右静脉、肝中静脉、P8断端[13-14]。不同于传统Couniaud分段方法,从肝静脉回流角度将S8分为腹侧段和背侧段更易实施解剖性肝切除,背侧段主要由肝右静脉回流,腹侧段主要由肝中静脉回流,两亚段之间由前裂静脉回流。另一方面,若肿瘤位于背侧段或腹侧段,只需切除相应的门静脉属支供应的肝段,无需S8段的全部切除,最大限度的增加了剩余肝脏功能体积。
肝段门静脉3D分型不仅可指导解剖性肝切除术的实施,而且为计算机辅助肝脏分段提供理论依据,用于指导制定实际手术方案。传统Couinaud肝分段是基于离体肝铸型的结果,虽然被广泛接受,但仍不免具有局限性[15]。我们研究结果表明,86.7%的P8背侧支常向右越过肝右静脉,延伸至其后方,支配标准Couinaud 肝段中S7 的一部分,导致S7和S8的边界难以界定,若按照Couinaud分段方法,势必将S8的部分肝脏区域划分到S7,其结果是造成S8的实际区域偏小,导致术前评估出现误差,行右前叶或S8肝切除时,超越肝右静脉的S8段肝组织将缺血,出现术后残肝功能障碍。对于S6和S7界限的区分,当门静脉右后支呈向后上方走形的P7主干和向后下方走形的P6 主干时,较易区分S6 和S7 界限;但对于P6 C型和P7 C型者(39.7%),P6和P7共干,其头侧支和尾侧支放射状分布在肝实质深面,Couinaud分段法则无法准确划分S6和S7肝内的边界。对于P6血供来自右前支分支(P6 D型)以及P5来自右后支(P5E型)情况,Couinaud 肝段划分法也不能真实反映肝脏解剖,均会导致影像学定位病变出错和误导术式选择。笔者单位设计MI-3DVS软件的分段模块是基于门静脉的三级血管主干分支来进行计算机辅助的肝段划分,各肝段的形态、大小及与相邻肝段的分界由门静脉三四级分支的实际血流拓扑流域来决定。肝分段的处理步骤主要包括:门静脉血管中心线提取,门静脉血管中心线标记,以及根据标记的中心线进行肝段划分[6]。而保证肝分段正确性的前提是准确的肝段门静脉标记。本研究通过观察右半肝各肝段门静脉分支分布、变异规律指导门静脉中心线的标记,有效避免Counauid分段结果与实际解剖结构不一致的现象。按照门静脉3级分支数量划分若干个肝段,肝实质内各段间界面为不规则曲面,肝表面分界为波浪状曲线,更符合实际肝脏分界。
综上所述,基于计算机3D技术的肝脏门静脉分割重建,构建了忠于患者实际解剖的门静脉三维立体模型以及基于门静脉三级分支的肝分段方法,为解剖性肝切除术的实施提供了形态学依据。以3D分型为依据,结合个体化肝脏分段技术,有助于右肝解剖性肝段和亚肝段切除的顺利实施。
| [1] | Shindoh J, Makuuchi M, Matsuyama Y, et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepatocellular carcinoma[J]. J Hepatol,2015, 23 (15) : 168. |
| [2] | Fujimoto J, Hai S, Hirano T, et al. Anatomic liver resection of right paramedian sector: ventral and dorsal resection[J]. J Hepatobiliary Pancreat Sci,2015, 22 (7) : 538-45. DOI: 10.1002/jhbp.v22.7. |
| [3] | Shindoh J, Mise Y, Satou S, et al. The intersegmental plane of the liver is not always flat--tricks for anatomical liver resection[J]. Ann Surg,2010, 251 (5) : 917-22. DOI: 10.1097/SLA.0b013e3181d773ae. |
| [4] | Majno P, Mentha G, Toso C, et al. Anatomy of the liver: an outline with three levels of complexity--a further step towards tailored territorial liver resections[J]. J Hepatol,2014, 60 (3) : 654-62. DOI: 10.1016/j.jhep.2013.10.026. |
| [5] | Fang CH, Liu J, Fan YF, et al. Outcomes of hepatectomy for hepatolithiasis based on 3-dimensional Reconstruction technique[J]. J Am Coll Surg,2013, 217 (2) : 280-8. DOI: 10.1016/j.jamcollsurg.2013.03.017. |
| [6] | 叶建平, 范应方, 郭李云. 一种半自动的肝脏分段方法及三维可视化实 现[J]. 中国数字医学,2014 (11) : 57-9. |
| [7] | Cheng YF, Huang TL, Lee TY, et al. Variation of the intrahepatic portal vein; angiographic demonstration and application in living-related hepatic transplantation[J]. Transplant Proc,1996, 28 (3) : 1667-8. |
| [8] | Atri M, Bret PM, Fraser-Hill MA. Intrahepatic portal venous variations: prevalence with US[J]. Radiology,1992, 184 (1) : 157-8. DOI: 10.1148/radiology.184.1.1609075. |
| [9] | Takayasu K, Moriyama N, Muramatsu Y, et al. Intrahepatic portal vein branches studied by percutaneous transhepatic portography[J]. Radiology,1985, 154 (1) : 31-6. DOI: 10.1148/radiology.154.1.3964948. |
| [10] | Makuuchi M, Hasegawa H, Yamazaki S. Ultrasonically guided subsegmentectomy[J]. Surg Gynecol Obstet,1985, 161 (4) : 346-50. |
| [11] | 蔡守旺, 杨世忠, 孟翔飞, 等. 三维重建技术联合持久美蓝染色法在精 准解剖性肝切除术中的应用[J]. 中华消化外科杂志,2012, 11 (6) : 511-3. |
| [12] | Cristino H, Hashimoto T, Takamoto T, et al. Advanced concept of anatomic resection of the liver: preservation of subsegment during right paramedian sectoriectomy[J]. J Am Coll Surg,2012, 214 (2) : e5-7. DOI: 10.1016/j.jamcollsurg.2011.10.018. |
| [13] | Takamoto T, Hashimoto T, Ogata S, et al. Planning of anatomical liver segmentectomy and subsegmentectomy with 3-dimensional simulation software[J]. Am J Surg,2013, 206 (4) : 530-8. DOI: 10.1016/j.amjsurg.2013.01.041. |
| [14] | Ahn KS, Kang KJ, Park TJ, et al. Benefit of systematic segmentectomy of the hepatocellular carcinoma: revisiting the dye injection method for various portal vein branches[J]. Ann Surg,2013, 258 (6) : 1014-21. DOI: 10.1097/SLA.0b013e318281eda3. |
| [15] | Bismuth H. Revisiting liver anatomy and terminology of hepatectomies[J]. Ann Surg,2013, 257 (3) : 383-6. DOI: 10.1097/SLA.0b013e31827f171f. |
 2016, Vol. 36
2016, Vol. 36
