2. 南方医科大学基础医学院细胞生物学教研室, 广东 广州 510515
2. Department of Cell Biology, School of Basic Medical Sciences, Southern Medical University,Guangzhou 510515, China
肥胖是由于体内脂肪细胞体积增大或脂肪细胞数量增加,使体内脂肪聚集增多导致的代谢紊乱疾病。根据世界卫生组织估计世界范围内约有31 亿肥胖患者[1]。由于肥胖与许多代谢疾病包括动脉粥样硬化、高血压、2型糖尿病、非酒精性肝脏疾病和某些类型癌症密切相关[2-3],因此肥胖的流行是极其令人担忧。尽管肥胖发生的明确病因和机制依然让人捉摸不定,然而研究表明早期脂肪组织的发育在肥胖的发生发展中扮演重要作用。有证据表明在儿童和青少年时期脂肪细胞数量已固定而且到成年也保持不变,表明早期发育环境对脂肪组织形成的作用对肥胖的发生具有长期重要的影响[4];而且许多肥胖和超重儿童最后都发展为成人肥胖[5]。因此寻找一种早期发育阶段的肥胖动物模型对于研究早期脂肪组织形成在肥胖中的作用是具有重要意义。作为脊椎动物,斑马鱼拥有许多与人类相似的结构,而且斑马鱼基因组与人类基因组具有高度的同源性,因此斑马鱼已经被用于模拟许多的人类疾病[6-13]。但是运用斑马鱼幼鱼建立肥胖模型目前并没有被报道过,而且斑马鱼幼鱼具有透明可见性的特性,因此可以应用脂质荧光染料尼罗红对其体内脂肪组织进行标记和成像。因此本研究目的是通过饮食喂养方法诱导建立斑马鱼幼鱼肥胖模型,并且通过生化和组织学、尼罗红染色方法证实斑马鱼肥胖的发生,从而为早期肥胖的发病机理和治疗肥胖药物的筛选提供实验模型。
1 材料和方法 1.1 材料 1.1.1 实验动物野生型AB斑马鱼由南方医科大学生命科学院细胞生物教研室斑马鱼实验室提供。斑马鱼按照Westerfield方法进行饲养,14 h照明,10 h黑暗,定时喂养。
1.1.2 实验主要试剂及仪器油红O和尼罗红(sigma);苏木素和伊红(华俊医疗器械公司);Tricane(sigma);无水乙醇和1,2-丙二醇(广东华光化学厂);幼鱼喂养饲料Larval AP100(Zeigler);甘油三酯和总胆固醇检测试剂盒(南京建成生物制品公司);光学显微镜和荧光显微镜(日本OLYMPUS公司);酶标仪(BIO RAD)。
1.2 方法 1.2.1 斑马鱼饲养在体式显微镜下筛选发育正常的受精后第5天的幼鱼,随机分成喂养量30 mg/d组(正常喂养组)和180 mg/d组(过度喂养组),每组100条鱼,放入装有1.5 L斑马鱼培养用水的水缸中,使其适应深水环境1 d。从受精后第7 天(7 dpf)开始喂养,每天喂养3次,喂养完后2 h换一半水,喂养20 d。
1.2.2 体质量、体长和体质量指数(BMI)测量用0.02%Tricane将幼鱼麻醉,用吸水纸将幼鱼表面水吸干,在天平中称量体质量。用游标卡尺测量幼鱼头部最前端到鱼尾最末端距离,这段长度代表幼鱼体长,BMI为体质量(mg)除以体长(mm)的平方所得的数值。
1.2.3 整体油红O染色4%多聚甲醛固定斑马鱼幼鱼3 d 之后,PBS 冲洗2 次,依次按100%、80%、60%、40%不同浓度1,2-丙二醇分别处理幼鱼20 min,加入新鲜配制0.5%油红O染液,避光常温染色12 h,随后用100% 1,2-丙二醇浓液去背景色,80% 1.2-丙二醇4 ℃中保存,显微镜下观察统计斑马鱼幼鱼肝脏脂肪变性情况(肝脏染色呈红色或许多红点,边界与周围组织清晰评判为脂肪变性)并拍照记录。
1.2.4 石蜡切片制作4%多聚甲醛固定幼鱼4 d后,PBS冲洗几次,不同浓度酒精脱水,二甲苯透明,石蜡浸透和石蜡包埋,制成石蜡标本,在石蜡切片机上切取5μm厚度蜡片。
1.2.5 HE染色即苏木素-伊红染色,石蜡切片常规脱蜡至水化,苏木素染色7 min,自来水冲洗,温水蓝化1 min,浸入1%盐酸酒精中分化60 s 左右,之后放入伊红染液中染色5 min,梯度酒精脱水,二甲苯透明,中性树脂封片。显微镜下观察肝脏病理变化,并拍照保存。
1.2.6 尼罗红活体标记和成像中性脂质实验用丙酮配制2 mg/mL尼罗红母液,避光-20 ℃保存。用蒸馏水配制0.5 μg/mL的尼罗红工作液,在装有斑马鱼的容器中加入尼罗红工作液,避光孵育幼鱼60 min,之后在蒸馏水中清洗3 min。然后将斑马鱼幼鱼用0.02% Tricane麻醉,在荧光显微镜下观察幼鱼脂肪组织和肝内脂滴(呈强烈桔黄色)并拍照。
1.2.7 冰冻切片油红O染色4%多聚甲醛固定幼鱼4 d,PBS冲洗2次,30%蔗糖浓液(PBS配制)浸透4 ℃过夜,OCT包埋,在冰冻切片机中切取8 μm厚度切片,60 ℃烤片30 min,用85%、100% 1,2-丙二醇分别渗透5 min,再用新鲜配制0.5%油红O染液常温下染色2 h,PBS轻轻冲洗掉染液,100% 1,2-丙二醇去背景色1 min,PBS轻轻冲洗掉丙二醇,苏木精染液中复染10s,清水冲洗后吸干玻片,明胶封片。在显微镜下观察脂滴(染色呈红色)并拍照。
1.2.8 斑马鱼脂质测定将斑马鱼幼鱼按体质量(mg):体积(μL)为1∶9加入蒸馏水稀释10倍,离心,吸出上层清液,按照甘油三酯和总胆固醇试剂盒说明书,测量幼鱼体内甘油三酯和总胆固醇浓度。
1.2.9 统计学分析数据采用SSPS13.0统计软件分析,两组间计量资料比较采用独立样本t检验。P<0.05认为差异具有统计学意义。
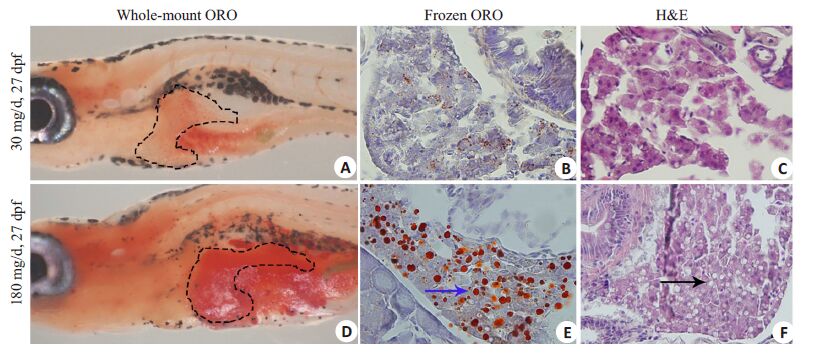
2 结果 2.1 过度喂养诱导斑马鱼幼鱼发生肥胖根据前期预试验对不同喂养量斑马鱼生长和死亡情况分析,不同的喂养量对斑马鱼死亡率无影响,喂养20 d幼鱼死亡率约为25%。确定每100条幼鱼按喂养量为30 mg/d喂养20 d斑马鱼生长发育不受影响,定为正常喂养组,而喂养180 mg/d为过度喂养组。如表 1所示,过度喂养组幼鱼体质量和体长明显比正常喂养组幼鱼体质量和体长增加,与正常喂养组比较,过度喂养组幼鱼体质量增加了69.4%,而体长增加23.4%;而且过度喂养组幼鱼体质量指数(BMI)比正常组喂养组幼鱼增加近1倍;此外,过度喂养组幼鱼发生肝脏脂肪变性率和总甘油三酯浓度明显比正常喂养组高,而胆固醇含量两组之间没有差异。同时整体油红O染色显示过度喂养组幼鱼肝脏染色呈红色,边界清晰(图 1D),而正常喂养组幼鱼肝脏染色淡红,边界模糊(图 1A);冰冻切片油红O染色和石蜡切片HE染色显示过度喂养组斑马鱼肝脏出现大泡性脂肪变性(图 1E,F),而正常喂养组斑马鱼肝脏并无明显脂滴出现(图 1B,C)。
| 表 1 各组喂养20 d幼鱼体质量、体长、体质量指数(BMI)、甘油三酯(TG)、总胆固醇(TCH)和肝脂肪变性率变化 Table 1 Body weight,body length,BMI,TG,TCH and hepatic steatosis rate of the larvae in the two groups after 20 days of feeding(Mean±SD) |
|
图 1 喂养20 d幼鱼的组织学改变 Figure 1 Histological changes of zebrafish larvae fed for 20 days in normal feeding and overfed group observed bywhole-mount Oil Red O staining (Original magnification: ×32) (A,D),frozen ORO (Original magnification: ×400) (B,E) and HE staining (Original magnification: × 400) (C,F). Dashed box indicate zebrafish liver. Normal liver wasdyed pink and showed fuzzy boundary in normal group; fatty liver was dyed red and showed clear boundary inthe overfed group. Arrows indicate hepatic lipid droplets. |
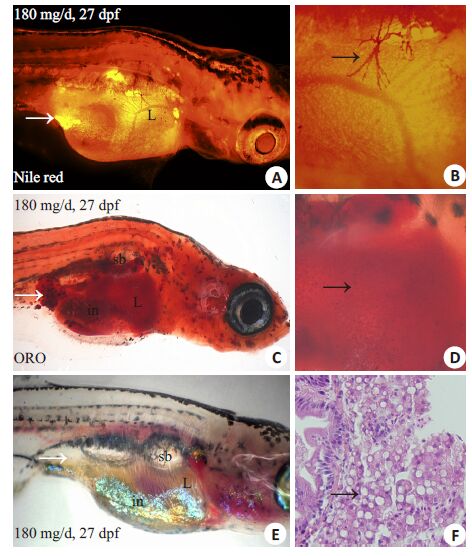
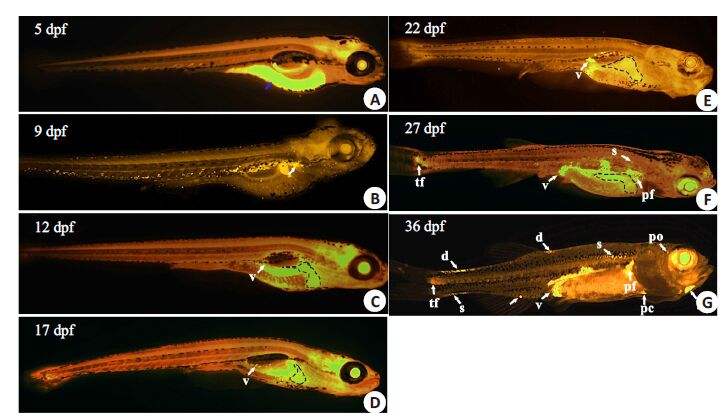
我们选择过度喂养的27 dpf幼鱼,用尼罗红染液处理,在荧光显微镜下观察。发现在幼鱼肝内和腹腔部位有明显的强烈桔黄色信号,表明幼鱼存在肝内脂滴和脂肪细胞聚集(图 2A,B)。同时整体油红O染色(图 2C,D),白光显微镜(图 2E)和HE切片(图 2F)进一步证实肝内脂滴和腹部脂肪细胞的存在。接着我们运用尼罗红染色观察不同喂养时间幼鱼体内脂肪组织的发生和分布。尼罗红染色显示5 dpf斑马鱼幼鱼还未被完全吸收的卵黄囊(图 3A)。过度喂养2 d的幼鱼(即9 dpf)胰腺位置出现中性脂质聚集,表明脂肪细胞最先出现在胰腺部位(图 3B);喂养5 d的幼鱼(12 dpf)腹腔中开始出现小脂滴,提示存在脂肪细胞聚集(图 3C);而随着喂养时间延长腹腔脂肪细胞聚集明显增多,脂肪细胞出现的部位除腹腔外,还出现在其他部位如胸鳍部(图 3F,G),眼眶周围(图 3G),尾鳍部(图 3F,G),心包周围(图 3G),下颌部(图 3G),皮下和背部(图 3G)。这表明随着喂养时间延长斑马鱼体内脂肪细胞数量和出现部位逐渐增加,说明不同部位脂肪组织的发生并不是同步的,斑马鱼脂肪组织的形成按一定的顺序存在时间和空间上的调控。此外,发现在过度喂养下斑马鱼肝脏在喂养5 d后可出现明显的脂质聚集(图 3C),之后肝内脂质聚集一直存在(图 3D~F),表明斑马鱼易于发生肝内脂肪变性。
|
图 2 尼罗红染色活体标记斑马鱼幼鱼肝内脂滴和脂肪组织 Figure 2 In vivo labeling of hepatic lipid droplets and adipose tissueof overfed zebrafish by Nile Red staining. A,B: Nile Red stainingof hepatic lipid droplets and adipose depots in vivo; C,D: Hepaticneutral lipid and visceral adipose depots shown by whole-mountOil Red O staining; E,F: Bright light and HE staining showingvisceral adipose tissue and hepatic steatosis. Thick arrowsindicate visceral adipose tissue (Original magnification: ×32); Thinarrows indicate hepatic lipid droplets. L: Liver; sb: Swim bladder;in: Intestine (B,D: ×100; F: ×400). |
|
图 3 过度喂养斑马鱼幼鱼随着喂养时间延长体内脂肪组织数量和分布部位逐渐增加 Figure 3 Amount and distribution of adipose fat depots in overfed zebrafish larvae increased with feedingtime. Nile Red staining showed the changes of distribution of adipose depots and hepatic neutral lipidin zebrafish larvae at 5 dpf (A),9 dpf (B),12 dpf (overfed for 5 days) (C),17 dpf (overfed for 10dys) (D),22 dpf (overfed for 15 days) (E),27 dpf (overfed for 20 days) (F),36 dpf (overfed for 29 days) (G). Thedotted line cycle indicates the liver; Blue arrowhead indicates the yolk sac; White arrowheads indicateadipose depots in the viscera (v),pectoral fin plate (pf),pericardial region (pc),jaw (j),periorbital region(po),subcutaneous positions (s),dorsal region (d) and tail fin region (tf). |
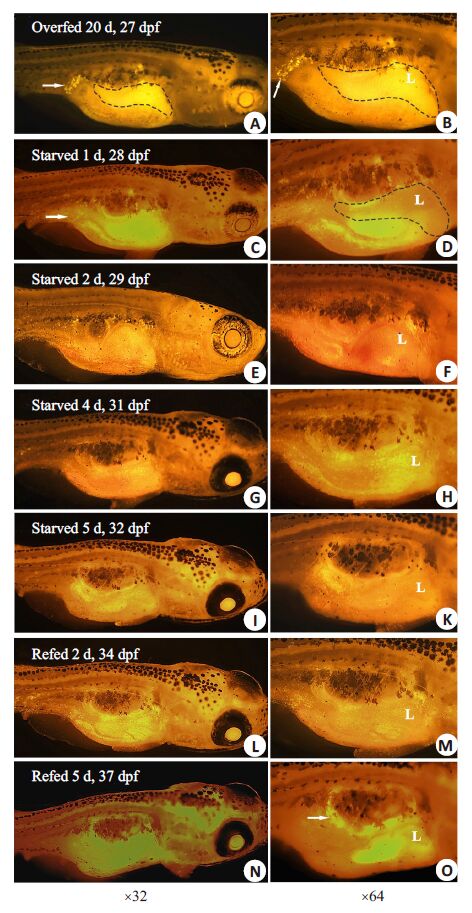
首先,尼罗红染色过度喂养的27 dpf斑马鱼显示腹腔内脂肪细胞聚集和肝内脂滴形成(图 4A,B)。而在斑马鱼饥饿1、2和4 d后,腹腔脂肪组织明显逐渐减少,肝脏体积和肝内脂滴也逐渐减少(图 4C~H)。在饥饿5 d后,腹腔内脂肪组织和肝内脂滴基本消失(图 4I,K),表明在饥饿状态时,斑马鱼动用脂肪组织的脂肪和肝内脂质维持生命活动。为了证明斑马鱼在重新给予喂养后脂肪组织重新出现,我们对饥饿5 d 后斑马鱼给予喂养。尼罗红染色发现喂养2 d后,斑马鱼腹腔内又出现小脂滴(图 4L,M),提示脂肪组织重新出现。在重新喂养5 d后,斑马鱼腹腔内中性脂质明显增加,而肝内脂滴变化不是很明显(图 4N,O)。这表明饥饿的斑马鱼重新喂养后,脂肪细胞可重新聚集脂质。肝内脂滴并未出现,这可能喂养时间不够,肝内未聚集足够脂滴。
|
图 4 斑马鱼脂肪组织内脂质和肝内脂滴的动员和贮存受外界营养状态调节 Figure 4 Mobilization and storage of zebrafish fat depots andhepatic lipid droplets are regulated by exogenous nutrition. NileRed staining showed the dynamic change of adipose tissues andhepatic lipid droplets in zebrafish overfed for 20 days (A,B),followed by starvation for 1 day (C,D),2 days (E,F),4 days(G,H),5 days(I,K) and refeeding for 2 days (L,M) and 5 days (N,O). Thick arrows indicate visceral adipose tissue; Dashed boxindicates zebrafish liver,L: liver. |
肥胖是是由于体内能量摄入超过能量消耗,而导致能量以脂肪形式(主要是甘油三酯)贮存在脂肪细胞内引起的代谢紊乱疾病。随着人们生活水平的提高和饮食方式的西化,不仅成人肥胖的发生率增高[14],而且儿童和青少年超重和肥胖的发生率也逐年增加[15-16]。由于肥胖的发病机制目前并不明确,尤其儿童和青少年肥胖发生机制研究缺乏,而目前肥胖的主要治疗是饮食控制和增加体育锻炼,仍然缺乏有效的药物用于治疗肥胖。而肥胖动物模型是研究肥胖发病机制和筛选有效药物的基础,因而建立稳定可靠的肥胖动物模型具有重要的意义。传统的啮齿动物模型试验需要大量人员和基础设备支持,成本高昂,而且肥胖变异高,肥胖发生率低,因而寻求简单,成本低,肥胖发生率高的肥胖动物模型成为人们所需。
Oka等[17]通过每天每条鱼60 mg干重丰年虾过度喂养成年斑马鱼,结果显示BMI和血清甘油三酯浓度增加,肝脏发生脂肪变性,并且通过比较转录组分析过度喂养斑马鱼腹腔脂肪组织和肥胖小鼠及人类腹腔脂肪组织基因转录水平,发现它们在凝血系统和脂质代谢通路上存在共同的病理生理过程,从而建立了成年斑马鱼肥胖模型。本研究通过前期预实验确定每100条幼鱼每天喂养30 mg,喂养20 d后斑马鱼幼鱼发育正常,定为正常喂养组,而幼鱼喂养180 mg喂养20 d为过度喂养组。实验数据显示过度喂养组幼鱼体质量、BMI和总甘油三酯浓度明显增加,而且89.4%的幼鱼发生肝脏脂肪变性,病理切片显示肝脏大泡性脂肪变性,整体油红染色显示腹腔内脂肪细胞聚集明显增多,这表明过度喂养幼鱼可诱导肥胖发生。鉴于斑马鱼基因组与人类基因组具有高度同源性,斑马鱼幼鱼又处于生长发育阶段,因而该模型可用于模拟人类儿童和青少年肥胖,为研究该类肥胖的发生机制和治疗药物提供实验平台。
肥胖发生在病理上主要表现在体内脂肪细胞体积变大或脂肪细胞数量增加,或者两者同时发生。而在人、小鼠和正常成年斑马鱼上很难活体上观察到脂肪细胞的变化,由于斑马鱼幼鱼具有透明可见性的特点,使其在活体中观察脂肪细胞变化成为可能。近年来国外许多文献报道应用具有标记中性脂质特性的脂质荧光染料尼罗红[18]活体中标记斑马鱼幼鱼脂肪细胞来研究脂肪细胞的发育及其调控因素。本研究首次在国内应用尼罗红活体标记斑马鱼幼鱼体内脂肪细胞,并且观察到过度喂养下幼鱼肝内脂滴的聚集。通过观察不同喂养时间斑马鱼体内脂肪组织和肝内脂滴的变化,表明不同部位脂肪组织的形成并不是同时发生的,而是在时间和空间上按一定的顺序受到严格的调控;而且脂肪细胞最早(9 dpf)出现的部位是在胰腺,12 dpf 后出现在腹腔,27 dpf后出现在腹腔外其他部位如皮下、胸鳍和眼眶周围等部位。Flynn[19]和Imrie等[20]人报道白色脂肪组织的发育是受发育时间和斑马鱼大小影响。斑马鱼在17 dpf时,不论大小,都会出现腹腔脂肪组织;而不论斑马鱼年龄多大,皮下脂肪组织只有体长达到8.2 mm才会出现;斑马鱼脂肪细胞最早出现在8~15 dpf 斑马鱼的胰腺内,这些结果与我们观察到的结果相一致。同时尼罗红染色也显示过度喂养5 d后(12 dpf)斑马鱼幼鱼肝内出现明显的脂质聚集,表明斑马鱼易于发生肝内脂肪变性。我们的数据表明斑马鱼幼鱼不仅为研究早期肥胖发生提供很好的模型,同时为活体上研究脂肪组织的形成和发育提供很好的平台。我们的研究也证明脂肪组织内脂肪和肝内脂滴受外界营养环境的调控,当饥饿时体内脂肪和肝内脂滴被动员提供能量;而外界营养充裕时,体内脂肪细胞重新贮存脂肪,这与其他研究结果相一致[19-20]。同时,这也表明饮食控制是治疗肥胖的一种有效方法。
尽管斑马鱼对研究脂肪细胞在肥胖发生的作用中有许多优势,但是斑马鱼幼鱼也存在许多不足。首先,幼鱼体积小,无法获取血标本,从而不能检测生化学指标如血糖、血脂和胰岛素浓度等来评价代谢相关疾病情况。再次,斑马鱼是变温动物体内没有棕色脂肪组织[21],而人类肥胖的发生不仅依赖于食物摄入与热量利用之间的平衡,而且也依赖于白色脂肪组织和棕色脂肪组织之间的平衡,因此斑马鱼肥胖模型可能不适用于研究棕色脂肪相关的信号通路。最后,目前并没有关于斑马鱼肥胖的统一标准,本研究根据肥胖具有的临床表型首次建立斑马鱼幼鱼肥胖模型,因此关于肥胖的其他并发症如胰岛素抵抗等需研究人员进一步研究。
总而言之,本研究首次通过过度喂养方法成功建立斑马鱼幼鱼肥胖模型;并且国内首次使用脂质荧光染料尼罗红活体内标记和成像斑马鱼脂肪组织和肝内脂滴,为活体中研究肥胖发生和肝内脂质变化提供新的实验方法。由于斑马鱼具有体积小,样本量大,繁殖周期短,操作简单,身体透明和饲养成本低等优点,因此斑马鱼幼鱼肥胖模型为进一步研究肥胖发病机制和药物筛选提供了实验基础。
致谢: 本研究以南方医科大学广东省人类疾病斑马鱼模型与药物筛选重点实验室为平台,在此衷心感谢张文清教授、张译月教授以及斑马鱼实验室全体成员的关心与帮助!| [1] | Bessesen DH. Update on obesity[J]. J Clin Endocrinol Metab,2008, 93 (6) : 2027-34. DOI: 10.1210/jc.2008-0520. |
| [2] | Mcmullen S. Childhood obesity: the impact on long-term risk of metabolic and CVD is not necessarily inevitable[J]. Proc Nutr Soc,2014, 73 (3) : 389-96. DOI: 10.1017/S0029665114000111. |
| [3] | Karagozian R, Derdák Z, Baffy G. Obesity-associated mechanisms of hepatocarcinogenesis[J]. Metabolism,2014, 63 (5) : 607-17. DOI: 10.1016/j.metabol.2014.01.011. |
| [4] | Spalding KL, Arner E, Westermark PO, et al. Dynamics of fat cell turnover in humans[J]. Nature,2008, 453 (7196) : 783-7. DOI: 10.1038/nature06902. |
| [5] | Flynn MA, Mcneil DA, Maloff B, et al. Reducing obesity and related chronic disease risk in children and youth: a synthesis of evidence with 'best practice' recommendations[J]. Obes Rev,2006, 7 (Suppl 1) : 7-66. |
| [6] | Schlegel A, Stainier DY. Lessons from "lower" organisms: what worms, flies, and zebrafish can teach us about human energy metabolism[J]. PLoS Genet,2007, 3 (11) : e199. DOI: 10.1371/journal.pgen.0030199. |
| [7] | Lieschke GJ, Currie PD. Animal models of human disease: zebrafish swim into view[J]. Nat Rev Genet,2007, 8 (5) : 353-67. DOI: 10.1038/nrg2091. |
| [8] | Schlegel A, Gut P. Metabolic insights from zebrafish genetics, physiology, and chemical biology[J]. Cell Mol Life Sci,2015, 72 (12) : 2249-60. DOI: 10.1007/s00018-014-1816-8. |
| [9] | Asaoka Y, Terai S, Sakaida I, et al. The expanding role of fish models in understanding non-alcoholic fatty liver disease[J]. Dis Model Mech,2013, 6 (4) : 905-14. DOI: 10.1242/dmm.011981. |
| [10] | Liu W, Chen JR, Hsu CH, et al. A zebrafish model of intrahepatic cholangiocarcinoma by dual expression of hepatitis B virus X and hepatitis C virus core protein in liver[J]. Hepatology,2012, 56 (6) : 2268-76. DOI: 10.1002/hep.25914. |
| [11] | 王坤元, 刘莉, 戴文聪, 等. 二乙基亚硝胺诱导建立斑马鱼肝纤维化模 型[J]. 南方医科大学学报,2014 (6) : 777-82. |
| [12] | 戴文聪, 刘莉, 王坤元, 等. 急性酒精性脂肪肝斑马鱼模型的建立[J]. 临床肝胆病杂志,2013, 29 (4) : 286-9. |
| [13] | Shimada Y, Kuninaga S, Ariyoshi M, et al. E2F8 promotes hepatic steatosis through FABP3 expression in diet-induced obesity in zebrafish[J]. Nutr Metab (Lond),2015, 12 : 17. DOI: 10.1186/s12986-015-0012-7. |
| [14] | Jia WP, Wang C, Jiang S, et al. Characteristics of obesity and its related disorders in China[J]. Biom Environ Sci,2010, 23 (1) : 4-11. DOI: 10.1016/S0895-3988(10)60025-6. |
| [15] | 李显兰, 陈莉. 儿童、青少年肥胖症的流行现状及病因探讨[J]. 重庆 医学,2013, 42 (2) : 226-8. |
| [16] | 李辉, 宗心南. 我国大陆主要城市学前儿童单纯性肥胖及其影响因 素的20年变化趋势[C]. 中国四川成都: 2010. |
| [17] | Oka T, Nishimura Y, Zang L, et al. Diet-induced obesity in zebrafish shares common pathophysiological pathways with mammalian obesity[J]. BMC Physiol,2010, 10 : 21. DOI: 10.1186/1472-6793-10-21. |
| [18] | Greenspan P, Fowler SD. Spectrofluorometric studies of the lipid probe, Nile red[J]. J Lipid Res,1985, 26 (7) : 781-9. |
| [19] | Flynn EJ, Trent CM, Rawls JF. Ontogeny and nutritional control of adipogenesis in zebrafish (Danio rerio)[J]. J Lipid Res,2009, 50 (8) : 1641-52. DOI: 10.1194/jlr.M800590-JLR200. |
| [20] | Imrie D, Sadler KC. White adipose tissue development in zebrafish is regulated by both developmental time and fish size[J]. Dev Dyn,2010, 239 (11) : 3013-23. DOI: 10.1002/dvdy.v239:11. |
| [21] | Gesta S, Tseng YH, Kahn CR. Developmental origin of fat: Tracking obesity to its source[J]. Cell,2007, 131 (2) : 242-56. DOI: 10.1016/j.cell.2007.10.004. |
 2016, Vol. 36
2016, Vol. 36

