糖尿病肾病(DN)是糖尿病最主要的慢性微血管并发症之一,是目前引起终末期肾病的首要原因,严重威胁着人类健康。糖尿病肾病的发病过程复杂,其确切发病机制尚不明确。近年来,在糖尿病肾病(DN)、代谢综合征(MS)和慢性肾病(CKD)等疾病中,血脂异常对肾脏造成的损害作用日益受到关注。西格列汀是第一个用于治疗2型糖尿病的二肽基肽酶IV(DPP4)抑制剂,通过竞争性抑制DPP4的活性,减少GLP-1的降解,使生理浓度的GLP-1水平升高,作用增强,具有非血糖依赖性的保护效应,如改善左心室功能和血管内皮舒张功能、抗动脉粥样硬化以及减轻急性肾损伤和高血压肾损伤[1-4]。然而,西格列汀对血脂异常相关的肾损伤是否有相似的保护作用及潜在的机制尚不清楚。Egr-1是一种具有锌指结构的转录因子,为即刻早期基因(immediateearly gene)家族成员。有研究证实,Egr-1参与多种肾脏损伤过程[5]。然而Egr-1 是否参与血脂异常造成的肾脏损伤,目前国内外尚无报道。所以,本研究以ApoE基因敲除小鼠作为研究对象,观察西格列汀对肾组织中Egr-1 及FN 表达的影响,探讨其肾脏保护作用及可能机制。
1 材料和方法 1.1 实验动物雄性apoE-/-小鼠,体质量15~20 g,SPF级,8 周龄,取自南方医科大学药学院动物饲养中心,ApoE-/-种鼠(2只)由美国哈佛大学Joslin糖尿病中心赠予,SPF环境饲养繁殖;雄性C57BL/6J小鼠,体质量15~20 g,SPF级,8周龄,购于南方医科大学实验动物中心。用SPF级普通饲料及高脂饲料(含21.8%脂肪,1.25%胆固醇)饲料。
1.2 动物分组apoE-/-组:给予高脂饮食;sig+apoE-/-组:给予高脂+西格列汀饮食(高脂饲料混合0.3%西格列汀,剂量为200 mg/kg/d);control组:给予高脂饲料的同性别、同周龄C57BL小鼠。每组6只,3组小鼠均持续喂养16周。
1.3 主要试剂与耗材Antibody Egr-1(Santa Cruz Biotechnology),Antibody FN(Abcam);Antibodyβ-actin(中杉金桥生物),抗兔、抗鼠荧光二抗(LI-COR Biosciences),Tizol、逆转录试剂盒及Real-time PCR 检测试剂(美国Invitrogen 公司),PCR引物由英潍捷基(上海)公司合成,RIPA裂解液(广州拓科达生物科技有限公司),盐酸西格列汀(美国默沙东公司)。
1.4 血糖、血脂、尿白蛋白水平检测各组小鼠连续灌胃16周后,禁食、禁水12 h,分别行腹腔耐量实验(IPGTT),观察血糖水平,后置于代谢笼中,收集24 h尿标本,用ELISA法检测小鼠24 h尿白蛋白。随后进行小鼠腹腔麻醉,摘眼球取血,4 ℃冰箱静置2 h以上,低温高速离心机离心。离心所得血清标本,取至少l mL置于全自动生化分析仪内,测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)的含量。
1.5 实时荧光定量PCR检测按Trizol 试剂说明书提取总RNA,用NanoDropND-1000分光光度计测定RNA浓度,用A260/A280比值判定其纯度,比值在1.8~2.0之间,提示RNA纯度较好,可用于逆转录,接着严格按照Invitrogen逆转录试剂盒说明书将其逆转录为cDNA,再以cDNA 为模板进行qPCR扩增目的基因,qPCR引物序列见表 1。
| 表 1 实时荧光定量PCR引物序列 Table 1 Sequences of primers used for real-time quantitative PCR |
用RIPA裂解液提取总蛋白,用BCA法测量蛋白浓度。取20 μg蛋白,用10% SDS-聚丙烯酰胺凝胶进行电泳分离,约1~1.5 h,电转移至聚偏二氟乙烯膜(PVDF膜)后以5%脱脂奶粉室温封闭2 h,放入TBST漂洗数秒,放入预先配制的一抗中,4 ℃摇床过夜,洗膜3次后置于荧光二抗(1∶15 000)室温孵育1 h,洗膜3次后于滤纸吸干,后使用Odyssey双色红外荧光扫描成像系统获得图片,运用Quantity One图像分析软件测得条带灰度值,将各目的条带与内参条带比值后,比较各组间差异。
1.7 统计学分析所有数据均以均数±标准差表示,采用SPSS 13.0软件进行统计分析,IPGTT多个时间点数据采用重复测量方差分析。3组及3组以上样本均数比较满足方差齐性用One-way ANOVA方差分析,组间两两比较采用LSD法。若方差不齐,采用Welch检验,组间两两比较采用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠血脂变化实验16周取血检测后观察到,与对照组比较,sig+apoE-/-组和apoE-/-组的小鼠血清甘油三酯(TG)、胆固醇(CHOL)、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)水平均显著升高(P<0.05),而apoE-/-组和sig+apoE-/-两组间上述指标无统计学差异(P>0.05)。此外,sig+apoE-/-组的高密度脂蛋白(HDL)显著高于apoE-/-组(P<0.001)和control 组(P<0.001),提示西格列汀干预后可明显升高血清HDL水平(图 1)。
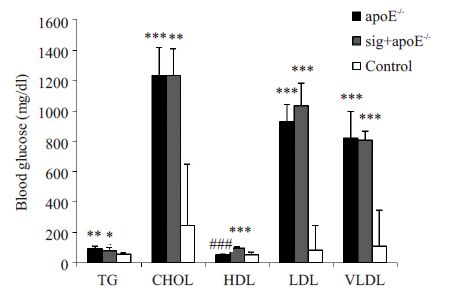
|
图 1 各组小鼠血脂水平 Figure 1 Blood lipid profiles in the 3 groups (n=6). *P<0.05, **P< 0.01, ***P<0.001 vs control group; ###P<0.001 vs apoE-/- group. |
腹腔糖耐量实验结果显示,sig+apoE-/-组、apoE-/-组和对照组3组间,血糖值在0,15,30,60,120 min均没有统计学差异(P>0.05),提示西格列对各组小鼠的血糖水平没有显著影响(图 2)。
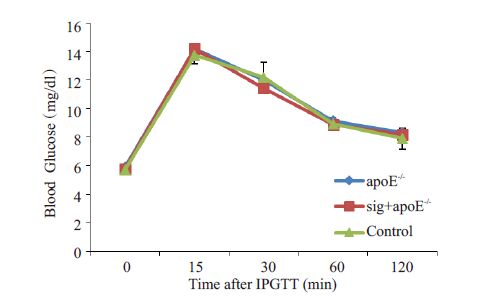
|
图 2 各组小鼠腹腔糖耐量实验中的血糖水平 Figure 2 Blood glucose level in the 3 groups during IPGTT. |
h尿白蛋白结果显示:apoE-/-组24 h尿白蛋白排泄量明显高于对照组,差异具有统计学意义(24.37±3.205 vs 18.40±2.955 μg/L,P=0.007);西格列汀治疗后,sig+apoE-/-组小鼠24 h尿白蛋白较apoE-/-组显著降低,差异具有统计学意义(16.61±3.497 vs 24.37±3.20 μg/L,P=0.003,图 3)。
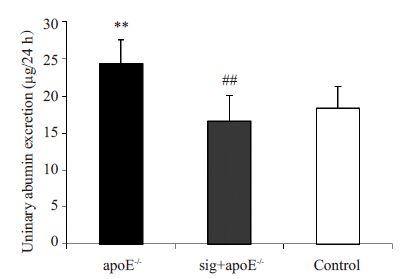
|
图 3 各组小鼠24 h尿白蛋白排泄量的比较 Figure 3 24-h uninary albumin excretion in the 3 groups (n=6). **P<0.01 vs control group; <##P<0.01 vs apoE-/- group. |
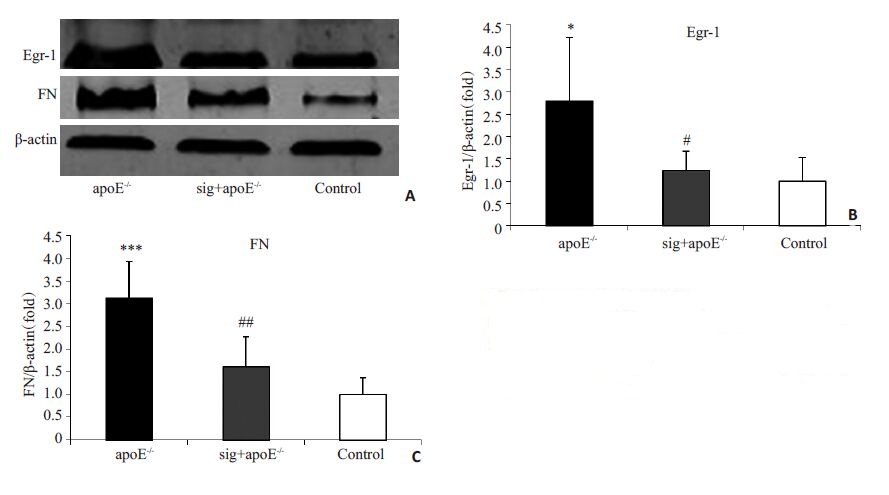
Real-time PCR检测结果显示(图 4):apoE-/-小鼠予高脂饲料16周后,肾皮质Egr-1与FN的mRNA水平明显升高(图 4A、B),与对照组相比,差异具有统计学意义(P<0.01),西格列汀给药后,Egr-1与FN的mRNA水平明显降低(图 4A、B),与apoE-/-组相比,差异具有统计学意义(P<0.01)。Western Blotting 检测结果显示(图 5A):与对照组相比,apoE-/-组的Egr-1与FN的蛋白水平明显升高(图 5B、C),差异具有统计学意义(P<0.05),西格列汀干预后,可见Egr-1与FN的蛋白水平较apoE-/-组明显降低(图 5B、C),差异具有统计学意义(P<0.05)。
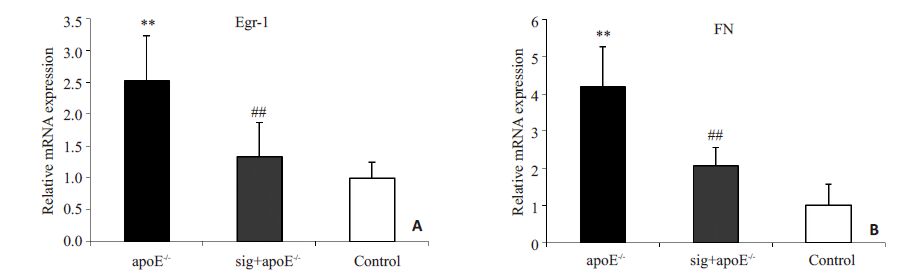
|
图 4 Real-time PCR检测Egr-1和FN的表达 Figure 4 Expressions of Egr-1 and FN mRNA in the renal tissues detected by real-time PCR in the 3 groups (n=6). **P<0.01,vs control group; ##P<0.01 vs apoE-/- group. |
|
图 5 Western Blotting检测Egr-1和FN的表达 Figure 5 Protein expressions of Egr-1 and FN in the renal tissues detected by Western blotting (n=6).*P<0.01, ***P<0.01 vs control group; #P<0.01, ##P<0.01 vs apoE-/- group. |
随着人们生活方式、饮食结构的改变,糖尿病的发病率逐年升高。而血糖控制不佳的患者由于长期的高血糖也容易引起各种慢性并发症。目前,糖尿病肾病作为糖尿病慢性微血管并发症之一,已成为我国终末期肾衰竭第二大原因,严重威胁着人类健康[6]。同时,随着膳食脂肪和高糖高热量饮食的摄入过多,体力劳动明显减少,导致高脂血症的广泛流行。越来越多的研究均显示[7],血脂异常是慢性肾病发生和发展的主要的独立危险因素之一,其特点为显著增高的甘油三酯血清和胆固醇水平,以及载脂蛋白谱特征的改变。研究表明[8-9],高脂饮食诱导的脂质沉积、肾小球系膜基质扩张、细胞外基质积聚等被认为是肾小球硬化和肾小管间质纤维化发展过程早期的病理特征。对已经存在基础肾病(如糖尿病肾病)的患者,血脂异常可导致肾功能的不断恶化[10]。脂代谢紊乱导致的肾损害机制较为复杂,目前认为,可能与肾血流动力学改变、内皮功能障碍、胰岛素抵抗、慢性炎症、氧化应激等有关,然而确切机制尚未完全阐明。
西格列汀是一种新型的抗糖尿病药物,是高选择性DPP4抑制剂,主要通过竞争性抑制DPP4的活性,减少GLP-1的降解,升高生理浓度的GLP-1水平,从而发挥其生物学效应。西格列汀不仅具有良好的降糖效果,改善胰岛素抵抗,同时,西格列汀还可具有一定的降脂作用,影响甘油三酯及胆固醇的合成及分泌[11]。此外,也有研究证实,西格列汀除了调控血糖、血脂,还发现其对多个组织器官具有降糖降脂以外的保护作用[12-15]。研究证实,西格列汀对心肌损害、动脉粥样硬化、急性肾损伤等都有除降糖降脂之外的独立保护作用[16-18]。高脂血症和高血糖可共同作用导致肾损伤。由于糖尿病患者常合并有血脂异常,因此我们设想西格列汀对血脂异常所致肾损伤的保护作用参与了其对糖尿病肾病的保护效应。研究发现,西格列汀可通过降低肾脏VEGF的表达,从而对早期糖尿病肾病大鼠肾脏有一定的保护作用。在糖尿病动物模型及T2DM患者中也都发现西格列汀具有减少蛋白尿排泄量并减轻肾损伤的作用[19-20]。因此,本研究主要探讨西格列汀对于血脂异常所致肾损伤的保护作用以及这一作用的潜在机制。
apoE-/-小鼠是最接近于人类代谢模式的经典的血脂异常模型,所以,我们选取apoE-/-小鼠作为研究对象,以高脂饲料诱导肾损伤。24 h尿白蛋白排泄率是肾损伤的评价和诊断的重要指标之一,也是治疗效果评价的指标。在本研究中,我们观察到apoE-/-组小鼠的24 h尿白蛋白排泄量显著增加,西格列汀干预后,sig+apoE-/-组的小鼠尿白蛋白水平明显下降,改善肾功能。此外,apoE-/-组及sig+apoE-/-组的小鼠血脂水平与control组相比均显著升高,尤以甘油三酯和胆固醇升高最为显著,而小鼠出现的脂代谢紊乱在给予或不给于西格列汀治疗的不同组间,没有显著差异,这与其他学者的研究结果保持一致,而实验中的IPGTT实验结果显示,3组小鼠间空腹血糖水平不具有统计学差异,这也排除了西格列汀降糖作用对肾脏的保护效应。因此我们可以排除降低高血脂高血糖对肾脏起到的保护效应。由此,我们开始探讨西格列汀对肾脏的独立保护作用。
纤连蛋白(FN)是ECM的重要组成成分,而ECM过度积聚和沉积是肾脏纤维化的主要特征,肾脏纤维化又是各种慢性进展性肾病的最终结局。所以本研究选取FN作为肾脏损伤的观察指标。结果显示,与control组相比,apoE-/-组小鼠肾组织中的FN mRNA和蛋白表达量均明显升高,而与apoE-/-组相比,sig+apoE-/-组的FN mRNA和蛋白表达量均明显降低。因此,这证实了高脂导致了肾损伤,而在西格列汀的干预下,FN的表达被明显抑制,说明了西格列汀对高脂引起的肾损伤起到了保护作用。
早期生长反应因子(Egr-1),又名Zif 268,NGF1-A,Krox24,or TIS8,属于即刻早期反应基因家族中重要的一员。Egr-1是通过与下游细胞核内靶基因启动子上的Egr-1结合位点的结合,而实现对靶基因的转录调控,使靶细胞执行相应功能,从而发挥其生物学作用的。Egr-1在动物及人体内广泛分布,可被多种刺激因素快速诱导表达,通过与靶基因结合而调节一系列生长因子、细胞因子和粘附分子的表达,参与体内众多的病理生理过程,如细胞的生长和分化、炎症、动脉粥样硬化、细胞凋亡、肿瘤,在神经轴突的生长、促进创伤的修复以及维持女性正常的生殖能力等方面也发挥着一定作用[21-22]。近年来,有研究表明,Egr-1参与DN的多个发病环节,如促进系膜细胞增殖、引起血管内皮功能损伤、促进TGF-β过表达及肾纤维化、引起ECM积聚等[23]。其中,Shin 等[24]研究发现,Egr-1 可通过上调系膜细胞中MMP-9基因的表达,抑制ECM降解,促进系膜外基质沉积,加重肾小球硬化。Gil等[25]通过体内和体外研究证实,糖尿病和高糖状态下可引起Egr-1表达升高。然而,在血脂异常状态下Egr-1 的表达水平是否升高,Egr-1是否也参与了血脂异常所致肾损伤的过程,目前国内外尚无报道。因此,本研究采用实时荧光定量PCR和Western Blotting检测各组小鼠肾组织中Egr-1的表达。结果显示,与control 组相比,apoE-/-组的Egr-1mRNA和蛋白表达水平均显著升高,表明在血脂异常状态下,Egr-1的表达水平是升高的。与此同时,与apoE-/-组相比,sig+apoE-/-组的Egr-1水平是明显降低的,说明西格列汀可抑制Egr-1的表达。由此,我们推测西格列汀可能通过抑制Egr-1的表达,从而抑制FN的表达,最终达到保护肾脏的作用。
综上所述,血脂异常可诱导肾损伤,西格列汀可对血脂异常相关性肾损伤起到独立的保护作用,Egr-1参与了血脂异常引起的肾损伤过程,西格列汀可能通过抑制Egr-1的表达从而抑制FN的表达最终达到肾脏保护作用的。本研究首次提出了Egr-1在血脂异常相关性肾损伤中的作用,为血脂异常相关性肾损伤的机制研究提供了一个新思路,但其具体机制还需要后续更多的的细胞实验及动物实验加以证实。
| [1] | Vittone F, Liberman A, Vasic D, et al. Sitagliptin reduces plaque macrophage content and stabilises arteriosclerotic lesions in Apoe (-/-) mice[J]. Diabetologia, 2012, 55 (8): 2267-75. DOI: 10.1007/s00125-012-2582-5. |
| [2] | Kubota Y, Miyamoto M, Takagi G, et al. The dipeptidyl peptidase-4 inhibitor sitagliptin improves vascular endothelial function in type 2 diabetes[J]. J Korean Med Sci, 2012, 27 (11): 1364-70. DOI: 10.3346/jkms.2012.27.11.1364. |
| [3] | Rahman M, Baimbridge C, Davis BR, et al. Progression of kidney disease in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin versus usual care: a report from the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT)[J]. Am J Kidney Dis, 2008, 52 (3): 412-24. DOI: 10.1053/j.ajkd.2008.05.027. |
| [4] | Kao DP, Kohrt HE, Kugler J. Renal failure and rhabdomyolysis associated with sitagliptin and simvastatin use[J]. Diabet Med, 2008, 25 (10): 1229-30. DOI: 10.1111/dme.2008.25.issue-10. |
| [5] | Sun S, Ning X, Zhai Y, et al. Egr-1 mediates chronic hypoxiainduced renal interstitial fibrosis via the PKC/ERK pathway[J]. Am J Nephrol, 2014, 39 (5): 436-48. |
| [6] | Dolan V, Hensey C, Brady HR. Diabetic nephropathy: renal development gone awry?[J]. Pediatr Nephrol, 2003, 18 (2): 75-84. DOI: 10.1007/s00467-002-0988-x. |
| [7] | Kes P, Basic KV, Furic CV, et al. Dyslipidemia and stroke in patients with chronic kidney disease[J]. Acta Med Croatica, 2014, 68 (2): 141-9. |
| [8] | Trevisan R. Lipids and renal disease[J]. J Am Soc Nephrol, 2006, 17 (4_suppl_2): S1S7-45. |
| [9] | Chan CM. Hyperlipidaemia in chronic kidney disease[J]. Ann Acad Med Singapore, 2005, 34 (1): 31-5. |
| [10] | Ligabue G, Cavazzini F, Albertazzi A. Dyslipidemia and the risk of kidney disease[J]. G Ital Nefrol, 2007, 24 (Suppl 38): 8-12. |
| [11] | Fukuda-Tsuru S, Anabuki J, Abe Y, et al. A novel, potent, and long-lasting dipeptidyl peptidase-4 inhibitor, teneligliptin, improves postprandial hyperglycemia and dyslipidemia after single and repeated administrations[J]. Eur J Pharmacol, 2012, 696 (1/3): 194-202. |
| [12] | Chua S, Lee FY, Tsai TH, et al. Inhibition of dipeptidyl peptidase-IV enzyme activity protects against myocardial ischemia-reperfusion injury in rats[J]. J Transl Med, 2014, 12 : 357. DOI: 10.1186/s12967-014-0357-0. |
| [13] | Nader MA, El-Awady MS, Shalaby AA, et al. Sitagliptin exerts anti-inflammatory and anti-allergic effects in ovalbumin-induced murine model of allergic airway disease[J]. Naunyn Schmiedebergs Arch Pharmacol, 2012, 385 (9): 909-19. DOI: 10.1007/s00210-012-0772-9. |
| [14] | Dos Santos L, Salles TA, Arruda-Junior DF, et al. Circulating dipeptidyl peptidase IV activity correlates with cardiac dysfunction in human and experimental heart failure[J]. Circ Heart Fail, 2013, 6 (5): 1029-38. DOI: 10.1161/CIRCHEARTFAILURE.112.000057. |
| [15] | Chang MW, Chen CH, Chen YC, et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors[J]. Acta Pharmacol Sin, 2015, 36 (1): 119-30. DOI: 10.1038/aps.2014.98. |
| [16] | Youssef MI, Mahmoud AA, Abdelghany RH. A new combination of sitagliptin and furosemide protects against remote myocardial injury induced by renal ischemia/reperfusion in rats[J]. Biochem Pharmacol, 2015, 96 (1): 20-9. DOI: 10.1016/j.bcp.2015.04.010. |
| [17] | Singh TP, Vangaveti VN, Malabu UH. Dipeptidyl peptidase-4 inhibitors and their potential role in the management of atherosclerosis-A review[J]. Diabetes Metab Syndr, 2015, 9 (4): 223-9. DOI: 10.1016/j.dsx.2015.04.005. |
| [18] | Nuransoy A, Beytur A, Polat A, et al. Protective effect of sitagliptin against renal ischemia reperfusion injury in rats[J]. Ren Fail, 2015, 37 (4): 687-93. DOI: 10.3109/0886022X.2015.1010991. |
| [19] | Liu WJ, Xie SH, Liu YN, et al. Dipeptidyl peptidase IV inhibitor attenuates kidney injury in streptozotocin-induced diabetic rats[J]. J Pharmacol Exp Ther, 2012, 340 (2): 248-55. DOI: 10.1124/jpet.111.186866. |
| [20] | Mega C, Vala H, Rodrigues-Santos P, et al. Sitagliptin prevents aggravation of endocrine and exocrine pancreatic damage in the Zucker Diabetic Fatty rat -focus on amelioration of metabolic profile and tissue cytoprotective properties[J]. Diabetol Metab Syndr, 2014, 6 (1): 42. DOI: 10.1186/1758-5996-6-42. |
| [21] | 陈学清, 姜泊, 宋于刚, 等. 早期生长反应因子-1和组织因子在大鼠胰腺炎组织中的表达[J]. 第一军医大学学报, 2004 (11): 1245-7. |
| [22] | 武世勋, 郭雄, 张峰, 等. 大骨节病与骨关节病软骨组织死亡相关因子表达的比较[J]. 南方医科大学学报, 2014 (12): 1785-9. |
| [23] | 王丹, 关美萍, 薛耀明. 早期生长反应因子-1与糖尿病肾病[J]. 国际内分泌代谢杂志, 2014 (6): 397-400. |
| [24] | Shin SY, Kim JH, Baker A, et al. Transcription factor Egr-1 is essential for maximal matrix metalloproteinase-9 transcription by tumor necrosis factor alpha[J]. Mol Cancer Res, 2010, 8 (4): 507-19. DOI: 10.1158/1541-7786.MCR-09-0454. |
| [25] | Gil RG, Tzahi Neuman, Marjolein Garsen, et al. Heparanase Is Essential for the Development of Diabetic Nephropathy in Mice[J]. Diabetes, 2012 : 61. |
 2016, Vol. 36
2016, Vol. 36

