肝癌是一种常见的恶性肿瘤[1-3]。随着体检和诊断技术的提高,越来越多的小肝癌被早期发现。小肝癌是指单个癌结节<3 cm或相邻两个癌结节直径之和<3 cm。当前手术切除依然是肝癌患者首选的治疗方法。近20年来,相继出现了各种原位消融肝癌的治疗措施,主要用于提高这些患者生存的目的。常见的有冷冻切除术、经皮无水酒精注射(PEI)、射频消融(RFA)、微波消融(MWA)和激光消融(LA)等。这些局部消融技术得到了广泛的普及并被证明是有效且安全的,能最大限度的保护周围正常肝实质且减少住院周期[4-6]。
目前应用最为广泛的局部消融方法是RFA 和MWA[7-13]。尽管如此,RFA和MWA仍有一定局限性。有文献报道10%~25%的患者因为肿瘤位于高危部位而不能进行RFA或者MWA治疗,如对该部位的肿瘤进行消融极易导致严重并发症或者导致不完全消融[14-21]。所谓高危部位指的是结节距离重要结构小于5 mm,这些重要结构包括重要血管或胆管结构、肺脏、心脏、胆囊、右肾及胃肠等。
许多研究表明激光消融治疗肝癌取得了很好的疗效。但是这些报道主要是用激光消融治疗非高危部位的肝癌[22-25]。很少报道治疗高危部位肝癌的研究。因此,本文主要研究超声引导下激光消融高危部位及非高危部位的小肝癌,以总结出激光消融是否能有效的治疗高危部位的小肝癌以及尽可能地减少并发症的发生。
1 材料和方法 1.1 研究对象对2012~2014年之间在我院就诊的不能行手术切除的肝癌患者共86 例(男性56例,女性42例,年龄32~65岁)95个病灶。纳入标准:(1)对直径≤3 cm的单发肿瘤或相邻两个癌结节直径之和<3 cm,无血管、胆管侵犯或远处转移,肝功能Child-PughA 或B级的早期肝癌患者;(2)无严重肝肾心脑等器官功能障碍、凝血功能正常或接近正常的肝癌;(3)不愿意接受手术治疗的小肝癌;(4)因肝脏功能差或肿瘤位置等各种原因而不能手术切除的小肝癌;(5)肝脏转移性肿瘤化疗后、患者等待肝移植前控制肿瘤生长以及移植后复发转移。排除标准:(1)肝功能Child-PughC 级,TNMIV 期或肿瘤呈浸润状;(2)近期有食管(胃底)静脉曲张破裂出血;(3)弥漫性肝癌,合并门静脉主干~二级分支或肝静脉癌栓;(4)主要脏器严重的功能衰竭;(5)活动性感染尤其胆系炎症等;(6)不可纠正的凝血功能障碍及血象严重异常血液病;(7)顽固性大量腹水,意识障碍或恶液质。最终68例73个病灶纳入本研究之中。其中,≤1 cm组有20例22个病灶,1例患者有3个病灶(年龄46.56±7.12 岁);1~2 cm组有21 例22 个病灶,1 例患者有2 个病灶(年龄46.95±6.96 岁);2~3 cm组有27例29个病灶,2例患者有2个病灶(年龄47.15±5.91岁)。位于高危部位的的患者33例共35个病灶,2例患者均有2 个病灶(年龄46.78±7.02 岁);非高危部位的的患者35 例共38 个病灶,1 例患者有2 个病灶,1例患者有3个病灶(年龄46.98±6.83岁)。各组之间年龄的差异均无统计学意义(P>0.05)。其中位于高危部位35 个病灶均距离重要结构小于5 mm(靠近第一肝门的病灶有5个,第二肝门的有5个,胆囊的有8个,肺脏的有4个,心脏的有5个,右肾的有6个,胃肠的有2 个)。42 例患者的结节经病理证实(穿刺活检)为原发性肝细胞性肝癌(HCC),26 例为转移性肝癌,其中14 例结直肠癌肝转移,4 例乳腺癌肝转移,4 例肺癌肝转移,3 例胃癌肝转移,1 例淋巴瘤肝转移。本研究经我院伦理委员会批准,所有患者在治疗前签署书面手术知情同意书。
1.2 仪器与药品Siemens Acuson S2000 彩色多普勒超声诊断仪(Siemens. Mountain View,CA,USA),4C1 凸阵探头,频率2.0~4.0 MHz。配备CEUS成像技术。
意大利百胜医疗公司生产的超声激光集成系统。超声仪为Mylab Twice彩色多普勒超声诊断仪,CA541凸阵探头,频率2.0~4.0 MHz。配备CEUS成像技术。激光治疗仪为Echolaser X4激光治疗系统。该设备由主机、光纤连接器、一次性使用无菌光纤(黄、红、蓝、绿4种颜色各1条,材质相同)、不锈钢穿刺针及脚踏开关组成。Nd:YAG激光波长:1064±10 nm;多模;每条光纤最大输出功率:7 W±20%;4条光纤总输出功率:28 W±20%;瞄准光波长:630~670 nm;瞄准光输出功率≤3 mW。光纤长15 cm,直径为300 μm。激光消融可采用单针或者多针治疗,多针治疗可借助多针导针槽固定针套。
造影剂采用意大利Braco 公司生产的第二代超声造影剂声诺维(SonoVue,Bracco,Milan,Italy)。造影微泡为磷脂包裹的六氟化硫微泡,用法为SonoVue25 mg 加入5 mL生理盐水(0.9% NaCl),振摇30 s 后形成微泡混悬液,采用20 G套管针经上肢肘前静脉团注法注入,每次注射2.4 mL,继之推5 mL的生理盐水冲管。
利多卡因、生理盐水、强痛定或杜冷丁及急救药品。
1.3 治疗方法 1.3.1 术前准备局部消融治疗前完善检查:血常规、生化常规、凝血功能、血清肿瘤标志物(AFP等)、心电图、胸片和超声检查,必要时行心肺功能检查等。术前禁食2 h,以防止术中恶心呕吐。术前30 min 肌注强痛定100 mg或度冷丁50~100 mg,以减轻术中疼痛。
常规超声检查:先采用常规的二维灰阶超声观察结节位置、数目、大小、形态、边界及内部回声、是否毗邻重要血管或胆管结构、有无淋巴结转移等。然后用彩色多普勒及频谱多普勒观察结节中央及周边的血供特点,是否有滋养血管。制定完整的治疗方案和策略,保证足够的安全范围。选择适合的超声引导路径,并监控治疗过程,保证治疗的安全性、准确性和有效性。
超声造影:先用常规超声观察肝癌结节的具体部位,充分显示肝癌结节及其周边肝脏组织,选择肝癌结节显像的最佳体位,然后固定探头,嘱患者平静呼吸,启动对比脉冲序列(contrast pulse sequence,CPS)超声造影成像模式进行造影成像。肘前静脉团注声诺维的同时启动超声计时器,实时连续地观察肝癌结节的灌注过程及回声强度变化,包括动脉期(10~30 s)、门脉期(31~120 s)及延迟期(121~360 s),存贮全过程动态影像。为了减少微泡的破坏,有利于连续实时显像,所有患者均选择低帧频(10 Hz)和低机械指数(MI<0.2)进行成像,且聚焦点被置于结节下方。对于有多个结节的患者进行造影检查时,两次检查间隔时间至少大于15 min。测量结节3个垂直径线(包括最大径a及两垂直径b、c),结节体积V=πabc/6。
术前在超声引导下穿刺活检以获得明确病理诊断。所有超声检查均由一名有经验的超声医师独立完成,以避免不同操作者对结果可能产生影响。检查图像均保存于超声仪器硬盘内。
1.3.2 术中操作激光消融(LA):所有患者均住院治疗。再次全面超声扫查,根据病变的位置,选择合适的体位,充分暴露手术部位,确定进针点、进针角度和布针方案。其中,≤1 cm组及1~2 cm组使用一根光纤;2~3 cm组使用两根光纤,两根光纤之间的距离为1.5 cm。超声定位后常规消毒铺巾,1%利多卡因进针点局麻,然后逐层麻醉至肝包膜,选择肋间进针,超声引导下尽量选择先经过部分正常肝脏,将21 G穿刺针置入结节预定部位。穿刺应准确定位,避免反复多次穿刺,导致肿瘤种植、损伤邻近组织或肿瘤破裂出血等。然后退出针芯,插入激光光纤,平齐穿刺针时,后退穿刺针卡紧接口,使光纤尖端裸露10 mm。激光消融采用输出功率为5 W,输出能量1800~3600 J。一次消融时间为输出能量/(60×输出功率)min。踩下Echolaser激光控制踏板,持续进行激光消融。全程在超声连续监视下进行。治疗中行心电监护、吸氧,严密监测心率、血压、血氧饱和度的变化,每15~30 min测量一次并记录,注意观察病人面色表情,询问有无不适并给与相应处理和心理支持,以缓解情绪。随着激光能量的释放,光纤尖端出现回声增强区并不断扩大,逐渐覆盖结节。本研究采用多针多点消融方法,消融要确保安全边界,即超出原结节大小最少5 mm的消融范围。对于可见滋养血管的结节,可先阻断滋养血管,阻断成功后结节血流明显减少,然后再消融结节。对于较大的结节,为确保消融完全,一般先消融结节深部,再向上退针继续消融结节的浅表部位。对于囊性为主的结节,可先行囊液抽吸,然后再按以上方法进行治疗。消融结束后,直接进行针道消融,防止针道播散。治疗结束前再次行全面超声检查,等待气体部分消散,确定消融范围已完全覆盖肿瘤,力求5 mm的安全消融边界,排除发生肿瘤破裂、出血、血气胸等并发症的可能因素。
1.3.3 术后护理及评估治疗完毕,穿刺点用无菌纱布包扎,局部盐袋压迫以防出血或血肿形成。休息半小时,观察无任何不适后方可用平车送回病房。嘱病人卧床休息24 h,并观察穿刺部位有无渗血、出血。术后禁食4~6 h后方可进食清淡饮食。术后当天应严密观察血压、脉搏、呼吸,1次/h,连续6次平稳后停止。给与止血、护肝、预防感染、镇痛等治疗措施,预防并发症的发生;并发症发生时,应积极处理。
消融治疗后1 d对患者行超声检查及实验室检查等。超声检查评估消融灶的大小、血流及造影增强模式等。尤其是超声造影观察结节的灌注情况,判断是否完全消融。测量消融结节的3条径线(包括最大径a及两条垂直径b、c)。计算消融结节体积V=πabc/6。实验室检查血常规、生化常规、凝血功能、和血清肿瘤标志物(AFP等)。
1.4 统计学分析所有数据均采用SPSS19.0统计软件包进行统计学分析处理。不同大小及不同部位的结节完全消融率及不同部位并发症发生率的比较用χ2检验,P<0.05表示差异有统计学意义。
2 结果 2.1 消融结节检查结果治疗功率为5W,总能量1200 J~7200 J,总治疗时间12.7±4.8 min(范围4~24 min)。超声造影观察消融结节的灌注情况,判断是否完全消融,消融结节在动脉相、门脉相及延迟相均未见增强,我们便认为原结节完全消融。65个病灶超声造影显示三相未见增强,并且范围超出原结节大小,完全消融率为89.0%。≤1 cm组、1~2 cm组、2~3 cm组病灶的完全消融率分别为100.0%(22/22)、86.4%(19/22)、82.7%(24/29),P>0.05(P=0.133),3组间差异没有统计学意义(表 1)。高危组和非高危组病灶的完全消融率分别为85.7%(30/35)、92.1%(35/38),P>0.05(P=0.383),两组之间的差异没有统计学意义(表 2)。
| 表 1 不同大小结节完全消融比较 Table 1 Comparison of complete ablation of nodules of different sizes |
| 表 2 不同部位结节完全消融比较 Table 2 Comparison of complete ablation of nodules at different sites |
所有患者没有发生重大并发症或死亡。在高危组,3例患者发生轻微的并发症,其中腹水1 例(2~3 cm组),胸腔积液2 例(1~2 cm 组);在非高危组,2 例患者发生轻微并发症,其中发热1 例(2~3 cm 组),腹水1 例(1~2 cm 组)。手术过程中,81.8%的患者在穿刺点或者上腹部有轻至中度的疼痛或者右肩放射痛,但不需治疗,治疗结束后疼痛即刻消失。并发症发生率在高危组和非高危组分别为9.1%(3/33)、5.7%(2/35),P>0.05(P=0.594),两组之间的差异没有统计学意义(表 3)。
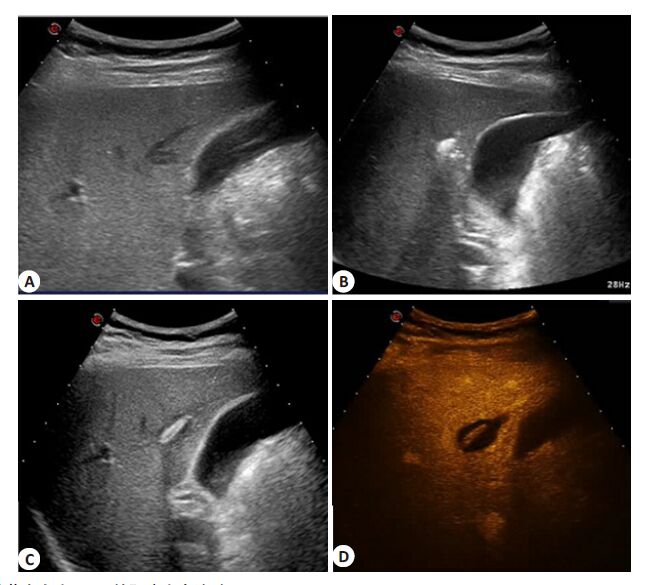
|
图 1 结节大小为5 mm的肝癌完全消融 Figure 1 Representative ultrasound images showing complete ablation of hepatocellular carcinoma of 5 mm in a 49-year-old male patient. A nodular lesion was found in the S5 with a dimension of 4 mm×5 mm, and was pathologically identified as HCC. A: A nodule <5 mm from the gallbladder, B: Gas covered nodule gradually in the process of laser ablation, C: Ultrasonogram of ablation lesion after LA procedure, D: Contrastenhanced ultrasound of the ablation lesion (three-phase had no enhancement; MI=0.1). |
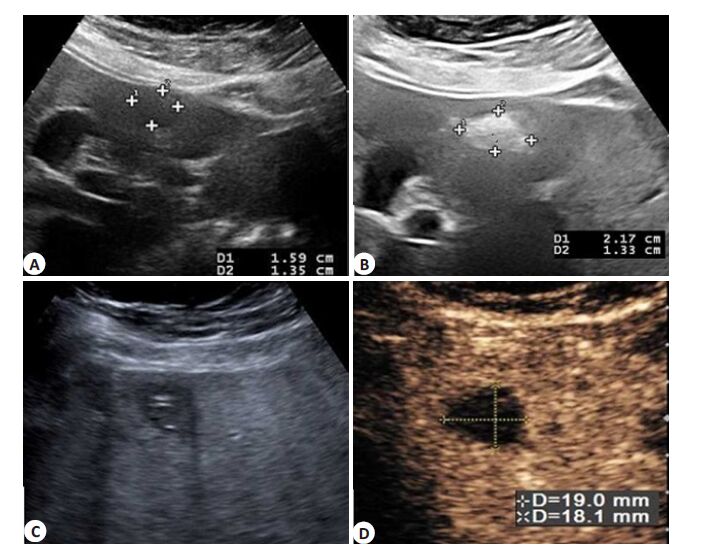
|
图 2 结节大小为16 mm的乳腺癌肝转移完全消融 Figure 2 A representative case of complete ablation of breast cancer liver metastases of 16 mm in a 48-year-old female patient. The nodular lesion was located in the S4 with adimension of 16 mm×13 mm. A: A nodule <5 mm in the liver capsule and gallbladder; B: Gas covered nodule gradually in the process of laser ablation; C: Ultrasonogram of ablation lesion after LA procedure; D: Contrast-enhanced ultrasound of the ablated lesion. Three-phase had no enhancement (MI=0.1). |
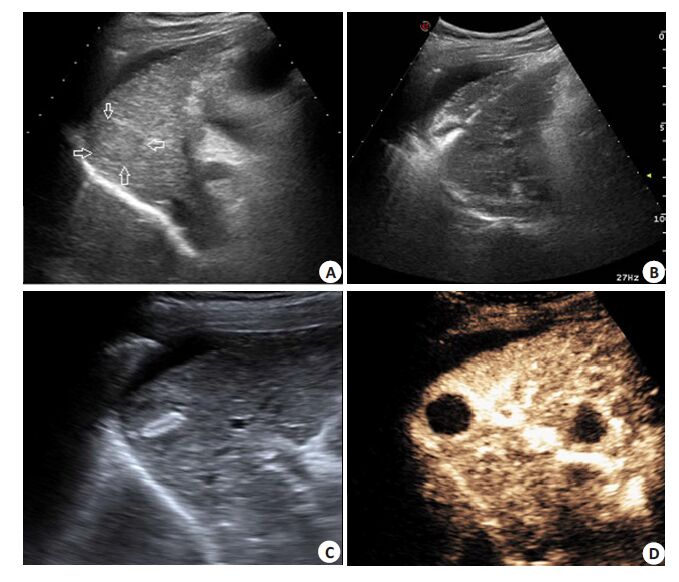
|
图 3 结节大小为21 mm的原发性肝细胞性肝癌完全消融 Figure 3 A representative case showing complete ablation of hepatocellular carcinoma of 21 mm in a 53-year-old male patient. A nodular lesion was found in the S6 with a dimension of 21 mm×17mm, and pathologically dentified as HCC. A: nodule <5 mm in the diaphragm; B: Gas covered nodule gradually in the process of double needle laser ablation (two needle point distance was about 1.5 cm); C: Ultrasonogram of the ablated lesion after LA procedure; D: Contrast-enhanced ultrasound of the ablation lesion. Three-phase had no enhancement (MI=0.1). |
| 表 3 不同部位结节并发症比较 Table 3 Comparison of complications at different sites |
激光消融(LA)是一种局部热消融方法,文献报道其可较好的运用于小肝癌的消融治疗[26-27]。本研究采用激光消融对治疗小肝癌进行了进一步研究,将肝癌分为≤1 cm组、1~2 cm组、2~3 cm组。结果显示激光消融小肝癌的完全消融率为89.0%。≤1 cm组、1~2 cm组、2~3 cm组病灶的完全消融率分别为100%、86.4%、82.7%,P>0.05(P=0.133),3组间差异没有统计学意义。这进一步说明激光消融用于治疗<3 cm肝癌结节效果明确。另外本研究还将肝癌分为高危组和非高危组病灶进行了激光消融治疗,结果显示高危组和非高危组病灶的完全消融率分别为85.7%、92.1%,P>0.05(P=0.383),两组之间的差异没有统计学意义。这说明激光消融对于高危部位的肝癌结节的消融能达到非高危部位同样的消融效果。这可能主要是因为其不像RFA受组织阻抗的影响,激光消融范围稳定,如能保持光纤前端10 mm,侧向5 mm,一般不会对重要脏器产生损伤。因此对于靠近重要脏器的小肝癌激光消融可能是理想选择。
在术后副作用及并发症方面,LA比其他热消融要有明显减少。轻微的副作用包括腹痛、体温升高、包膜下血肿形成、心动过缓、胸腔积液和轻度肝损伤等。极少数患者发生了严重并发症。Francica等[27]报道并发症发生率为1.9%。Caspani 等[28]治疗高危位置小肝癌均未发生严重并发症,4名患者(8.16%)在术后6~24 h内发生轻微的并发症(1例腹水,2例腹水和有症状胸腔积液同时存在,1例有症状胸腔积液),但均不需治疗。所有患者诉不同程度的疼痛。Fiedler等[29]报道应用LA治疗转移性肝癌病人20例58个病灶,未发现临床相关并发症。本研究中所有患者没有发生重大并发症或死亡。在高危组,3例患者发生轻微的并发症,其中腹水1例(2~3 cm组),胸腔积液2例(1~2 cm组);在非高危组,2例患者发生轻微并发症,其中发热1例(38 ℃,2~3 cm组),腹水1例(1~2 cm组)。手术过程中,81.8%的患者在穿刺点或者上腹部有轻至中度的疼痛或者右肩放射痛,但不需治疗,治疗结束后疼痛即刻消失。轻微并发症发生率在高危组和非高危组分别为9.1%(3/33)、5.7%(2/35),P>0.05(P=0.594),两组之间的差异没有统计学意义。这表明不管肿瘤是否位于高危位置,并发症的发生与其不相关。并发症在1~2 cm组与2~3 cm组之间的发生率也没有统计学意义。由此可见,并发症与结节大小及光纤数目不相关。因此,对于不同部位的肝肿瘤,激光消融能较安全达到消融效果。LA发生并发症率较低主要原因:一方面可能是由于LA使用的穿刺针明显较RFA和MWA小有关,另一方面LA本身产生的消融范围稳定,热效应和有效杀伤范围较其他的热消融小有关。
因此,激光消融用于治疗<3 cm肝癌结节效果明确。激光消融可较好的运用于不同大小、不同部位小肝癌的消融治疗。激光消融对于高危部位的肝癌结节的消融能达到非高危部位同样的消融效果,激光消融是高危部位小肝癌消融治疗的理想选择。
本研究的局限性有:(1)样本量较小,病理类型单一,没有包含胆管癌等其它类型肝癌;(2)随访期较短,应至少随访12个月,对消融后的有效性进一步进行追踪观察,并研究患者的生存率;(3)本研究为回顾性研究,今后还需要多中心、大样本病例前瞻性研究进行证明。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90. DOI: 10.3322/caac.v61:2. |
| [2] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12): 2893-917. DOI: 10.1002/ijc.v127:12. |
| [3] | Chen WQ, Zeng HM, Zheng RS, et al. Cancer incidence and mortality in China, 2007[J]. Chin J Cancer Res, 2012, 24 (1): 1-8. DOI: 10.1007/s11670-012-0001-6. |
| [4] | Llovet JM, Mas X, Aponte JJ, et al. Cost effectiveness of adjuvant therapy for hepatocellular carcinoma during the waiting list for liver transplantation[J]. Gut, 2002, 50 (1): 123-8. DOI: 10.1136/gut.50.1.123. |
| [5] | Bruix J, Sherman M. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42 (5): 1208-36. DOI: 10.1002/hep.v42:5. |
| [6] | Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008[J]. J Hepatol, 2008, 48 (Suppl 1): S20-37. |
| [7] | Livraghi T. Radiofrequency ablation of hepatocellular carcinoma[J]. Surg Oncol Clin N Am, 2011, 20 (2): 281-99. DOI: 10.1016/j.soc.2010.11.010. |
| [8] | Martin RC, Scoggins CR, Mcmasters KM. Safety and efficacy of microwave ablation of hepatic tumors: a prospective review of a 5-year experience[J]. Ann Surg Oncol, 2010, 17 (1): 171-8. DOI: 10.1245/s10434-009-0686-z. |
| [9] | Lloyd DM, Lau KN, Welsh F, et al. International multicentre prospective study on microwave ablation of liver tumours: preliminary results[J]. HPB (Oxford), 2011, 13 (8): 579-85. DOI: 10.1111/j.1477-2574.2011.00338.x. |
| [10] | Bhardwaj N, Strickland AD, Ahmad F, et al. Microwave ablation for unresectable hepatic tumours: clinical results using a novel microwave probe and generator[J]. Eur J Surg Oncol, 2010, 36 (3): 264-8. DOI: 10.1016/j.ejso.2009.10.006. |
| [11] | Boutros C, Somasundar P, Garrean S, et al. Microwave coagulation therapy for hepatic tumors: review of the literature and critical analysis[J]. Surg Oncol, 2010, 19 (1): e22-32. DOI: 10.1016/j.suronc.2009.02.001. |
| [12] | Inokuchi R, Seki T, Ikeda K, et al. Percutaneous microwave coagulation therapy for hepatocellular carcinoma: increased coagulation diameter using a new electrode and microwave generator[J]. Oncol Rep, 2010, 24 (3): 621-7. |
| [13] | 简志祥, 侯宝华, 孙建, 等. 肝动脉化学药物栓塞, B超引导无水酒精瘤内注射和微波射频消融在肝癌肝移植前的应用[J]. 南方医科大学学报, 2006 (12): 1736-7. |
| [14] | Livraghi T, Solbiati L, Meloni MF, et al. Treatment of focal liver tumors with percutaneous radio-frequency ablation: complications encountered in a multicenter study[J]. Radiology, 2003, 226 (2): 441-51. DOI: 10.1148/radiol.2262012198. |
| [15] | Mulier S, Mulier P, Ni Y, et al. Complications of radiofrequency coagulation of liver tumours[J]. Br J Surg, 2002, 89 (10): 1206-22. DOI: 10.1046/j.1365-2168.2002.02168.x. |
| [16] | Rhim H, Yoon KH, Lee JM, et al. Major complications after radiofrequency thermal ablation of hepatic tumors: spectrum of imaging findings[J]. Radiographics, 2003, 23 (1): 123-34. DOI: 10.1148/rg.231025054. |
| [17] | Komorizono Y, Oketani M, Sako K, et al. Risk factors for local recurrence of small hepatocellular carcinoma tumors after a single session, single application of percutaneous radiofrequency ablation[J]. Cancer, 2003, 97 (5): 1253-62. DOI: 10.1002/(ISSN)1097-0142. |
| [18] | Ebara M, Okabe S, Kita K, et al. Percutaneous ethanol injection for small hepatocellular carcinoma: therapeutic efficacy based on 20-year observation[J]. J Hepatol, 2005, 43 (3): 458-64. DOI: 10.1016/j.jhep.2005.03.033. |
| [19] | Koda M, Ueki M, Maeda Y, et al. Percutaneous sonographically guided radiofrequency ablation with artificial pleural effusion for hepatocellular carcinoma located under the diaphragm[J]. AJR Am J Roentgenol, 2004, 183 (3): 583-8. DOI: 10.2214/ajr.183.3.1830583. |
| [20] | Poggi G, Gatti C, Cupella F, et al. Percutaneous US-guided radiofrequency ablation of hepatocellular carcinomas: results in 15 patients[J]. Anticancer Res, 2001, 21 (1B): 739-42. |
| [21] | Horigome H, Nomura T, Nakao H, et al. Percutaneous radiofrequency ablation therapy using a clustered electrode for malignant liver tumors[J]. J Clin Gastroenterol, 2001, 32 (5): 418-22. DOI: 10.1097/00004836-200105000-00012. |
| [22] | Eickmeyer F, Schwarzmaier HJ, Muller FP, et al. Survival after laser-induced interstitial thermotherapy of colorectal liver metastases-a comparison of first clinical experiences with current therapy results[J]. Rofo, 2008, 180 (1): 35-41. DOI: 10.1055/s-2007-963565. |
| [23] | Puls R, Langner S, Rosenberg C, et al. Laser ablation of liver metastases from colorectal cancer with Mr thermometry: 5-year survival[J]. J Vasc Interv Radiol, 2009, 20 (2): 225-34. DOI: 10.1016/j.jvir.2008.10.018. |
| [24] | Pacella CM, Francica G, Di Lascio FM, et al. Long-term outcome of cirrhotic patients with early hepatocellular carcinoma treated with ultrasound-guided percutaneous laser ablation: a retrospective analysis[J]. J Clin Oncol, 2009, 27 (16): 2615-21. DOI: 10.1200/JCO.2008.19.0082. |
| [25] | Pompili M, Pacella CM, Francica G, et al. Percutaneous laser ablation of hepatocellular carcinoma in patients with liver cirrhosis awaiting liver transplantation[J]. Eur J Radiol, 2010, 74 (3): e6-e11. DOI: 10.1016/j.ejrad.2009.03.012. |
| [27] | Francica G, Petrolati A, Di Stasio E, et al. Effectiveness, safety, and local progression after percutaneous laser ablation for hepatocellular carcinoma nodules up to 4 cm are not affected by tumor location[J]. AJR Am J Roentgenol, 2012, 199 (6): 1393-401. DOI: 10.2214/AJR.11.7850. |
| [28] | Caspani B, Ierardi AM, Motta F, et al. Small nodular hepatocellular carcinoma treated by laser thermal ablation in high risk locations: preliminary results[J]. Eur Radiol, 2010, 20 (9): 2286-92. DOI: 10.1007/s00330-010-1766-y. |
| [29] | Fiedler VU, Schwarzmaier HJ, Eickmeyer F, et al. Laser-induced interstitial thermotherapy of liver metastases in an interventional 0.5 Tesla MRI system: technique and first clinical experiences[J]. J Magn Reson Imaging, 2001, 13 (5): 729-37. DOI: 10.1002/jmri.v13:5. |
 2016, Vol. 36
2016, Vol. 36

