2. 公共卫生与热带医学学院卫生检测中心,广东 广州 510515
2. Hygiene Detection Center, School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, China
胰岛素(INS)是治疗糖尿病最常用和最有效的药物,对糖尿病的治疗有着不可替代的作用,且使用过程中不会对人体产生特别的伤害。但由于INS自身稳定性差,口服或者其它非注射途径给药后易被胃肠道内强酸、碱以及消化酶破坏或降解,因此生物利用度较低[1]。近年来,具有良好生物相容性、生物可降解性的高分子材料已应用于纳米给药系统,利用高分子材料的优良性能使之成为INS的载体在一定程度上可达到以下目的[2-5]:①药物经高分子载体材料包埋后稳定性增加,可避免药物经胃肠道被酶降解;②形成的纳米给药系统可通过细胞间通道或被消化道派氏淋巴结上的M细胞吞噬而增加药物吸收;③由高分子载体材料制得的INS缓控释制剂可延长降血糖时间,减少给药次数,提高患者顺应性。本课题组在前期实验中以聚己内酯(PCL)与聚乙二醇(PEG)为原料合成了两亲性嵌段共聚物,试探性地考察了以其作为INS载体材料时对药物的包埋效果及体外释放性能,实验证明该载体材料对INS的包封率较高但存在较明显的突释效应[6],因此为降低突释效应并改善该纳米给药系统的性能,本文在PEG、PCL链段的基础上引入聚乙烯亚胺(Polyethyleneimine,PEI)嵌段,合成了新的载体材料即五嵌段聚合物PEI-PCLPEG-PCL-PEI。
本实验首先采用开环聚合法合成三嵌段聚合物聚己内酯/聚乙二醇/聚己内酯(PCL-PEG-PCL),再通过迈克尔加成反应将丙烯酰化的三嵌段聚合物接枝到PEI的伯氨基上,最终得到五嵌段聚合物PEI-PCL-PEGPCL-PEI;以该聚合物为药物载体材料,利用溶剂挥发法制备聚合物载INS纳米粒,并进一步考察了该纳米粒的理化性质和体外释药性能,以期为INS的制剂开发提供参考。
1 材料和方法 1.1 仪器与试剂Malvern-3000Hs型光子相关光谱仪(英国马尔文公司),FA2204B型分析天平(上海佑科仪表有限公司),DF101S型集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂),DZF6050型真空干燥箱(巩义市英峪予华仪器厂),FD-1B-50型冷冻干燥机(北博医康有限公司),RE-201D型旋转蒸发仪(巩义市英峪予华仪器厂),Nicolet 6700型傅里叶红外光谱仪(美国赛默飞世尔公司),Avance Ⅱ 40 型核磁共振波普仪(德国布鲁克公司),RF-5301PC 型荧光检测仪(日本岛津公司),UV-1700 型紫外分光光度计(日本岛津公司),Pico 21型离心机(美国赛默飞世尔公司),Avanti J26XP型高速冷冻离心机(美国贝克曼公司),H-7650型透射电子显微镜(日本Hitachi公司)。
ε-己内酯(ε-CL,纯度99%,经CaH2干燥后减压蒸馏)、聚乙二醇(PEG2000)、聚乙烯亚胺(PEI10000)、辛酸亚锡、芘均购于阿拉丁公司,胰岛素原料药(徐州万邦,批号1503A17),考马斯亮蓝G-250(MYM公司),透析袋(截留相对分子质量8000~14 000,科昊生物工程有限公司),水为去离子水,试剂均为分析纯。
1.2 五嵌段聚合物PEI-PCL-PEG-PCL-PEI的合成 1.2.1 三嵌段聚合物PCL-PEG-PCL的合成采用开环聚合法合成PCL-PEG-PCL三嵌段聚合物。精密称量适量PEG2000和ε-CL,置于50 mL的干燥圆底烧瓶中,以l% ε-CL 摩尔质量的辛酸亚锡作为催化剂进行反应。反应装置抽真空通氮气后在125 ℃条件下油浴加热搅拌反应24 h。反应结束后向反应液中加入适量二氯甲烷,再逐滴滴入大量无水冷乙醚中沉淀,过滤,收集白色粉末状产物。重复上述纯化步骤3次后将产物在40 ℃下真空干燥至恒重。
1.2.2 丙烯酸酯封端的PCL-PEG-PCL的合成将上述合成的三嵌段聚合物PCL-PEG-PCL置于50 mL圆底烧瓶中,加入约10 mL甲苯搅拌至完全溶解。再在冰浴条件下分别加入三乙胺和丙烯酰氯(反应摩尔比为三乙胺∶丙烯酰氯∶三嵌段聚合物PCL-PEG-PCL=4∶4.2∶1),反应装置抽真空通氮气后在80 ℃条件下油浴加热搅拌反应8 h。反应结束后,反应液过滤除去三乙胺盐酸盐结晶。滤液在过量冷正己烷中沉淀,抽滤,收集白色粉末状产物,40 ℃真空干燥至恒重。
1.2.3 五嵌段聚合物PEI-PCL-PEG-PCL-PEI 的合成利用Michael加成反应合成五嵌段聚合物。按投料比称取一定量的PEI10000 和丙烯酸酯封端的PCLPEG-PCL并将两者分别溶于约7 mL氯仿。先将PEI氯仿溶液在55 ℃、惰性气体氛围中搅拌至完全溶解,再将丙烯酸酯封端的PCL-PEG-PCL氯仿溶液逐滴加入上述溶液,反应装置抽真空通氮气后继续在55 ℃条件下搅拌回流反应24 h。反应结束后,降至室温,反应液用透析袋(MWCO=8000~14 000)在三氯甲烷中透析24 h以除去未反应单体,再在过量冷石油醚中沉淀,得到的白色沉淀用少量二氯甲烷溶解后逐滴加入去离子水中搅拌过夜,挥发有机溶剂后冷冻干燥得白色粘稠状产物。合成路线如图 1所示。
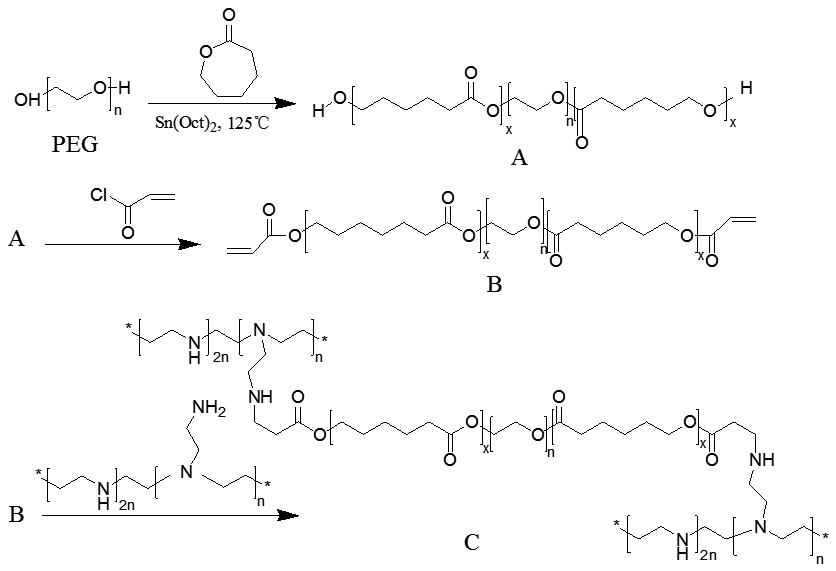
|
图 1 五嵌段聚合物的合成路线 Figure 1 Synthetic scheme of the copolymers. A: PCL-PEG-PCL; B: PCL-PEG-PCL acrylated; C: PEI-PCL-PEG-PCL-PEI. |
以溴化钾为分散剂,将纯化后的合成产物于室温下碾磨成粉末,取适量样品压片,在400~4 000 cm-1波数扫描,测定红外吸收光谱。
1.3.2 核磁共振氢谱(1H-NMR)表征将纯化后的合成产物溶于氘代氯仿(CDCl3),以四甲基硅烷(TMS)作为内标物,进行1H-NMR光谱(400 MHz)表征。
1.3.3 临界聚集浓度的测定采用芘荧光法测定五嵌段聚合物的临界聚集浓度即CAC值。CAC值是表征聚合物自组装特性和结构稳定性的重要参数。配制4.8×10-3 g/L的芘-丙酮溶液适量,并向10 mL西林瓶中加入125 μL芘-丙酮溶液,振荡摇匀,50 ℃鼓风干燥使丙酮挥发殆尽;以1 g/L空白聚合物纳米溶液作为母液稀释配置0.5~5×10-5 g/L共9个不同质量浓度的聚合物溶液,分别向丙酮挥发殆尽的西林瓶中加入上述系列聚合物溶液5 mL,使芘的终浓度为6×10-7 mol/L,65 ℃恒温水浴3.5 h,室温下避光放置过夜,待测。固定发射波长393 nm,激发和发射的狭缝均为3 nm,扫描速度为“super”,在300~370 nm扫描系列聚合物溶液,记录不同质量浓度的聚合物溶液在337 nm和334 nm处的荧光强度I337和I334,并以I337/I334的比值对聚合物质量浓度的对数作图,所得曲线中低浓度区域的水平切线和中间浓度区域的切线相交于一点,该点对应的聚合物质量浓度即为该聚合物体系的CAC值。
1.4 INS的含量测定 1.4.1 检测波长的确定将一定量的INS-考马斯亮蓝溶液在400~700 nm波长范围内进行紫外吸收波长扫描,获知其最大吸收波长在595 nm处;将空白聚合物纳米粒溶液在相同条件下进行紫外吸收扫描发现无明显紫外吸收,可知聚合物对INS的检测无干扰,因此建立紫外分析方法来检测聚合物载INS纳米粒中INS的含量是可行的。
1.4.2 标准曲线的建立精密称取25.0 mg INS,溶于0.01 mol/L HCl 溶液中,定容至25 mL,配成浓度为1.00 mg/mL的INS母液;分别吸取母液0.2、0.4、0.5、0.6、0.8、1.0、1.5、2.0 mL至10 mL容量瓶,并用0.01 mol/LHCl溶液定容至10 mL,得到一系列不同浓度的标准样品;准确量取上述标准样品1.0 mL,加入考马斯亮蓝G-250试剂4 mL,摇匀,采用0.01 mol/L HCl溶液同法制得的样品为空白对照,在10 min~1 h内,在紫外分光光度计上于595 nm处测定吸光度值,将测得的吸光度值与对应的INS浓度关系线性拟合,得到标准曲线回归方程。
1.5 载INS纳米粒的制备采用溶剂挥发法制备聚合物载INS纳米粒。精密称取适量INS,溶于10 mL、0.01 mol/L 的HCl溶液,然后用1 mol/LNaOH溶液调节其pH值至5.5~6.0;再将溶于0.4 mL二氯甲烷的聚合物在磁力搅拌下逐滴滴加(10 s/d)至上述胰岛素溶液,室温搅拌一段时间后于40 ℃条件下持续搅拌2~3 h,4 ℃、25 000 r/min条件下离心1 h 并收集离心沉淀,去离子水洗涤3 次,冷冻干燥,即得聚合物载INS纳米粒。同法制备空白纳米粒。
1.6 包封率及载药量的测定分别将不同投药比的10 mL空白聚合物纳米粒溶液和聚合物载INS纳米粒溶液在4 ℃、25 000 r/min条件下离心1 h后收集上清液。采用考马斯亮蓝G-250染色法(Bradford法)测定INS含量[7],再根据下式计算聚合物载药纳米粒的包封率和载药量。
包封率(EE%)=(INS的总质量-游离INS的质量)/投药总质量×100%
载药率(DL%)=(INS的总质量-游离INS的质量)/纳米制剂总质量×100%
1.7 INS-PEI10K-PCL4K-PEG2K-PCL4K-PEI10K 纳米粒粒径及形态的表征采用激光粒度仪分析仪对聚合物载药纳米粒的粒度进行表征,取载INS纳米粒溶液适量,稀释使之充分分散后检测;采用透射电子显微镜(TEM)观察聚合物载药纳米粒的大小和形态,取适量聚合物载INS纳米粒溶液,稀释,滴于碳膜铜网上,停留2 min,用滤纸吸去多余的溶液,滴加3%磷钨酸溶液负染2 min,室温下干燥,透射电镜观察,拍照。
1.8 体外释药性能及释放机制考察精密称量INS原料药和冷冻干燥后的聚合物载INS 纳米粒各5 mg,分别置于5 mL 的PBS 缓冲液(0.01 mol·l-1,pH=6.0),再放入50 mL的离心管,于37±1 ℃恒温水浴,80 r/min匀速搅拌,并保持漏槽条件。于预先规定的时间点取样1 mL,同时补充等量等温的新鲜介质。样品经14 000 r/min离心30 min后取出上清液测定INS含量,计算规定时间内的药物累计释放率。每个样品平行操作3份,以累积释放率的平均值对时间绘制体外累计释放曲线。此外,以PEI10K-PCL4KPEG2K-PCL4K-PEI10K载INS 纳米粒的体外释放为例,将其各取样时间点的体外累积释药率分别与零级、一级、Niebergull、Hixcon-Crowell等7个释药模型拟合,考察载药纳米粒的体外释放行为,以相关系数r为判断依据,相关系数r越接近l,则拟合效果越好。
1.9 统计学分析使用SPSS20.0软件进行统计分析,数据用均数±标准差表示,各组间比较采用单向方差分析,以P<0.05视为存在统计差异。
2 结果 2.1 合成产物的结构及性质分析 2.1.1 FT-IR分析结果图 2A中1106 cm-1、2867 cm-1分别为三嵌段聚合物中PEG链段C-O键的伸缩振动峰和C-H的伸缩振动峰,1725 cm-1、3438 cm-1处分别为PCL链段C=O键的伸缩振动峰和末端-OH的伸缩振动峰。与PCL4K-PEG2K-PCL4K的红外光谱相比,丙烯酸酯封端的PCL4K-PEG2K-PCL4K的红外图在1636 cm-1处出现了-C=C-的特征峰,说明反应中间体合成成功。图 2C中3404 cm-1处的特征峰归属于PEI上氨基的伸缩振动峰,红外图谱结果与聚合物的预计结构一致。同理,PEI10K-PCL5K-PEG2K-PCL5K-PEI10K按同样的方法进行红外分析,也确证得到了相应的五嵌段聚合物(图 3)。
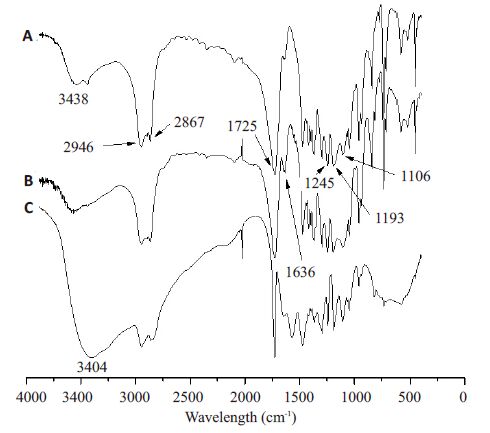
|
图 2 五嵌段聚合物PEI10K-PCL4K-PEG2K-PCL4K-PEI10K合成过程中各步产物的红外光谱图 Figure 2 Infrared spectra of the products during synthesis of PEI10K-PCL4K-PEG2K-PCL4K-PEI10K copolymers. A: PCL4KPEG2K-PCL4K; B: PCL4K-PEG2K-PCL4K acrylated; C: PEI10KPCL4K-PEG2K-PCL4K-PEI10K. |
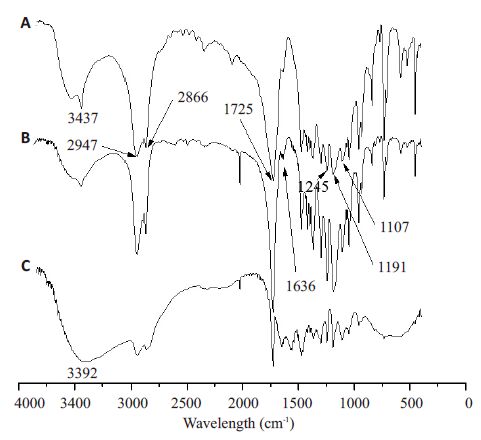
|
图 3 五嵌段聚合物PEI10K-PCL5K-PEG2K-PCL5K-PEI10K合成过程中各步产物的红外光谱图 Figure 3 Infrared spectra of the products during synthesis of PEI10KPCL5K-PEG2K-PCL5K-PEI10K copolymers. A: PCL5K-PEG2KPCL5K;B: PCL5K-PEG2K-PCL5K acrylated; C: PEI10K-PCL5KPEG2K-PCL5K-PEI10K. |
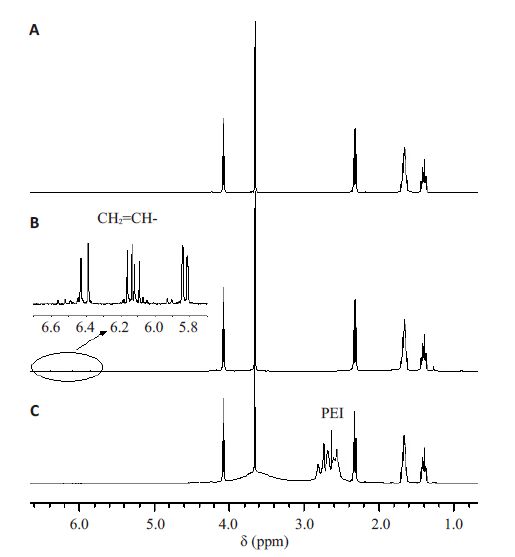
如图 4A所示,3.67 ppm处的峰是聚合物PEG重复单元(-CH2-CH2O-)中亚甲基氢的特征峰;δ=4.08、2.33、1.40、1.67 ppm处的峰均为己内酯开环后5个亚甲基氢的特征峰,其中4.08 ppm代表与氧相连的亚甲基氢的特征峰,2.33 ppm代表与羰基相连的亚甲基氢的特征峰。图 4B中δ=5.85 ppm和6.40 ppm处出现了-CH=CH2的两个β-H的特征峰,6.14 ppm处出现了-CH=CH2的α-H的特征峰,说明成功合成出了反应中间体即丙烯酸酯封端的PCL4K-PEG2K-PCL4K[8-9]。而图 4C 中-CH=CH2的两个β-H的特征峰和α-H的特征峰均未出现,说明反应第三步的产物中无未反应的反应中间体;δ=2.50~2.86 ppm 处出现了PEI 单元(-NHCH2CH2-)中亚甲基氢的特征峰,均说明成功合成出了PEI10K-PCL4K-PEG2K-PCL4K-PEI10K[10]。同理,采用相同方法对PEI10K-PCL5K-PEG2K-PCL5KPEI10K进行1H-NMR表征,确证得到相应的五嵌段聚合物(图 5)。此外,还可通过核磁谱图计算聚合物的数均相对分子质量[11],由于PEG的相对分子质量已知,五嵌段聚合物中各组分的数均相对分子质量可通过聚合物PEG/PEI 的比例和聚合物PEG/PCL 的比例推算得到。因聚合物PEG/PCL的比例可从PEG中乙撑基团的氢原子的峰面积(4H,δ3.67 ppm,-CH2CH2O-)和PCL中与氧相连的亚甲基氢原子的峰面积(2H,δ4.08ppm,-OCH2-)计算出,同理聚合物PEG/PEI的比例可从PEG 中乙撑基团的氢原子的峰面积(4H,δ3.67ppm,-CH2CH2O-)和PEI中乙撑基团的氢原子的峰面积(4H,δ2.50~2.86 ppm,-CH2CH2NH-)计算得知,故由此推算出聚合物PEI10K-PCL4K-PEG2K-PCL4KPEI10K和PEI10K-PCL5K-PEG2K-PCL5K-PEI10K的相对分子质量分别为32 550、30 299,与理论值比较接近。
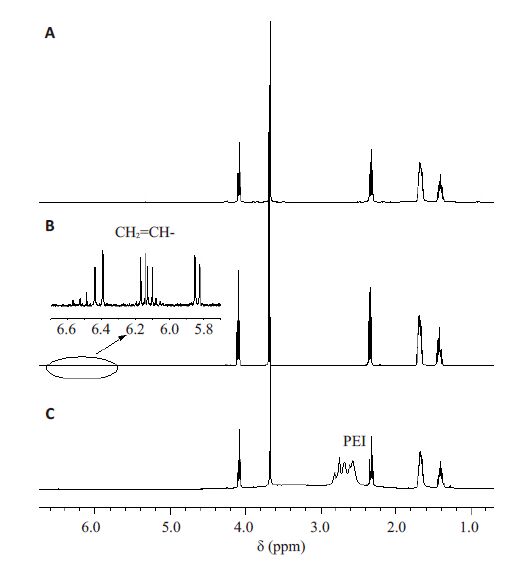
|
图 4 五嵌段聚合物PEI10K-PCL4K-PEG2K-PCL4K-PEI10K合成过程中各步产物的核磁谱图 Figure 4 1H-NMR spectra of the products during synthesis of PEI10KPCL4K-PEG2K-PCL4K-PEI10K copolymers. A: PCL4K-PEG2KPCL4K;B: PCL4K-PEG2K-PCL4K acrylated; C: PEI10K-PCL4KPEG2K-PCL4K-PEI10K. |
|
图 5 五嵌段聚合物PEI10K-PCL5K-PEG2K-PCL5K-PEI10K合成过程中各步产物的核磁谱图 Figure 5 1H-NMR spectra of the products during synthesis of PEI10K-PCL5K-PEG2K-PCL5K-PEI10K copolymers. A: PCL5KPEG2K-PCL5K; B: PCL5K-PEG2K-PCL5K acrylated; C: PEI10KPCL5K-PEG2K-PCL5K-PEI10K. |
PEI10K-PCL4K-PEG2KPCL4K-PEI10K 和PEI10K-PCL5K-PEG2K-PCL5KPEI10K的CAC值分别为10.96×10-4 g/L和8.13×10-4 g/L,当PCL链段增加时,聚合物CAC值减小,且均比普通小分子表面活性剂的CAC值低3~6个数量级,由此可见该五嵌段聚合物在水中形成纳米粒之后,即使在很低的浓度下仍能保持稳定[12]。
2.2 INS标准曲线的建立按1.4 法将一系列标准样品的吸光度值与对应的INS 浓度进行线性回归,得到标准曲线回归方程y=0.0048x+0.1428,R2=0.9976,说明INS 浓度在10~200 μg/mL范围内时,浓度与吸光度的相关性良好。
2.3 载INS纳米粒的包封率及载药量以PEI10K-PCL4K-PEG2K-PCL4K-PEI10K 为载体材料时,该聚合物载INS纳米粒不同投药比组间的包封率存在统计差异(P<0.05),不同投药比组间的载药量存在统计差异(P<0.05);因聚合物载药纳米粒的载药量更能反映载体对药物的包埋状况,故针对载药量而言,聚合物载药纳米粒20% wt投药比组与33% wt投药比组之间的载药量存在统计差异(P<0.05),20% wt投药比组与40% wt投药比之间的载药量存在统计差异(P<0.05),33% wt投药比组与40%wt投药比组之间的载药量也存在统计差异(P<0.05),同时由表 2可知,投药比为40% wt 时,相应INS 制剂的载药量最大,故选择40% wt这一投药比进行后续试验。
| 表 1 PEI10K-PCL4K-PEG2K-PCL4K-PEI10K载INS纳米粒的包封率与载药量 Table 1 Encapsulation and drug loading efficiency of insulin-loaded polymeric nanoparticles (Mean±SD, n=3) |
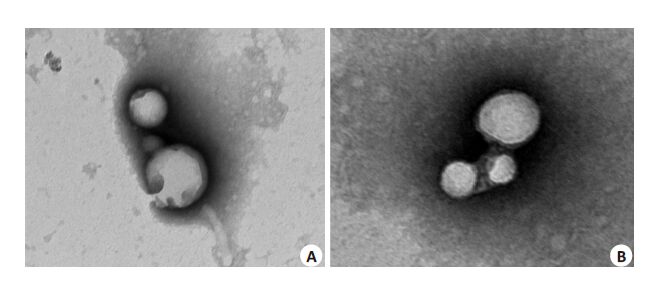
PEI10K-PCL4K-PEG2K-PCL4K-PEI10K 载INS纳米粒的粒径为175.30 ± 19.51 nm,多分散指数达0.415±0.115。由图 6A可知上述载INS纳米粒呈明显的类球状结构,粒径为80~140 nm,分散性较好。
|
图 6 载INS纳米粒的透射电镜图 Figure 6 TEM micrographs of insulin-loaded polymeric nanoparticles based on PEI10K-PCL4K-PEG2KPCL4K-PEI10K (A) and PEI10K-PCL5K-PEG2K-PCL5K-PEI10K (B) (Original magnification: ×25 000). |
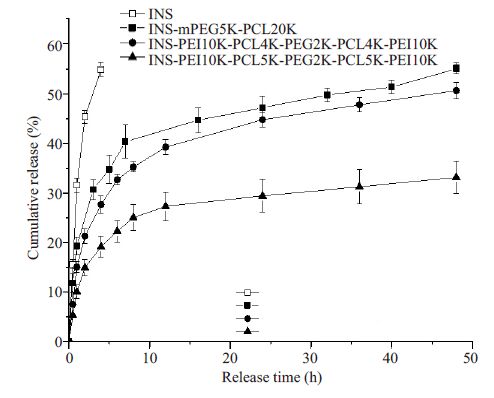
由图 7可知,INS原料药4 h后累计释药54.84%;而PEI10K-PCL4K-PEG2K-PCL4K-PEI10K 载INS 纳米粒在前6 h处于快速释放期,INS在此阶段的累计释放量也仅达32.66%,此后药物释放速率逐步趋于平缓,48 h末的累计释放量达50.66%。为阐明PEI的引入可达到降低突释的目的,合成了两嵌段聚合物mPEG5k-PCL20k,因与上述五嵌段聚合物相比,mPEG5k-PCL20k中PCL、PEG嵌段的大小比例同样为4,以该两嵌段聚合物为载体制得的载INS纳米粒在突释阶段的累计释药量明显多于前者。此外,采用1.2法合成并制备了PEI10K-PCL5K-PEG2K-PCL5K-PEI10K 载INS纳米粒,其在突释阶段的释药量为22.24%,48 h末的累计释药量达33.17%,释药时间明显延长。
|
图 7 INS原料药与不同聚合物载INS纳米粒的体外累积释放率 Figure 7 Release pattern of insulin and different insulin-loaded polymeric nanoparticles in vitro(Mean±SD, n=3). |
动力学拟合结果表明,PEI10K-PCL4K-PEG2KPCL4K-PEI10K 载INS 纳米粒的体外释放行为与Weibull模型、Riger-Peppas模型和Higuchi模型的拟合效果较好,其中又以Weibull 模型的拟合度最高(r=0.9982),即上述载INS 纳米粒的释放符合Weibull 模型,提示该INS制剂的药物释放存在延迟,这与释药初期(0~6 h)释药速度较快,随后药物呈持续释放的特点相符合[13]。
3 讨论目前,将PEI及接枝PEI的相关嵌段共聚物用来包埋蛋白类药物的研究较少,故选择PCL-PEG-PCL作为基础链段,接枝PEI 后得到性能更优异的五嵌段聚合物[14]。以该新型聚合物载药不仅能增加被包埋药物的稳定性,还可通过调节聚合物亲疏水嵌段的比例、相对分子质量大小等因素来控制药物的释放速率,进而改善药物的体外释放特性例如减少突释效应来获得较理想的缓控释制剂。
体外释药实验中,五嵌段聚合物载INS纳米粒的体外释药曲线呈两个释放相,前6 h存在突释效应,其原因可能是:①释药初期,制剂内部包埋的药物与释放介质中的药物浓度差较大;②已溶解或粘附在载药粒子表面的少量药物向释放介质中扩散造成突释效应,纯化后的聚合物载药纳米粒包封率在50%左右即可证实。此后6~48 h为体外释药的缓释期,此阶段药物释放速率相对恒定,因载体材料在释放介质中经水化溶胀后逐渐形成水化膜而延缓药物释放,同时由于载体材料体外降解速度缓慢,直至聚合物PEG和PCL之间的酯键发生断裂、酯键经氨解作用产生酰胺类化合物并最终解离、降解成聚合物碎片[15],药物才释放完全。此外,五嵌段聚合物载INS纳米粒的体外缓释效果均优于两嵌段聚合物载INS纳米粒,因pH值的变化使PEI氨基发生质子化带正电,进而与带相反电荷的INS通过静电作用聚集成核,与此同时聚合物的亲疏水嵌段在溶剂中发生自组装,上述载药内核被亲水性链段缠绕成壳后形成稳定胶束,药物分子和聚合物分子之间的相互作用增强,造成药物突释量减少;再者由于聚合物疏水嵌段PCL比例增大后,载体材料疏水性增强,释放介质进入制剂内部受阻因而延缓药物溶出,故PCL嵌段的疏水作用以及药物与载体之间的静电作用共同造成五嵌段聚合物载药纳米粒突释量减小,缓释效应明显。
对于聚合物在水中自组装形成粒子形态的差异,有研究[16]认为聚合物亲水链段的质量比或体积比(f)、相对分子质量和疏水链段与水的有效参数(X)是决定聚合物自组装结构的重要参数。也有研究认为亲水链段体积所占聚合物分子总体积的百分系数feo值反映了聚合物自组装形成的粒子形态[17-18]。本文中PEI10KPCL5K-PEG2K-PCL5K-PEI10K载INS纳米粒的体外缓释效果明显优于PEI10K-PCL4K-PEG2K-PCL4KPEI10K载INS纳米粒,因增大了疏水嵌段PCL的比例后,聚合物的feo 值减小,PEI10K-PCL4K-PEG2KPCL4K-PEI10K 的feo 值为0.73,PEI10K-PCL4KPEG2K-PCL4K-PEI10K的feo为0.69,后者的feo值更接近于囊泡的范围(0.20~0.42),故推测PEI10K-PCL4KPEG2K-PCL4K-PEI10K载INS纳米粒的形态为聚电解质胶束,PEI10K-PCL4K-PEG2K-PCL4K-PEI10K 载INS纳米粒的形态则更接近于囊泡,图 6B中后者的圆形双层膜结构明显,其结构稳定性更强[19],包封率(61.30±0.31)%更高,均可造成药物释放减缓。
本文制得的五嵌段聚合物载INS纳米粒理化性质较好,包封率和载药量较高,体外缓释效应明显且突释阶段药物释放量减少,避免了短时间内迅速大量释药而造成患者出现不良反应,故有一定的应用前景。此外,改变五嵌段聚合物中不同嵌段的比例,并以相应的聚合物为药物载体,考察各个嵌段大小对载INS纳米粒体内外性质影响的研究尚在进行中。
| [1] | Alai MS, Lin WJ, Pingale SS. Application of polymeric nanoparticles and micelles in insulin oral delivery[J]. J Food Drug Anal, 2015, 23 (3): 351-8. DOI: 10.1016/j.jfda.2015.01.007. |
| [2] | Lu X, Gao H, Li C, et al. Polyelectrolyte complex nanoparticles of amino poly(glycerol methacrylate)s and insulin[J]. Int J Pharm, 2012, 423 (2): 195-201. DOI: 10.1016/j.ijpharm.2011.12.017. |
| [3] | Peng Q, Zhang ZR, Gong T, et al. A rapid-acting, long-acting insulin formulation based on a phospholipid complex loaded PHBHHx nanoparticles[J]. Biomaterials, 2012, 33 (5): 1583-8. DOI: 10.1016/j.biomaterials.2011.10.072. |
| [4] | Du X, Zhang J, Zhang Y, et al. Decanoic acid grafted oligochitosan nanoparticles as a carrier for insulin transport in the gastrointestinal tract[J]. Carbohydr Polym, 2014, 111 (9): 433-41. |
| [5] | Lopes MA, Abrahim BA, Cabral LM, et al. Intestinal absorption of insulin nanoparticles: contribution of M cells[J]. Nanomedicine, 2014, 10 (6): 1139-51. |
| [6] | 李伟炜, 王颐婷, 沈梅, 等. mPEG-PCL聚合物囊泡的制备及INSmPEG114-PCL152囊泡体外释放特性考察[J]. 中国实验方剂学杂志, 2014, 20 (23): 15-21. |
| [7] | 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工, 2009, 23 (3): 40-2. |
| [8] | Kweon H, Yoo MK, Park IK, et al. A novel degradable polycaprolactone networks for tissue engineering[J]. Biomaterials, 2003, 24 (5): 801-8. DOI: 10.1016/S0142-9612(02)00370-8. |
| [9] | Zheng YT, Nguyen MK, He CL, et al. pH-and temperaturesensitive PCL-grafted poly(β-amino ester)-poly(ethylene glycol)-poly(β-amino ester) copolymer hydrogels[J]. Macromol Res, 2010, 18 (11): 1096-102. DOI: 10.1007/s13233-010-1110-z. |
| [10] | Liu Y, Nguyen J, Steele T, et al. A new synthesis method and degradation of hyper-branched polyethylenimine grafted polycaprolactone block mono-methoxyl poly (ethylene glycol) copolymers (hy-PEI-g-PCL-b-mPEG) as potential DNA delivery vectors[J]. Polymer, 2009, 50 (16): 3895-904. DOI: 10.1016/j.polymer.2009.06.043. |
| [11] | 何宁, 孙贺春, 徐欢喜, 等. 可降解非病毒基因载体PEG-b-(PG-g-PEI)的合成与表征[J]. 南方医科大学学报, 2013, 33 (11): 1643-7. |
| [12] | 刘艳华, 孙进, 王文苹, 等. 透明质酸接枝十八烷基聚合物的合成及表征[J]. 中国实验方剂学杂志, 2012, 18 (20): 49-52. |
| [13] | Papadopoulou V, Kosmidis K, Vlachou M, et al. On the use of the Weibull function for the discernment of drug release mechanisms[J]. Int J Pharm, 2006, 309 (1/2): 44-50. |
| [14] | Fitzsimmons RE, Uludağ H. Specific effects of PEGylation on gene delivery efficacy of polyethylenimine: interplay between PEG substitution and N/P ratio[J]. Acta Biomater, 2012, 8 (11): 3941-55. DOI: 10.1016/j.actbio.2012.07.015. |
| [15] | Liu Y, Steele T, Kissel T. Degradation of Hyper-Branched poly (ethylenimine)-graft-poly(caprolactone)-block-monomethoxyl-poly (ethylene glycol) as a potential gene delivery vector[J]. Macromol Rapid Commun, 2010, 31 (17): 1509-15. DOI: 10.1002/marc.201000337. |
| [16] | Lee JS, Feijen J. Polymersomes for drug delivery: design, formation and characterization[J]. J Control Release, 2012, 161 (2): 473-83. DOI: 10.1016/j.jconrel.2011.10.005. |
| [17] | Discher D, Eisenberg A. Polymer vesicles[J]. Science, 2002, 297 (5583): 967-73. DOI: 10.1126/science.1074972. |
| [18] | Ahmed F, Discher DE. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles[J]. J Control Release, 2004, 96 (1): 37-53. DOI: 10.1016/j.jconrel.2003.12.021. |
| [19] | Meng F, Hiemstra C, Engbers GH, et al. Biodegradable polymersomes[J]. Macromolecules, 2003, 36 (9): 3004-6. DOI: 10.1021/ma034040+. |
 2016, Vol. 36
2016, Vol. 36

