脑灰质异位(FGMH)是一种较为少见的先天畸形,是神经元移行障碍性疾病的一种,在胚胎时期神经母细胞增殖迁移过程中受干扰因素的影响而发生[1]。随着产前诊断技术的不断向深、细、精方向发展,本病越来越受到关注。产前检查是一个特殊时期的检查,胎儿解剖结构上的影像学诊断主要依靠产前超声和MRI,本病亦如此。Blondiaux等[2]研究了11例产前诊断的灰质异位胎儿,指出即使是针对性的产前超声对本病的诊断也是较难的;Manganaro等[3]则指出胎儿MRI早在孕19 周胎儿就可对中枢神经系统结构进行良好的评价,但并未对产前超声与MRI 对本病的诊断进行对比研究;Teixeira等[4]研究了后颅窝池囊肿和本病的相关性,11例中均存在有后颅窝池囊肿,提出当发现后颅窝池囊肿时应着重检查侧脑室的形态结构以排除室管膜下灰质异位。总之以往研究报道侧重点各不相同,为探讨FGMH的产前超声图像特征并评价其最佳产前诊断方法,本文在前人研究的基础上,通过对1例因脑室扩张来我院会诊的胎儿行颅脑针对性超声检查,发现侧脑室壁毛糙不规整等改变,并对近20年来的产前诊断本病的文献进行了回顾性分析,对比研究产前超声和MRI 对本病的检出率,以进一步丰富我们对胎儿大脑灰质异位的产前诊断、特征性的超声表现、合并畸形、临床表现以及预后等的认识。
1 资料与方法 1.1 一般资料孕妇34岁,电子售后商,孕3产2,第1胎自然流产,手术清宫;第2胎早孕有先兆流产史,行保胎治疗,产前发现胎儿室间隔缺损,产后行手术封堵术,现已痊愈无异。孕妇丈夫为乙肝携带者。本例为第3胎,我院首诊时间为孕26周2 d,孕周由本次妊娠末次月经确定。早孕期曾感冒,无发烧及服药史,无放射性物质接触史,无家族遗传病史,实验室检查无明显特殊。
1.2 仪器与方法超声检查使用Siemens Acuson Sequoia 512 型彩色多普勒超声仪,探头频率为4~6 MHz和8~14 MHz。胎儿因侧脑室扩张到我院会诊,应用产科超声检查条件,对胎儿颅脑进行针对性超声检查,将图像储存到磁盘,以备回顾分析研究。
对胎儿产前超声图像、产后新生儿颅脑高频超声检查图像、产后颅脑MRI检查结果进行分析,结合文献报道,探讨胎儿大脑灰质异位的产前超声表现、发生部位、合并畸形、治疗及预后等。
1.3 统计学方法产前超声及MRI对FGMH的检出率应用配对四格表资料的卡方检验。P<0.05视为差异有统计学意义。
2 结果本例26周超声检查侧脑室前角宽约0.43 cm,后颅窝池宽约1.35 cm(如图 1)。于孕31+4 d复诊超声检查显示特征性的表现:侧脑室后角及前角室壁毛糙不规则,呈“锯齿状”,结节样的高回声锯齿状物凸向侧脑室壁内,同时合并有后颅窝池轻度增大宽约1.38 cm(如图 2)。本例足月分娩,女婴,产后2 d新生儿颅脑超声检查提示侧脑室壁回声毛糙(如图 3),与产前超声所见类似。新生儿头颅MRI检查考虑灰质异位,表现为双侧脑室外侧壁不光滑,呈“锯齿状”,T1WI呈稍高信号,T2WI呈低信号,与灰质信号近似(如图 4)。证实产前超声所见。产前未行染色体及基因检查。截至目前,本例1岁余,随访未见明显相关异常。
|
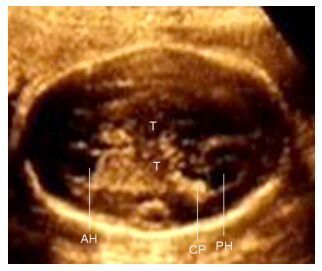
图 1 孕26周3 d超声检查结果 Figure 1 Ultrasound image of the fetus at 26 gestational week. The anterior horn of lateral ventricle (AH) was 0.43 cm, and the posterior cranial fossa was 1.35 cm. The wall of lateral ventricle was smooth, and the lesion was not obvious. T: Thalamus; CP: Choroid plexus; PH: Posterior horn of lateral ventricle. |
|
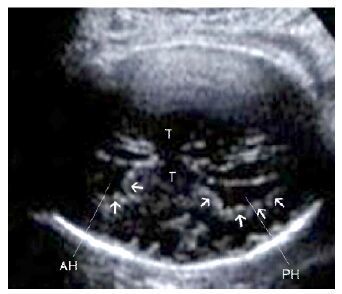
图 2 孕31周4 d超声检查结果 Figure 2 Ultrasound image of the fetus at 31 gestational weeks showing rough, irregular and serrated wall of the lateral ventricle (arrow). AH: Anterior horn of lateral ventricle; T: Thalamus; PH: Posterior horn of the lateral ventricle. |
|
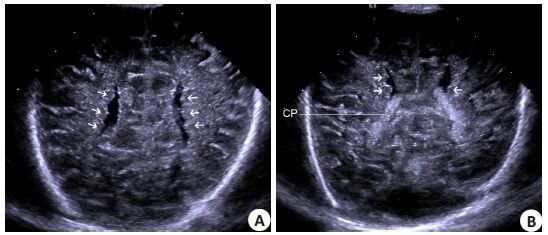
图 3 产后2 d行新生儿颅脑超声检查结果 Figure 3 Brain MRI of the fetus at 2 days after birth. A: Coronal section from top of the lateral ventricle showing rough, irregular and serrared wall of the lateral ventricle (arrow); B: Coronal section of the paraplexus showing tuberculous heterotopic gray matter of high echo convex to the lateral ventricle cavity (arrow). |
|
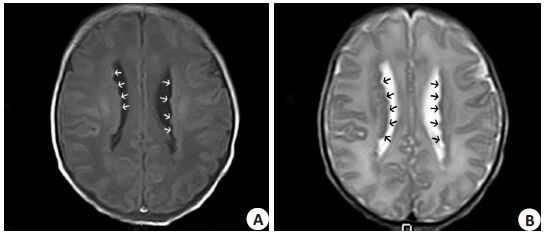
图 4 产后6 d行新生儿颅脑MRI检查结果 Figure 4 Brain MRI of the fetus at 6 days after birth. The walls of two lateral ventricles were coarse and serrated (arrows), and lesion showed a high signal on T1WI (A) and a low signal on T2WI (B), was similar to the signal of the grey matter. |
通过PubMed系统检索到产前诊断胎儿大脑灰质异位文献11篇共43例(如表 1),结合本文报道的1例进行回顾分析,经证实的病例共40例。发现大脑灰质异位产前平均诊断孕周为29.1±4.9周,全部(100%)病例在中晚孕期做出诊断,最早诊断孕周为19.5周,最晚诊断孕周为40周。文献中产前超声发现的17例FGMH 中全为室管膜下型,总结其产前特征性超声表现为:双侧/单侧侧脑室壁多发/单发、强回声/高回声、(小)结节状凸起/异位灶凸向侧脑室内,致使侧脑室壁不规则。本例灰质异位产前超声表现为侧脑室后角及前角室壁毛糙不规则,呈“锯齿状”,结节样的高回声锯齿状物凸向侧脑室壁内。与文献[5]报道吻合。活产或者引产后已证实且超声和MRI资料都有的病例有32 例。二者的FGMH检出率比较差异有统计学意义(P=0.000),详见表 2。所有病例均存在合并畸形100%(40/40),其中17(17/40, 42.5%)例合并有单侧或双侧的脑室扩张,13(13/40, 32.5%)例合并有后颅窝囊肿,8(8/40, 20%)例合并有后颅窝池增宽,7(7/40, 17.5%)例合并有胼胝体发育不良,6(6/40, 15%)例合并有其他神经元迁移障碍性疾病。活产后或引产后证实的40例中室管膜下型灰质异位35 例(87.5%, 35/40),皮层下结节状灰质异位1 例(2.5%, 1/40),局灶性灰质异位1例(2.5%, 1/40),3例未知。17例行染色体检查,均正常。8例行基因检查,6例存在有基因突变,全为filamin A(FLNA)基因突变,全为女性。
| 表 1 44例大脑灰质异位产前影像学表现及合并畸形总结表 Table 1 Imaging manifestations and associated malformation of 44 fetuses with FGMH |
| 表 2 产前超声及产前MRI检查32例脑灰质异位结果 Table 2 Chi-square test of the results of prenatal ultrasound and MRI for FGMH diagnosis in 32 cases (number of cases) |
正常神经元的移行是一个极其复杂的多因子调控过程,在胚胎第7周,侧脑室、室管膜下的生殖胚中原始神经元开始增殖,皮质神经元来源于胚胎脑室周围基质内的神经母细胞,第8周开始神经母细胞从脑中线处的胚胎神经基质处向软脑膜表面移行,多沿着放射状的神经胶质细胞移行,跨越生殖胚先移行的神经细胞形成脑皮质的深面,后移行的神经细胞形成脑皮质的表层,持续约2个月的时间,在8~16周时间内移行最旺,最终于胎儿第26~28周逐步发育成正常脑皮质的6个细胞层。而一旦此过程遭受到外界或内部因素的影响时都会产生神经元增殖、移行障碍[13]。大脑灰质异位是妊娠12周左右,由于神经元或未分化的细胞移行过程中受阻未能继续移行而停留下来,神经元在大脑不同的部位(室管膜至脑表面之间的任何位置)滞留、积聚而形成。
胎儿脑灰质异位可由外因如感染、中毒、缺血、放射损伤等[14]所致,也可由内因如某些特定的遗传基因(Xq28、17p13.3、22qll、Xq22)发生突变[15]导致。1994年Huttenlocher等[16]首次发现一个病例全为女性的家族性事件,在这些家族中的女性常有自发性流产的病史,从而推测本病与X染色体相关,最终确定是Xq28位点处的基因突变,其编码基因的产物为filamin A,可调控神经元迁移。此类为最常见的基因突变类型,常导致双侧弥漫性灰质异位[3, 17-18]。后者多见于女性,但亦可发生于男性,很多男性胎儿则因无正常X染色体而胎死宫内[18],对那些出生的男性胎儿多有严重的神经系统的智力障碍。
MRI将脑灰质异位分为室管膜下、皮层下和带状灰质异位[19]。室管膜下灰质异位为最常见的灰质异位。较多发生于侧脑室前角及三角区[20]。可分为单侧局限、双侧局限或双侧弥漫性。MRI表现为脑室周围圆形或卵圆形结节,周围无水肿,结节凸向脑室内,异位灰质在各个MRI序列均与灰质信号相同[21]。皮层下灰质异位据病灶的形态不同又可分为2种亚型:结节型和弧线型,结节型是皮层下白质内的结节状灰质异位灶;弧线型是与正常大脑灰质部分相连但不规则弧线样或漩涡状的灰质异位区[22]。带状灰质异位时异位的灰质呈边缘光滑的带状位于侧脑室和大脑皮层之间的白质内,与其相邻的脑皮质平行,与侧脑室和大脑皮层有白质分隔,异常的灰质带可以表现为围绕侧脑室形成完整的环状,也可以是不完整的环状[23]。
据表 1可知文献报道有关产前诊断胎儿脑灰质异位近两年内发现比较多,可能与检测仪器的不断精细化以及人们对本病的关注提高有关。表 1数据显示胎儿脑灰质异位主要经MRI检出,MRI是目前诊断脑灰质异位最有效的方法。回顾文献报道中43例产前诊断的灰质异位胎儿,MRI检出的室管膜下型灰质异位占绝大多数(30/31,96.8%),而且其产前MRI表现具有特征性,表现为凸向脑室内的结节状物,呈“波浪状”或“锯齿状”改变,与灰质信号相同。其余两种类型的病灶无特征性表现,其中一例为皮层下结节状灰质异位,另一例仅提示为局灶性灰质异位,虽然病灶出现在脑白质内,在MRI上灰白质信号各异,但当脑白质内出现其他相似病变时因其MRI表现不具备特征性而需要鉴别分析,因此也较难诊断。本例同样属于较常见的双侧室管膜下结节型灰质异位,产前超声及产后MRI图像显示侧脑室前角及后角内侧壁毛糙不规整呈“锯齿状”改变。
超声产前诊断本病报道较少,本例结合文献报道的且经证实的共40例产前诊断的灰质异位胎儿中产前超声检出17 例(17/40, 42.5%),较MRI 明显为低(31/40, 77.5%),且均为室管膜下灰质异位。经活产或引产后证实且有产前超声和产前MRI资料者32例,其中超声检出率43.8%(14/32),MRI检出率93.8%(30/32),二者检出率比较差异有统计学意义(P<0.001)。表明产前检查胎儿脑灰质异位MRI优于超声。文献中最早于孕23周发现室管膜下灰质异位,但要结合MRI 进行诊断[5]。Pellicer等[24]认为早孕期和中孕早期因生发基质的干扰较难发现,晚孕期有可能发现室管膜下型的结节状灰质异位灶。异位的灰质团块呈圆形或者椭圆形,不相连或相连形成波浪带状低回声围绕侧脑室壁[5],侧脑室形态异常,可伴侧脑室扩张,合并存在其他颅内畸形时有相应超声表现。其他类型的脑灰质异位在超声下无法发现是因为人脑白质与脑灰质间无明显的声阻抗差,在超声上比较其回声强度无明显差异,而位于室管膜下的脑灰质由于与脑脊液邻近,脑脊液与脑灰质间声阻抗特性差明显,界面反射强,可清晰辨别而发现。本例因病灶位于侧脑室壁且合并存在有后颅窝池增宽而被发现。但本例孕26周时尚未发现侧脑室壁毛糙,可能与神经元迁移尚未完成,病灶太小未被发现有关。孕31周时则具有典型的室管膜下结节型灰质异位改变,可能与30周后脑室周围神经基质基本消失有关。
脑灰质异位可单独存在亦可合并其它畸形尤其是颅内合并畸形如其他神经元移行障碍性疾病[6]、胼胝体发育不良[2, 7]、透明隔腔消失、脑膜脑/脊髓脊膜膨出、小脑及颅后窝池异常[2, 4, 6, 25],还有某些染色体异常的软指标如侧脑室扩张,后颅窝池增宽[2, 8]、某些代谢性疾病等。本文研究发现确诊的40例中产前超声共发现其他颅内合并畸形33例(33/40, 82.5%),最多者为脑室扩张,17例(17/33, 51.5%),其次为后颅窝囊性暗区,13例(13/33, 39.4%),其余较多合并畸形包括胼胝体发育不良7例(7/33, 21.2%),后颅窝池增宽7例(7/33, 21.2%),其他神经元移行异常6例(6/33, 18.2%)。包括本例在内说明产前超声对FGMH的其他颅内合并异常检出较敏感。产前MRI检出其他颅内合并畸形33例,与产前超声相当。
灰质异位的主要临床表现为:(1)迟发的难治性癫痫,抗癫痫药物疗效差;(2)智力障碍;(3)神经系统功能失调[26]。本病治疗的关键是对症治疗。主要是控制癫痫发作,包括药物治疗和手术治疗。对药物难治性癫痫患者,手术切除异位的灰质团,可获得良好的效果,尤单侧单发结节型,手术效果最好[27]。单独发生的脑灰质异位早期发育可正常,无任何症状出现,越接近儿童期异常逐渐出现。值得一提的是很多新生儿脑内亦可见异位的神经元,但其很快便退化或者完成移行,在生后数月内消失,并非真正的灰质异位[28]。本例因目前无任何临床表现,应密切随访观察,以便了解日后神经系统发育状况而及时干预。
综上所述,只有典型的室管膜下型灰质异位产前超声才能诊断,并能较好的显示其图像特点,其图像特点为侧脑室壁不规则,毛糙呈“锯齿状”或“连续波浪状”,结节样的高回声锯齿状物凸向侧脑室壁内,常合并存在其他颅内畸形如单侧或双侧侧脑室扩张、后颅窝囊肿及后颅窝池增宽等。当超声不能明确诊断时,产前MRI 的检查是必要的。
| [1] | Aghakhani Y, Kinay D, Gotman J, et al. The role of periventricularnodular heterotopia in epileptogenesis[J]. Brain,2005, 128 (Pt 3) : 641-51. |
| [2] | Blondiaux E, Sileo C, Nahama-Allouche C, et al. Periventricularnodular heterotopia on prenatal ultrasound and magnetic resonanceimaging[J]. Ultrasound Obstet Gynecol,2013, 42 (2) : 149-55. DOI: 10.1002/uog.12340. |
| [3] | Manganaro L, Saldari M, Bernardo S, et al. Bilateral subependymalheterotopia, ventriculomegaly and cerebellar asymmetry: fetal MRIfindings of a rare association of brain anomalies[J]. J Radiol CaseRep,2013, 7 (11) : 38-45. |
| [4] | Teixeira SR, Blondiaux E, Cassart M, et al. Association ofperiventricular nodular heterotopia with posterior fossa cyst: aprenatal case series[J]. Prenat Diagn,2015, 35 (4) : 337-41. DOI: 10.1002/pd.4543. |
| [5] | Mitchell LA, Simon EM, Filly RA, et al. Antenatal diagnosis ofsubependymal heterotopia[J]. AJNR Am J Neuroradiol,2000, 21 (2) : 296-300. |
| [6] | Malinger G, Kidron D, Schreiber L, et al. Prenatal diagnosis ofmalformations of cortical development by dedicated neurosonography[J]. Ultrasound Obstet Gynecol,2007, 29 (2) : 178-91. DOI: 10.1002/(ISSN)1469-0705. |
| [7] | Tang PH, Bartha AI, Norton ME, et al. Agenesis of the corpuscallosum: an Mr imaging analysis of associated abnormalities in thefetus[J]. AJNR Am J Neuroradiol,2009, 30 (2) : 257-63. |
| [8] | Simon EM, Goldstein RB, Coakley FV, et al. Fast Mr imaging offetal CNS anomalies in utero[J]. AJNR Am J Neuroradiol,2000, 21 (9) : 1688-98. |
| [9] | Onyeije CI, Sherer DM, Jarosz CJ, et al. Prenatal sonographicfindings associated with sporadic subcortical nodular heterotopia[J]. Obstet Gynecol,1998, 91 (5 Pt 2) : 799-801. |
| [10] | Bargalló N, Puerto B, De Juan C, et al. Hereditary subependymalheterotopia associated with mega cisterna magna: antenataldiagnosis with magnetic resonance imaging[J]. Ultrasound ObstetGynecol,2002, 20 (1) : 86-9. |
| [11] | 王音, 陶国伟, 耿群, 等. 超声联合MRI诊断胎儿大脑皮层发育异常的研究[J]. 山东大学学报: 医学版,2014, 52 (1) : 57-61. |
| [12] | Recio-Rodríguez M, Fernández-Mayoralas DM, Fernández-Jaén A, et al. Prenatal diagnosis of frontonasal dysplasia associated withbilateral periventricular nodular heterotopia[J]. J Child Neurol,2014, 29 (10) : NP122-6. |
| [13] | Sun XZ, Takahashi S, Cui C, et al. Normal and abnormal neuronalmigration in the developing cerebral cortex[J]. J Med Invest,2002, 49 (3/4) : 97-110. |
| [14] | Allen KM, Walsh CA. Genes that regulate neuronal migration inthe cerebral cortex[J]. Epilepsy Res,1999, 36 (2/3) : 143-54. |
| [15] | Ghariani S, Dahan K, Saint-Martin C, et al. Polymicrogyria inchromosome 22q11 deletion syndrome[J]. Eur J Paediatr Neurol,2002, 6 (1) : 73-7. DOI: 10.1053/ejpn.2001.0544. |
| [16] | Huttenlocher PR, Taravath S, mojtahedi S. Periventricular heterotopiaand epilepsy[J]. Neurology,1994, 44 (1) : 51-5. DOI: 10.1212/WNL.44.1.51. |
| [17] | Pilz D, toodley N, golden JA. Neuronal migration,cerebral corticaldevelopment, and cerebral cortical anomalies[J]. J Neuropathol ExpNeurol,2002, 61 (1) : 1-11. DOI: 10.1093/jnen/61.1.1. |
| [18] | kşioğlu YZ, Scheffer IE, Cardenas P, et al. Periventricularheterotopia: an X-linked dominant epilepsy locus causing aberrantcerebral cortical development[J]. Neuron,1996, 16 (1) : 77-87. DOI: 10.1016/S0896-6273(00)80025-2. |
| [19] | Barkovich AJ, Kjos BO. Gray matter heterotopias: Mr characteristicsand correlation with developmental and neurologic manifestations[J]. Radiology,1992, 182 (2) : 493-9. DOI: 10.1148/radiology.182.2.1732969. |
| [20] | Zisch R, Artmann W. MRI in the diagnosis of heterotopic graymatter. Report of three cases first discovered in adulthood[J].Neuroradiology, 1991, 33(6): 527-8. |
| [21] | Kuzniecky RI, Barkovich AJ. Malformations of cortical developmentand epilepsy[J]. Brain Dev,2001, 23 (1) : 2-11. DOI: 10.1016/S0387-7604(00)00195-9. |
| [22] | Mandelstam SA, Leventer RJ, Sandow A, et al. Bilateral posteriorperiventricular nodular heterotopia: a recognizable corticalmalformation with a spectrum of associated brain abnormalities[J]. AJNR Am J Neuroradiol,2013, 34 (2) : 432-8. DOI: 10.3174/ajnr.A3427. |
| [23] | Gleeson JG. Classical lissencephaly and double cortex (subcorticalband heterotopia): LIS1 and doublecortin[J]. Curr Opin Neurol,2000, 13 (2) : 121-5. DOI: 10.1097/00019052-200004000-00002. |
| [24] | Pellicer A, Cabañas F, Pérez-Higueras A, et al. Neural migrationdisorders studied by cerebral ultrasound and colour Doppler flowimaging[J]. Arch Dis Child Fetal Neonatal Ed,1995, 73 (2) : F55-61. DOI: 10.1136/fn.73.2.F55. |
| [25] | Srour M, Rioux MF, Varga C, et al. The clinical spectrum of nodularheterotopias in children: report of 31 patients[J]. Epilepsia,2011, 52 (4) : 728-37. DOI: 10.1111/epi.2011.52.issue-4. |
| [26] | Donkol RH, Moghazy KM, Abolenin A. Assessment of gray matterheterotopia by magnetic resonance imaging[J]. World J Radiol,2012, 4 (3) : 90-6. DOI: 10.4329/wjr.v4.i3.90. |
| [27] | Lüders H, Schuele SU. Epilepsy surgery in patients withmalformations of cortical development[J]. Curr Opin Neurol,2006, 19 (2) : 169-74. DOI: 10.1097/01.wco.0000218234.67840.cb. |
| [28] | 徐忠平, 谢惠芳, 刘振华, 等. 脑灰质异位症6例报告[J]. 第一军医大学学报,2001, 21 (4) : 278. |
 2015, Vol. 35
2015, Vol. 35

