2. 肿瘤研究所,广东 广州 510515
2. Cancer Research Institute, SouthernMedical University, Guangzhou 510515, China
上皮性卵巢癌(EOC)是女性生殖器常见的3大恶性肿瘤之一,患者5年生存率不足30%,已成为严重威胁全世界妇女生命和健康的主要肿瘤[1]。临床上因卵巢癌起病隐匿,缺乏典型的早期症状,约有70%的患者一经诊断已属晚期,并且研究表明约有70%的患者两年内会出现复发和转移[2-3],很难进行根治性手术。因此,EOC被认为是预后较差的妇科恶性肿瘤之一。上皮间质转化(EMT)的异常激活是肿瘤发生发展的重要因素,其特征是上皮细胞失去极性和接触抑制而获得间质表型,且细胞的侵袭和迁移能力增强[4-5]。研究发现,E盒锌指结合蛋白2(zinc finger E-box binding homeobox 2, ZEB2)通过与E-cadherin基因启动子的E盒结合,抑制E-cadherin的表达,诱导细胞发生上皮-间质转化,从而增强细胞的转移和侵袭能力[6]。ZEB2 在许多恶性肿瘤组织中能够增强肿瘤细胞的侵袭、转移,如大肠癌[7]、胃癌[8]、乳癌[9]等,但目前ZEB2在EOC组织中的表达情况鲜有报道。原癌基因C-myc(cellular avian myelocytoma virus, C-myc)与细胞生长调控、肿瘤发生及细胞凋亡密切相关[10-11],其过度表达极有可能促进肿瘤的恶变、进展等过程。目前,关于ZEB2与C-myc蛋白表达与EOC临床病理特征等相关性研究,国内外尚未见文献报道。本研究通过对191 例EOC 组织中ZEB2 与C-myc 表达水平进行检测,分析ZEB2 与C-myc之间的关系,并探讨它们与EOC侵袭、转移以及临床病理特征之间的关系。
1 材料和方法 1.1 临床资料选取2008 年9 月~2015 年1 月南方医科大学第三附属医院病理科存档石蜡包埋卵巢组织标本204例,其中正常卵巢组织13 例、EOC组织191 例(浆液性腺癌159 例,粘液性腺癌32 例),均经病理学证实。191 例EOC患者年龄在22~81岁之间,其中≥47 岁182例,<47岁9例;根据国际FIGO临床分期标准:Ⅰ期137例,Ⅱ期28 例,Ⅲ期17 例,Ⅳ期9 例。EOC T分期中T1 期139例,T2期32例,T3期20例;无淋巴结转移173例,有淋巴结转移18 例;无远处转移182 例,有远处转移9 例。所有患者术前均未行放疗、化疗、生物治疗。对照组为同期因非卵巢疾病接受手术治疗获得的正常卵巢标本,共13例正常卵巢组织。
1.2 主要试剂小鼠抗人ZEB2单克隆抗体和小鼠抗人C-myc单克隆抗体均购自美国Abcam公司;SP试剂盒及DAB 显色试剂盒购自北京中杉金桥生物公司。
1.3 免疫组织化学检测及结果判定将蜡块制成4 μm厚切片,免疫组化操作步骤严格按试剂盒说明书进行,一抗均按1:100稀释。以ZEB2与C-myc的阳性切片作为阳性对照,以PBS液代替一抗作为阴性对照。结果判定采用双盲法,同时由2位资深病理科医师独立观察每张切片后进行判定。判定标准采用半定量评分法,根据染色强度和阳性细胞百分比进行判定[12]。染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比:无阳性细胞为0分,1%~为1分,10%~为2分,50%~为3 分,75%~为4 分。2 项评分乘积≤4为阴性,>4分为阳性。
1.4 统计学处理实验数据采用SPSS 20.0 软件进行实验数据分析。ZEB2和C-myc在EOC组织及正常卵巢组织的表达、各临床病理因素之间的相关性及相关关系均采用χ2和Spearman等级相关检验,P<0.05为差异有统计学意义。
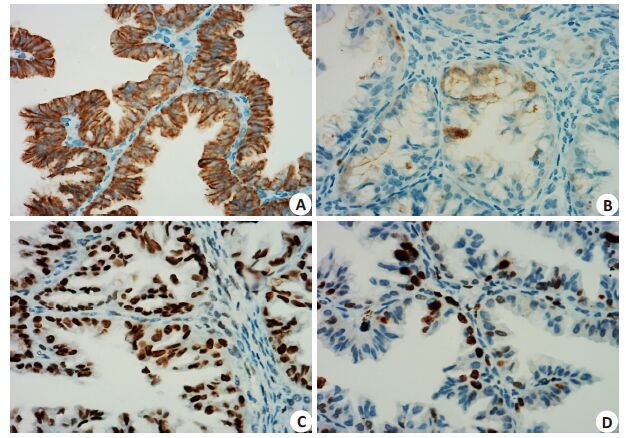
2 结果 2.1 ZEB2在EOC组织中的表达及其与临床病理因素ZEB2蛋白主要分布于肿瘤细胞的胞质,也可出现细胞核的表达,呈淡黄色至棕褐色颗粒,在正常组织及卵巢癌组织阳性表达率分别为30.8%(4/13)和49.2%(94/191),差异有统计学意义(P=0.007)。ZEB2表达与EOC的病理分型相关,在粘液性腺癌组比浆液性腺癌组中有更高的阳性表达率(75% vs 44%,P=0.003);且表达与FIGO分期、T分期、淋巴结转移有关,在Ⅲ~Ⅳ期中比Ⅰ~Ⅱ期中有更高的阳性表达率(69.2% vs 46.1%,P=0.028);在肿瘤T分期中阳性表达率T3>T2>T1(80% vs 62.5% vs 41.7%,P=0.002);有淋巴结转移者阳性表达率高于无淋巴结转移者(46.8% vs 13.8%,P=0.04);但与年龄、分化程度、远处转移等不相关(表 1、2、图 1A、B)。
| 表 1 191例EOC组织中ZEB2及C-myc的表达与临床病理因素的关系 Table 1 Correlation of ZEB2 and C-myc with clinicopathologic indexes in 191 patients with EOC |
| 表 2 EOC和正常卵巢组织中ZEB2及C-myc的表达 Table 2 ZEB2 and C-myc protein expression in the ovarian and EOC tissues |
|
图 1 ZEB2蛋白在EOC组织的细胞质中表达及C-myc蛋白在EOC组织的细胞核中表达 Figure 1 ZEB2 (A, B) and C-myc (C, D) protein expressions in cellular cytoplasm of EOC tissues (Original magnification: ×400) . A, C: High expressions; B, D: Low expression. |
C-myc蛋白主要定位于细胞核,也可出现细胞质的表达,呈棕褐色颗粒,在正常组织及EOC组织表达率分别为15.4%(2/13)和53.9%(103/191),差异具有统计学意义(P=0.001)。C-myc基因的表达与EOC的分化程度相关,在低分化组比高分化癌组中有更高的阳性表达率(59.7% vs 43.3%,P=0.039);且表达与EOC的FIGO 分期、T相关,在Ⅲ~Ⅳ期中比Ⅰ~Ⅱ期有更高的阳性表达率(73.1% vs 51.0%,P=0.035);在T分期的阳性表达率T3>T2>T1(80% vs 62.5% vs 48.2%,P=0.002);但与年龄、病理分型、淋巴结转移、远处转移等不相关。(表 1、2、图 1C、D)。
2.3 ZEB2及C-myc的表达在EOC组织中的相互关系ZEB2和C-myc在EOC中的表达经过Spearman相关性分析,两者呈正相关性(相关系数R=0.358,P<0.001)。同时ZEB2 及C-myc 的共同表达与T分期和FIGO分期有关(P<0.001,P<0.008,表 3、4)。
| 表 3 EOC组织中ZEB2及C-myc的表达之间的相互关系 Table 3 Correlation between the expression of C-myc and ZEB2 in EOC |
| 表 4 EOC中ZEB2及C-myc的共同表达之间的相互关系 Table 4 Co-expression of the two proteins in EOC |
ZEB2是ZEB转录因子家族的一员,ZEB2与ZEB 家族的另一个成员ZEB1高度同源。ZEB2和ZEB1都参与脊椎动物的胚胎发育,并通过调控EMT过程而参与恶性肿瘤的发生和发展[13]。ZEB2能与E-cadherin编码基因的启动子上的E2盒的[CACCT(G)]结合,抑制E-cadherin的转录,诱导细胞发生EMT,增强细胞的侵袭转移能力[13]。已有研究证实其可促进膀胱癌、乳腺癌及鼻咽癌细胞的转移能力,且有研究表明其表达上调可独立预测头颈部癌的不良预后[14-17]。但目前其在EOC 中的研究还十分有限,且机制并不很清楚。本研究结果显示:ZEB2蛋白主要定位于细胞质,EOC组织阳性表达率为49.2%高于正常卵巢组织30.8%,差异具有统计学意义,这与Cai[18]报道ZEB2在肝癌组织中的阳性表达率相一致。而且随着肿瘤T分级的升高,ZEB2的阳性表达率也随之增高;EOC组织中有淋巴结转移者的ZEB2阳性表达率远高于无淋巴转移者,表明ZEB2表达对EOC的淋巴结转移起着促进的作用,这与以往研究结果一致[8]。ZEB2在FIGO分期中Ⅲ~Ⅳ期阳性表达率为69.2%,在Ⅰ~Ⅱ期中为46.1%,差异有统计学意义,与Huang等[19]观点一致。综合这些结果说明,ZEB2作为转录因子,其高表达与EOC转移、肿瘤TNM分期确切有关,ZEB2表达越高TNM分期越高,淋巴结转移的可能性也越高。ZEB2作为促基因在肿瘤转移中发挥作用,它可能成为评价EOC发展、转移的一个有价值的指标。
原癌基因C-myc为序列特异性转录因子,该基因定位于染色体8q34,编码磷酸化蛋白。C-myc编码蛋白具有促进DNA复制,调节细胞周期、细胞增殖及分化等功能[20]。其表达与细胞生长调控、肿瘤发生及细胞凋亡有密切关系[10-11]。C-myc过度表达能够诱导细胞由静止期进入分裂周期,促进细胞的增殖从而导致肿瘤的发生[21-22]。在乳腺癌中C-myc癌基因的扩增率约30%,对其复发及生存期有较好的预测作用[23]。另外在乳腺癌研究中发现C-myc的表达与乳腺癌的病理分级、病理分型及淋巴结转移密切相关,是乳腺癌重要的独立预后因子[24]。本研究结果显示C-myc蛋白主要定位于细胞核,呈棕褐色颗粒。EOC组织中表达率为53.9%高于正常卵巢组织15.4%,差异具有统计学意义。C-myc在FIGO分期中Ⅲ~Ⅳ期的阳性表达率为73.1%,在Ⅰ~Ⅱ期为51.0%,差异具有统计学意义,与Sawant等[25]观点一致。而且还发现其表达与卵巢癌的分化程度、T 分期有关(P<0.05),但与年龄、病理分型、淋巴结转移、远处转移等不相关。由此看出C-myc的高表达与EOC肿瘤TNM分期、分化程度及T分期确切有关,C-myc表达越高肿瘤分化程度越低,T分期越高,其同样有望成为评价EOC 分期及T分级的一个有价值的指标。
目前,对ZEB2和C-myc在EOC中的浸润、转移及临床病理中表达中的相互关系的研究国内外尚未见文献报道。C-myc影响着细胞的生长、分化、凋亡和细胞周期的进程[26],其异常表达在癌变过程中是较早出现的分子改变,与肿瘤的启动及癌性增生有着密切的关系[27]。C-myc对细胞具有双重作用,既可刺激细胞增殖,亦可促进细胞凋亡。C-myc是刺激细胞增殖还是促进细胞凋亡受到多种因素的影响,包括基因、细胞因子、寡核苷酸、多种蛋白、蛋白酶体抑制剂、miRNA以及C-myc自身因素等等[28-29]。本研究对191例EOC组织中的ZEB2和C-myc表达进项了检测,发现ZEB2与C-myc蛋白表达的共阴性率为58.8%(57/97),共阳性率为67.0%(63/94),两者表达具有正相关性(相关系数R=0.358,P<0.001),其在EOC 发生、进展中可能具有协同作用。ZEB2和C-myc在T分期中两者共同表达具有较好相关性(P<0.001),并且在EOC早期即有较高的阳性表达率(40.7%,35/86)。同时我们发现两者在肿瘤FIGO分期中的共同表达率具有较明显的相关性(P=0.008),并且随着肿瘤分期越高,两者的共同表达阳性率越高(Ⅲ~Ⅳ vs Ⅰ~Ⅱ 82.4% vs 47.6%),但与年龄、病理分型、T分级、远处转移无明显相关性。
目前,关于ZEB2 和C-myc在EOC的增殖、侵袭、转移的研究仍然缺少丰富的实验和临床资料,本实验首次探索了二者之间在EOC临床病理表达的的联系,观察分析两者在EOC组织中的表达情况,研究发现两者的表达在EOC中具有协同性,对EOC的发生、发展起重要作用,肿瘤TNM分期越高,其表达一致性越高,并且在EOC早期两者具有较高的共同表达阳性率,故两者联合检测有望成为EOC早期诊断的重要指标。
| [1] | Wang B, Liu SZ, Zheng RS, et al. Time trends of ovarian cancerincidence in China[J]. Asian Pac J Cancer Prev,2014, 15 (1) : 191-3. DOI: 10.7314/APJCP.2014.15.1.191. |
| [2] | Vergote I. Neoadjuvant chemotherapy or primary surgery in stageIIIC or IV ovarian cancer[J]. N Engl J Med,2010, 363 (10) : 943-53. DOI: 10.1056/NEJMoa0908806. |
| [3] | 孙艳, 底建敏, 陈春宁. Survivin反义寡核苷酸对人卵巢癌细胞裸鼠腹腔移植瘤生长的影响与机制[J]. 南方医科大学学报,2015, 35 (8) : 1211-4. |
| [4] | Mazda M, Nishi K, Naito Y, et al. E-cadherin is transcriptionallyactivated via suppression of ZEB1 transcriptional repressor bysmall RNA-mediated gene silencing[J]. PLoS One,2011, 6 (12) : e28688. DOI: 10.1371/journal.pone.0028688. |
| [5] | 俞岚, 周蕾, 武世伍, 等. 上皮性卵巢癌中CD133与EMT相关因子表达的关系[J]. 南方医科大学学报,2015 (9) : 1297-302. |
| [6] | Vandewalle CV, Berx G. The role of the ZEB family of transcriptionfactors in development and disease[J]. Cell Mol Life Sci,2009, 66 (5) : 773-87. DOI: 10.1007/s00018-008-8465-8. |
| [7] | Kahlert C, Lahes S, Radhakrishnan P, et al. Overexpression ofZEB2 at the invasion front of colorectal cancer is an Independentprognostic marker and regulates tumor invasion in vitro[J]. ClinCancer Res,2011, 17 (24) : 7654-63. |
| [8] | Okugawa Y, Inoue Y, Tanaka K, et al. Smad interacting protein 1(SIP1) is associated with peritoneal carcinomatosis in intestinaltype gastric cancer[J]. Clin Exp Metastasis,2013, 30 (4) : 417-29. DOI: 10.1007/s10585-012-9547-4. |
| [9] | Karihtala P, Auvinen P, Kauppila S, et al. Vimentin, zeb1 and sip1are up-regulated in triple-negative and basal-like breast cancers:association with an aggressive tumour phenotype[J]. Breast CancerRes Treat,2013, 138 (1) : 81-90. DOI: 10.1007/s10549-013-2442-0. |
| [10] | Cole MD, Mcmahon SB. The Myc oncoprotein: a critical evaluationof transactivation and target gene regulation[J]. Oncogene,1999, 18 (19) : 2916-24. DOI: 10.1038/sj.onc.1202748. |
| [11] | Hemann MT, Bric A, Teruya-Feldstein J, et al. Evasion of the p53tumour surveillance network by tumour-derived MYC mutants[J]. Nature,2005, 436 (752) : 807-11. |
| [12] | Pecina-Slaus PN. Tumor suppressor gene E-cadherin and its role innormal and malignant cells[J]. Cancer Cell Int,2003, 3 (1) : 17. DOI: 10.1186/1475-2867-3-17. |
| [13] | Gheldof A, Hulpiau P, Van Roy F, et al. Evolutionary functionalanalysis and molecular regulation of the ZEB transcription factors[J]. Cell Mol Life Sci,2012, 69 (15) : 2527-41. DOI: 10.1007/s00018-012-0935-3. |
| [14] | Miura N, Yano T, Shoji F, et al. Clinicopathological significance ofSip1-associated epithelial mesenchymal transition in non-small celllung cancer progression[J]. Anticancer Res,2009, 29 (10) : 4099-106. |
| [15] | Yu C, Chen L, Yie L, et al. Targeting FoxM1 inhibits proliferation,invasion and migration of nasopharyngeal carcinoma through theepithelial-to-mesenchymal transition pathway[J]. Oncol Rep,2015, 33 (5) : 2402-10. |
| [16] | Cappellesso R, Marioni G, Crescenzi M, et al. The prognostic roleof the epithelial-mesenchymal transition markers E-cadherin andSlug in laryngeal squamous cell carcinoma[J]. Histopathology,2015, 67 (4) : 491-500. DOI: 10.1111/his.2015.67.issue-4. |
| [17] | Liu B, Miyake H, Nishikawa M, et al. Expression profile ofepithelial-mesenchymal transition markers in non-muscle-invasiveurothelial carcinoma of the bladder: correlation with intravesicalrecurrence following transurethral resection[J]. Urol Oncol,2015, 33 (3) : 110.e11-8. DOI: 10.1016/j.urolonc.2014.08.012. |
| [18] | Cai MY, Luo RZ, Chen JW, et al. Overexpression of ZEB2 inperitumoral liver tissue correlates with favorable survival aftercurative resection of hepatocellular carcinoma[J]. PLoS One,2012, 7 (2) : e32838. DOI: 10.1371/journal.pone.0032838. |
| [19] | Huang N, Wu Z, Lin L, et al. MiR-338-3p inhibits epithelialmesenchymaltransition in gastric cancer cells by targeting ZEB2and MACC1/Met/Akt signaling[J]. Oncotarget,2015, 6 (17) : 15222-34. DOI: 10.18632/oncotarget. |
| [20] | Amati B. Integrating Myc and TGF-beta signalling in cell-cyclecontrol[J]. Nat Cell Biol,2001, 3 (5) : E112-3. DOI: 10.1038/35074634. |
| [21] | White RA, Adkison LR, Dowler LL, et al. Chromosomal localizationof the human gene encoding c-myc promoter-binding protein(MPB1) to chromosome 1p35-pter[J]. Genomics,1997, 39 (3) : 406-8. DOI: 10.1006/geno.1996.4499. |
| [22] | 郑玮, 郑克鸿, 钟林, 等. 结直肠癌中Runx3和C-myc基因的表达[J]. 南方医科大学学报,2014 (7) : 1042-7. |
| [23] | Shanmugham R, Gopalan R, Shanthi P, et al. Tumour angiogenesisand C-myc expression in breast carcinomas[J]. Indian J PatholMicrobiol,2004, 47 (3) : 340-2. |
| [24] | 赵云霞, 龚晓萌, 崔芳芹, 等. 乳腺癌中PTEN、Rb、C-myc的异常表达及其临床意义[J]. 中国老年学杂志,2012, 32 (12) : 2531-3. |
| [25] | Sawant S. Prognostic role of Oct4, CD44 and c-Myc inradio-chemo-resistant oral cancer patients and their tumourigenicpotential in immunodeficient mice[Z], 2015. |
| [26] | Wulczyn FG, Smirnova L, Rybak A, et al. Post-transcriptionalregulation of the let-7 microRNA during neural cell specification[J]. FASEB J,2007, 21 (2) : 415-26. DOI: 10.1096/fj.06-6130com. |
| [27] | Ibarra I, Erlich Y, Muthuswamy SK, et al. A role for microRNAs inmaintenance of mouse mammary epithelial progenitor cells[J]. Genes Dev,2007, 21 (24) : 3238-43. DOI: 10.1101/gad.1616307. |
| [28] | Schulman BR, Slack FJ. Reciprocal expression of lin-41 and themicroRNAs let-7 and mir-125 during mouse embryogenesis[J]. Dev Dyn,2005, 234 (4) : 1046-54. DOI: 10.1002/dvdy.v234:4. |
| [29] | Johnson CD, Esquela-Kerscher A, Stefani G, et al. The let-7microRNA represses cell proliferation pathways in human cells[J]. Cancer Res,2007, 67 (16) : 7713-22. DOI: 10.1158/0008-5472.CAN-07-1083. |
 2015, Vol. 35
2015, Vol. 35

