2. 成都市锦江区妇幼保健院生殖医学中心,四川 成都 610016
2. Reproducitve Medicine Center, Jinjiang Maternal and Child Healthcare Hospital, Chengdu 610041, China
世界上第1例试管婴儿出生后的近40年中,辅助生殖技术取得了巨大的进步,然而约35%的平均妊娠率和25%的平均活产率仍满足不了日益增多的、希望通过辅助生殖技术获得孩子的患者[1]。胚胎质量,是决定IVF/ICSI临床结局的重要因素之一。目前,绝大多数生殖中心使用显微镜在特定的、间隔的时间(时间间隔一般为24 h)观察胚胎,并根据胚胎形态和发育特点对胚胎进行评级、筛选。这种传统的胚胎形态学评价方法存在一定局限性[2-3],移植评级最高的胚胎常常得不到妊娠,而评级低的胚胎有时却能得到活产。胚胎的发育是一个动态变化的过程,在短短几小时甚至几分钟内,胚胎的形态就可能发生明显的变化,而胚胎的评分也会随之改变,仅依靠有限的几次观察来评价胚胎,显然不够全面、客观。但若频繁地将胚胎取出进行观察,又则无法保证培养环境的温度、湿度、气体含量稳定,可能严重影响胚胎的发育。
利用time-lapse对胚胎进行监测,不仅可以动态观察胚胎,还可以记录特殊形态学事件的时间(尤其是胚胎分裂的时间),并以此对胚胎进行比较。同时培养箱内置的显微镜和time-lapse相机避免了对胚胎的频繁操作,保证了胚胎培养环境的稳定。然而这种新方法的使用是否确实能提高胚胎鉴别的能力、使患者尽早获得妊娠,尚存在争议。本研究回顾性分析了68 个使用time-lapse筛选胚胎的IVF/ICSI周期,并与71个使用传统形态学方法筛选胚胎的周期进行比较,探讨了time-lapse用于胚胎检测和评价的临床价值,以期为这种新方法的应用提供参考。
1 资料与方法 1.1 研究对象回顾性选取2014 年6 月~2015 年3 月于成都市锦江区妇幼保健院生殖医学中心利用EmbryoScopetime-lapse胚胎培养系统进行胚胎监测和筛选的68个IVF/ICSI周期作为TLM组(n=68),选取同一时期于同一中心利用传统胚胎形态学方法筛选胚胎的71个IVF/ICSI周期作为对照组(n=71)。纳入标准:女方年龄≤35岁;基础FSH≤10 mU/mL;基础窦卵泡数(AFC)≥10个;女方不孕原因均为输卵管因素,排除盆腔子宫内膜异位症、子宫腺肌症、子宫肌瘤、反复流产、反复胚胎着床失败等预后不良的患者,但未排除患有多囊卵巢综合症(PCOS)的患者;每位患者最多参与1个周期;每位患者均为第1个移植周期;新鲜移植或者冷冻移植;每位患者移植2枚D3胚胎。
1.2 胚胎培养及监测TLM组胚胎受精后放入EmbryoScope(UnisenseFertilitech,丹麦)专用培养皿(Embryoslide, UnisenseFertilitech,丹麦)中进行培养。每个培养皿包括12个培养孔,使用序贯培养液(卵裂期胚胎用G-1液,囊胚用G-2液,Vitrolife,瑞典)培养胚胎。培养液上覆以矿物油。每个胚胎置于单独的一个培养孔中,然后将培养皿放入EmbryoScope时差培养箱中,培养环境参数为:5.0% CO2,5.0% O2,37 ℃。EmbryoScope时差培养箱带有嵌入式显微镜,每个TLM组胚胎的全部培养过程都使用Timelapse进行监测,设置为每10 min获取1次胚胎图像。
对照组胚胎受精后放入普通培养皿中,培养环境参数为:5.0% CO2,5.0% O2,37 ℃,也使用序贯培养液(卵裂期胚胎用G-1液,囊胚用G-2液,Vitrolife,瑞典)培养胚胎。受精后分别于44、68 h对胚胎进行观察。
1.3 胚胎的评价及筛选利用EmbryoScope时差培养箱连接的外部电脑中的专门用以对time-lapse 图像进行分析的Embryo-Viewer(Unisense Fertilitech,丹麦)软件,随时观看获取的time-lapse图像以及图像生成的录像,同时获得胚胎形态发生改变的时间资料,包括每次胚胎的分裂、异常分裂、多核、碎片出现等,这些形态改变的时间定义为胚胎的形态动力学变量。对于ICSI受精的胚胎,将精子注入卵子的时间定义为t0;对于IVF受精的胚胎,将精子和卵子混合的时间定义为t0。我们用以评价胚胎的形态动力学变量包括:t2、t3、t4、t5、cc2、s2(表 1)。
| 表 1 形态动力学定义 Table 1 Morphokinetic parameters definition |
利用Meseguer 等[4]于2011 年描述的分级模型对TLM组的胚胎进行评级和筛选,模型描述见图 1;将胚胎分为A、B、C、D、E、F 6个级,其中A-D级再分为(+)和(-)2个亚级,共是10个级别。分级步骤:第1步,排除明显不可用胚胎,如形态明显异常或已经停止发育的胚胎(F级);第2步,排除满足以下任意3个条件之一的胚胎(E级)(1)2细胞期时2个细胞大小明显不均(2)从一个细胞直接分裂形成3个或者更多的细胞(3)4细胞期出现多核;第3步,对剩余胚胎,若t5落在最佳区间(48.8~56.6 h),为A或者B级,反之,则为C级或者D及;第4步,若s2<0.76 h,根据t5的值,胚胎为A级或者C级;反之,为B级或者D级;第5 步,对于A-D 级的胚胎,若cc2<11.9 h,则得到额外(+)亚级(A+/B+/C+/D+),反之,则得到额外(-)亚级(A-/B-/C-/D-)。TLM组每位患者根据上述的模型,选择级别最高的2个胚胎进行移植。
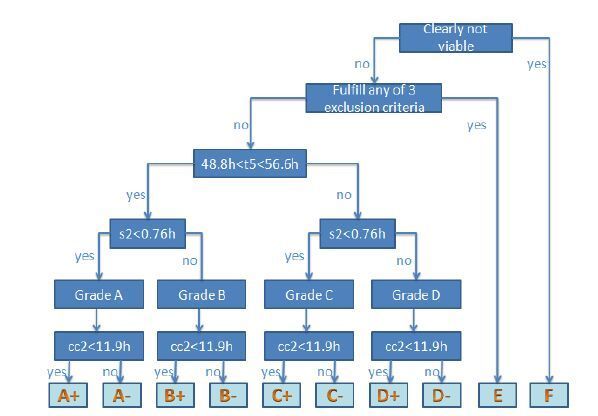
|
图 1 进行胚胎选择的分级模型 Figure 1 Hierarchical model for embryo selection. |
对照组胚胎使用Peter卵裂期胚胎评分系统评估胚胎。Ⅰ级:卵裂球大小均匀,形状规则,透亮,碎片<10%;Ⅱ级:卵裂球稍不均匀,或者形状稍不规则,胞浆有颗粒,碎片在10%~20%;Ⅲ级:卵裂球明显不均,或者形状不规则,胞浆有颗粒,碎片在20%~50%;Ⅳ级:卵裂球严重不均匀,或者形状严重不规则,胞浆有颗粒,碎片>50%。对照组由2PN发育而来、卵裂球数目在6~10个的D3胚胎中,根据上述形态学分级,选择2个最佳的胚胎进行移植。
1.4 临床结局βHCG阳性:移植后14 d测血清βHCG阳性。临床妊娠:移植后4~6周B超下可见到孕囊并胎心(+)。胚胎着床率:移植后4~6周B超下可见到胎心(+)的孕囊数占移植总胚胎数的百分比。
1.5 统计学分析使用SPSS 16.0软件进行统计学分析,计数资料采用χ2检验,计量资料采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果 2.1 基本情况比较TLM组与对照组在年龄、基础窦卵泡数(AFC)、基础FSH、基础LH、基础E2、取卵个数方面均没有显著差异(P>0.05,表 2)。
| 表 2 患者一般情况 Table 2 Baseline characteristics of the patients (n=number of cycles) |
TLM组的βHCG阳性率、临床妊娠率、胚胎着床率分别为:66.2%、61.8%、47.1%;对照组的βHCG阳性率、临床妊娠率、胚胎着床率分别为:47.9%、43.7%、30.3%;TLM组的βHCG阳性率、临床妊娠率、胚胎着床率均显著高于对照组,差异均有统计学意义(P<0.05,表 3)。
| 表 3 TLM组和对照组的临床结局比较 Table 3 Clinical outcome comparison between TLM group and control group |
由表 4可见,按照女方患者年龄对TLM组和对照组的临床结局进行亚组分析。≤30岁的患者,TLM组βHCG阳性率、临床妊娠率、胚胎着床率分别为:60.0%、55.0%、43.6%;对照组βHCG阳性率、临床妊娠率、胚胎着床率分别为:56.5%、54.3%、36.9%;TLM组βHCG阳性率、临床妊娠率、胚胎着床率均高于对照组,但两组间均没有显著差异(P>0.05);31~35 岁的患者,TLM组βHCG阳性率、临床妊娠率、胚胎着床率分别为:75.0%、71.4%、53.6%;对照组βHCG阳性率、临床妊娠率、胚胎着床率分别为:32.0%、24.0%、18.0%;TLM组βHCG阳性率、临床妊娠率、胚胎着床率均高于对照组,且两组间差异均具有统计学意义(P<0.05)。
| 表 4 女方年龄及受精方式的亚组分析 Table 4 Subgroup analysis based on female patients' age and fertilization type |
按照受精方式进行亚组分析。IVF 受精的患者,TLM组βHCG阳性率、临床妊娠率、胚胎着床率分别为:71.7%、67.9%、51.9%;对照组βHCG阳性率、临床妊娠率、胚胎着床率分别为:34.0%、31.9%、20.2%;TLM组βHCG阳性率、临床妊娠率、胚胎着床率均高于对照组,且差异均具有统计学意义(P<0.05)。对于ICSI受精的患者,TLM组βHCG阳性率、临床妊娠率、胚胎着床率分别为:44.4%、33.3%、27.8%;对照组βHCG阳性率、临床妊娠率、胚胎着床率分别为:70.6%、58.8%、41.2%;对照组βHCG阳性率、临床妊娠率、胚胎着床率均高于TLM组,但差异均无统计学意义(P>0.05)。对于TESA受精的患者,TLM组βHCG阳性率、临床妊娠率、胚胎着床率分别为:50.0%、50.0%、33.3%;对照组βHCG阳性率、临床妊娠率、胚胎着床率分别为:85.7%、85.7%、71.4%;对照组的βHCG阳性率、临床妊娠率、胚胎着床率均高于TLM组,但差异均无统计学意义(P>0.05)。
3 讨论time-lapse 监测系统是近几年出现的、用于临床胚胎评价的新方法,其主要特点是对胚胎发育过程进行连续的高质量图像采集,同时又保证胚胎的培养环境稳定[5-7]。其图像采集间隔时间短并且固定(时间间隔一般为5~20 min),不仅可以对胚胎的形态进行动态的观察,同时还可以得到胚胎形态发生改变的时间资料(如原核消失、分裂开始、分裂结束、异常分裂、碎片重吸收、细胞胞膜波动、细胞胞质环流等发生的时间,又称为形态动力学参数),将胚胎的发育过程进行量化。time-lapse独特的将胚胎的形态和分裂时间相结合进行评价的方法,不仅更加全面,量化的信息还减少了观察者的主观性,比传统方法更加客观[8]。time-lapse相机与胚胎培养系统相整合,观察胚胎时不需要将胚胎取出,随时可在与摄像机相连接的外部电脑上观看采集到的胚胎图像以及图像生成的录像,保证了胚胎处于稳定、可调控的培养环境中。这种培养系统的安全性已经得到了证实[9-10]。
Meseguer 等[4]于2011 年根据胚胎的着床率,建立了一种多形态动力学变量模型,通过一系列的排除和筛选条件,可以区分形态学正常然而分裂模式异常的胚胎。这个模型建立后,又有许多试验致力于建立不同的基于time-lapse形态动力学变量的分级模型或是评分模型,以期得到一种更完美的胚胎筛选方法。然而利用形态动力学变量对胚胎进行评价,并选择胚胎进行移植,其临床结局是否明显优于传统形态学方法,目前不同研究得到的结论不尽相同;即使有结果阳性的试验作为支持,哪些形态动力学变量更有预测价值、选择哪种模型更优,也尚无定论。
本次研究针对预后良好的年轻患者,比较了使用time-lapse 和传统形态学方法用于胚胎评价的临床结局,结果显示,TLM组的临床妊娠率和胚胎着床率分别为61.8%、47.1%,这与文献报道的结果相同[4, 11-12],相较传统形态学方法,time-lapse能明显提高βHCG阳性率、临床妊娠率和胚胎着床率,差异有统计学意义(P<0.05)。分析其原因,可能有:(1)time-lapse培养系统使胚胎处于更加严格调控和稳定的培养环境中;(2)减少对胚胎的进出培养箱的操作次数;(3)通过动态观察,得到的形态学信息更加全面;(4)利用形态动力学变量的评价筛选胚胎[11]。本研究使用的time-lapse培养箱相比普通培养箱,净化气体、调控温度和气体含量的能力更佳[10],而严格控制和稳定培养环境对胚胎至关重要,因为温度和pH值的改变可能影响胚胎发育、降低胚胎质量[13]。
根据患者的年龄(≤30岁及31~35岁)进行亚组分析,结果显示:对于2个年龄组的患者,time-lapse都能提高βHCG阳性率、临床妊娠率、胚胎着床率,但是对于≤30 岁的患者,与对照组比较,差异没有统计学意义。可见,相对于≤30岁的患者,31~35岁的患者更能从中获益。究其原因,可能是因为年龄大的患者,由于其胚胎质量下降、染色体异常的发生率升高[14],胚胎在发育过程中更可能发生与染色体异常密切相关的异常分裂现象[15-17],而time-lapse可以将这些发生异常分裂胚胎与没有发生异常分裂的胚胎区分开来,传统形态学方法则对此无能为力。根据受精方式(IVF、ICSI、TESA)进行亚组分析发现,time-lapse仅能明显改善IVF患者的临床结局,而对于ICSI、TESA受精的患者,其效果不如使用传统形态学方法。这可能与我们纳入的ICSI 和TESA患者数目少(ICSI共23人,TESA共13人)有关,有待扩大样本数进行研究。
综上所述,对于预后良好的年轻患者,time-lapse相对于传统形态学方法,能明显改善临床结局,缩短患者获得妊娠的时间,尤其是年龄介于31~35 岁之间的患者。然而我们的研究仅仅纳入了预后良好的患者,对于预后不良的患者,time-lapse的临床价值尚需进一步研究证实。
| [1] | Ferraretti AP, Goossens V, Kupka M, et al. Assisted reproductivetechnology in Europe, 2009: results generated from Europeanregisters by ESHRE[J]. Hum Reprod,2013, 28 (9) : 2318-31. DOI: 10.1093/humrep/det278. |
| [2] | Edwards RG, Purdy JM, Steptoe PC, et al. The growth of humanpreimplantation embryos in vitro[J]. Am J Obstet Gynecol,1981, 141 (4) : 408-16. DOI: 10.1016/0002-9378(81)90603-7. |
| [3] | The Istanbul consensus workshop on embryo assessment: proceedingsof an expert meeting[J]. Hum Reprod, 2011, 26(6): 1270-83. |
| [4] | Meseguer M, Herrero J, Tejera A, et al. The use of morphokineticsas a predictor of embryo implantation[J]. Hum Reprod,2011, 26 (10) : 2658-71. DOI: 10.1093/humrep/der256. |
| [5] | Aparicio B, Cruz M, Meseguer M. Is morphokinetic analysis theanswer?[J]. Reprod Biomed Online,2013, 27 (6) : 654-63. DOI: 10.1016/j.rbmo.2013.07.017. |
| [6] | Kirkegaard K, Agerholm IE, Ingerslev HJ. Time-lapse monitoringas a tool for clinical embryo assessment[J]. Hum Reprod,2012, 27 (5) : 1277-85. DOI: 10.1093/humrep/des079. |
| [7] | Herrero J, Meseguer M. Selection of high potential embryos usingTime-lapse imaging: the era of morphokinetics[J]. Fertil Steril,2013, 99 (4) : 1030-4. DOI: 10.1016/j.fertnstert.2013.01.089. |
| [8] | Sundvall L, Ingerslev HJ, Breth Knudsen U, et al. Inter- and intraobservervariability of Time-lapse annotations[J]. Hum Reprod,2013, 28 (12) : 3215-21. DOI: 10.1093/humrep/det366. |
| [9] | Cruz M, Gadea B, Garrido N, et al. Embryo quality, blastocyst andongoing pregnancy rates in oocyte donation patients whose embryos were monitored by Time-lapse imaging[J]. J Assist ReprodGenet,2011, 28 (7) : 569-73. DOI: 10.1007/s10815-011-9549-1. |
| [10] | Kirkegaard K, Hindkjaer JJ, Gr?ndahl ML, et al. A randomizedclinical trial comparing embryo culture in a conventional incubatorwith a Time-lapse incubator[J]. J Assist Reprod Genet,2012, 29 (6) : 565-72. DOI: 10.1007/s10815-012-9750-x. |
| [11] | Rubio I, Galán A, Larreategui Z, et al. Clinical validation of embryoculture and selection by morphokinetic analysis: a randomized,controlled trial of the EmbryoScope[J]. Fertil Steril,2014, 102 (5) : 1287-1294. DOI: 10.1016/j.fertnstert.2014.07.738. |
| [12] | Siristatidis C, Komitopoulou MA, Makris A, et al. Morphokineticparameters of early embryo development via Time lapse monitoringand their effect on embryo selection and ICSI outcomes: aprospective cohort study[J]. J Assist Reprod Genet,2015, 32 (4) : 563-70. DOI: 10.1007/s10815-015-0436-z. |
| [13] | De Mouzon J, Goossens V, Bhattacharya S, et al. Assisted reproductivetechnology in Europe, 2006: results generated fromEuropean registers by ESHRE[J]. Hum Reprod,2010, 25 (8) : 1851-62. DOI: 10.1093/humrep/deq124. |
| [14] | Mantzouratou A, Mania A, Fragouli E, et al. Variable aneuploidymechanisms in embryos from couples with poor reproductivehistories undergoing preimplantation genetic screening[J]. HumReprod,2007, 22 (7) : 1844-53. |
| [15] | Chawla M, Fakih M, Shunnar A, et al. Morphokinetic analysis ofcleavage stage embryos and its relationship to aneuploidy in aretrospective Time-lapse imaging study[J]. J Assist Reprod Genet,2015, 32 (1) : 69-75. DOI: 10.1007/s10815-014-0372-3. |
| [16] | Kramer YG, Kofinas JD, Melzer K, et al. Assessing morphokineticparameters via Time lapse microscopy (TLM) to predict euploidy:are aneuploidy risk classification models Universal[J]. J AssistReprod Genet,2014, 31 (9) : 1231-42. |
| [17] | Campbell A, Fishel S, Bowman N, et al. Retrospective analysis ofoutcomes after IVF using an aneuploidy risk model derived fromTime-lapse imaging without PGS[J]. Reprod Biomed Online,2013, 27 (2) : 140-6. DOI: 10.1016/j.rbmo.2013.04.013. |
 2015, Vol. 35
2015, Vol. 35

