尽管近年来,宫颈癌的治疗方法和技术有了很大的提高,但其总的5年生存率没有明显提高,复发和转移是其主要原因。转移是指肿瘤细胞通过自身变形,脱离原发瘤,降解细胞外基质及新生血管形成而完成侵袭及转移过程。上皮间充质转化(EMT)是指上皮细胞在特定的生理和病理情况下向间充质细胞转化的现象,同时也伴有上皮性标记物表达降低(如E-cadherin、CK等),而间充质标记物表达升高(如vimentin、Twist、Slug、 Snail 等)。EMT被认为是肿瘤浸润转移的关键步骤。 锌指转录因子Snail是EMT过程中的关键转录因子,其通过与上皮性钙黏蛋白(E-cad)的启动子区E-box结构结合[1],抑制E-cad的转录表达,导致细胞彼此之间的黏附力降低,诱导EMT的发生,并促进浸润和转移。转录因子Slug也属于锌指结构家族,与Snail具有类似的结构,即含有4~6个锌指结构的高度保守的羧基末端和多变的氨基末端区域,也是EMT过程中的重要调控因子[2]。 Slug 也是通过与靶基因上E-box 结构结合,通过抑制 E-cad的表达而促进EMT的形成[3]。肿瘤转移抑制基因 KAI1 属于具有4 次跨膜糖蛋白结构的超家族成员之一,其主要功能就是抑制细胞的浸润及转移,在胚胎植入和肿瘤的转移过程中发挥重要作用[4-5]。目前关于 EMT过程中的转录因子Snail和Slug与肿瘤转移抑制因子KAI1在宫颈癌中的关系尚未见到有报道,本研究主要通过免疫组化方法检测154 例宫颈鳞状细胞癌 (cervical squamous cell carcinoma,CSCC)中Snail、 Slug和KAI1蛋白的表达,并分析它们之间的相互关系及其临床病理意义。
1 材料与方法 1.1 一般资料收集蚌埠医学院第一附属医院临床病理科2008年 1月~2009年12月存档石蜡包埋CSCC组织标本154例 (术前未行放、化疗)、宫颈上皮内瘤变组织标本(CIN)50 例和正常宫颈组织标本40例,所有病例均有完整的临床、病理及随访资料,入选病例随访至患者死亡或截止 2014年10月,随访时间为12~82个月。高分化43例,中分化89例,低分化22例;年龄26~65岁,中位年龄49.6 岁,≥50岁103例,<50岁751例;肿瘤长径D≥3.0 cm 88 例,D<3.0 cm 66例;有转移者56例,无转移者98例。浸润深度≥1/2 全层有98 例,<1/2 全层有56 例。根据 FIGO(FIGO)分期标准进行分期,其中ⅠB期患者91 例,ⅡA期患者51例,ⅡB期患者12例。
CIN组病例均为高级别上皮内瘤变组织(CIN 2~3 级)50例;正常组宫颈组织40例均因子宫肌瘤切除的宫颈组织,病理HE染色证实为正常宫颈组织。
1.2 试剂鼠抗人Slug 和KAI1 单克隆抗体购自美国Santa Cruz、鼠抗人Snail 单克隆抗体购自美国Abcam; ElivisionTM plus试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发有限公司。
1.3 实验方法所有标本均经4%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,烤干;接着在二甲苯溶液及等级梯度浓度的乙醇溶液中脱蜡至水洗,采用免疫组学 ElivisionTM plus法,所有操作步骤均按试剂盒说明书进行。利用已知阳性片作对照,以PBS液代替一抗作为空白对照。
1.4 结果判定Snail是以细胞核出现棕黄色颗粒为阳性;Slug主要是以细胞浆出现棕黄色颗粒为阳性,有时也会出现胞核着色;KAI1 是以细胞膜和浆出现棕黄色颗粒为阳性。采用二次计分法,每例标本随机选择10 个高倍视野(×400),计算每个视野中阳性细胞数占百分比及阳性强度并相乘,然后综合计分。具体方法见相关参考文献[5]。若积分≥2 分为阳性,<2 分为阴性。免疫组化染色结果由两位高年资病理医师通过独立双盲法读片评定。
1.5 统计分析采用SPSS 20.0 统计软件进行数据分析。Snail、 Slug和KAI1表达阳性组与阴性组生存分析用Kaplan- Meier法,组间比较采用log-rank检验,多因素分析采用 Cox回归多因素模型,Snail、Slug和KAI1在CSCC组织中表达与CIN组及正常宫颈组、各临床及病理因素的相关性采用χ2和Spearman等级相关检验,P<0.05为差异有统计学意义。
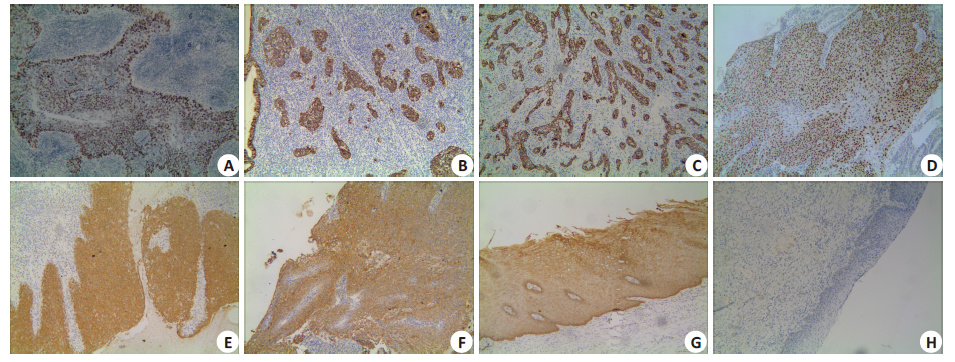
2 结果 2.1 CSCC中Snail蛋白的表达及其与临床病理参数的关系Snail蛋白在正常宫颈上皮细胞中的阳性表达率为 0%,在CIN组织中阳性表达率为32.0%,在CSCC组织中的阳性表达率为66.2%(图 1A),差异均有统计学意义 (P<0.05)。且Snail蛋白的阳性表达率与CSCC患者的年龄,肿瘤大小等无相关性(P>0.05)。随着CSCC的分化越差、浸润越深、FIGO分期越高,Snail蛋白的阳性表达率越高;淋巴结转移组中Snail蛋白的阳性表达率显著高于淋巴结无转移组(表 1)。
|
图 1 Snail、Slug和KAI1在IDC、CIN及宫颈正常组织中的阳性表达 Figure 1 Immunohistochemistry of Snail,Slug,and KAI1 expression in IDC,cervical intraepithelial neoplasm (CIN),and normal cervical tissues. A: Positive staining of Snail in nuclei of CSCC (well differentiated carcinoma); B: Positive staining of Slug in cytoplasm of CSCC (moderately differentiated carcinoma); C: Positive staining of KAI1 in membrane and cytoplasm of IDC (moderately differentiated carcinoma); D: Positive staining of Snail in nuclei of CIN; E: Positive staining of Slug in cytoplasm of CIN; F: Positive staining of KAI1 in membrane and cytoplasm of CIN; G: Positive staining of KAI1 in membrane and cytoplasm of normal cervical tissues; H: Negative control. |
| 表 1 CSCC中Snail、Slug和KAI1的表达与临床病理因素的关系 Table 1 Correlation of Snail,Slug,and KAI1 expression with the clinicopathologic characteristics of CSCC patients |
Slug 蛋白在正常宫颈组织中的阳性表达率为 2.5%,CIN中为34.0%,CSCC中位66.9%(图 1B),差异均有统计学意义(P<0.05)。Slug 阳性表达率与CSCC 组织的分化程度、浸润深度、淋巴结转移与否及FIGO分期均有相关性(P<0.05),即随着Slug 的阳性表达率越高,CSCC组织的分化越差、浸润越深、FIGO分期越高及更易发生淋巴结转移(表 1)。
2.3 CSCC中KAI1蛋白的表达及其与临床病理参数的关系KAI1蛋白在CSCC中的阳性表达率(43.5%)显著低于CIN组(64.0%)和正常组(95.0%),差异有统计学意义(P<0.05,图 1C)。KAI1 蛋白的阳性表达率与 CSCC患者的年龄、肿瘤大小等无关(P>0.05)。分化越差、浸润越深,KAI1蛋白的阳性表达率越低(P<0.05)。 淋巴结转移组中KAI1蛋白的阳性表达率明显低于其淋巴结未转移组;FIGO分期越高,KAI1蛋白的阳性表达率越低,差异有统计学意义(表 1)。
2.4 CSCC中Snail、Slug和KAI1之间的关系Spearman相关分析显示,Snail蛋白在CSCC中的表达与Slug呈正相关关系(r=0.752,P<0.001);Snail与 KAI1的表达呈负相关关系(r=-0.509,P<0.001);Slug与 KAI1的表达亦呈负相关关系(r=-0.384,P<0.001,表 2)。
| 表 2 CSCC中Snail、Slug及KAI1之间的关系 Table 2 Correlation among of Snail,Slug,and KAI1 expression in CSCC |
将CSCC组织病理分化(分为高分化组、中分化组与低分化组),年龄(分为≥50 岁组与<50 岁组)、FIGO 分期(分为ⅠB、ⅡA期组与ⅡB期组)、肿瘤直径(分为≥4.0 cm组与<4.0 cm组)、淋巴结转移(分为有转移组与无转移组)、浸润深度(分为≥1/2全层组和<1/2全层组)、Snail蛋白的表达(分为阳性表达组和阴性表达组)、Slug蛋白的表达(分为阳性表达组和阴性表达组)、 KAI1蛋白的表达(分为阳性表达组和阴性表达组)等因为带入Cox模型进行多因素分析发现:Snail和KAI1的表达以及FIGO分期是影响CSCC患者术后预后的独立危险因素(表 3)。
| 表 3 154例CSCC患者的多因素分析 Table 3 Multivariate survival analysis of 154 patients with CSCC |
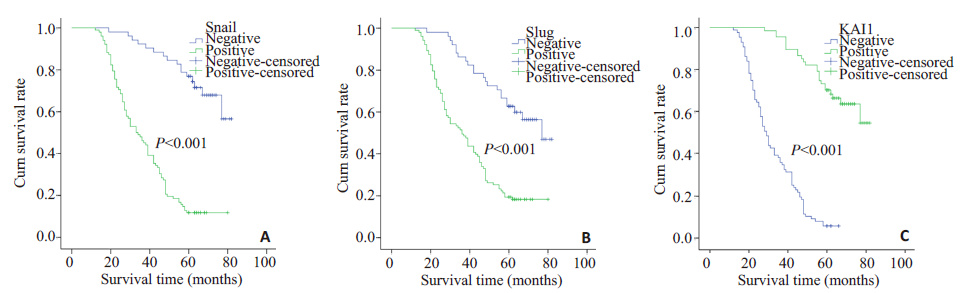
本组病例总的5年生存率为33.8%。Kaplan-Meier 生存分析显示Snail蛋白阳性表达组患者的生存时间明显短于其阴性表达组患者(Log-rank=29.513,P<0.001); Slug蛋白阳性表达组患者的生存时间也明显低于其阴性表达组患者(Log-rank=58.920,P<0.001);KAI1蛋白阳性表达组患者的生存时间明显高于其阴性表达组患者(Log-rank=96.487,P<0.001,图 2)。
|
图 2 Snail、Slug和KAI1表达阳性组与阴性组CSCC患者生存曲线 Figure 2 Survival curves of CSCC patients positive or negative for Snail (A),Slug (B) and KAI1 (C) expressions. |
EMT是指上皮细胞的极性丧失、黏附力降低或丧失、形态由圆形或立方形变为梭形,其运动能力增强,容易脱离母体,造成浸润和转移。同时上皮相关的标记物表达降低或丧失,而间充质相关的标记物表达增强。 EMT也是多细胞生物胚胎发育过程中的基础环节。近年来的研究发现大部分上皮源性恶性肿瘤在侵袭和浸润过程中都可能伴随有EMT现象[6],且有越来越多的证据表明EMT现象出现在恶性肿瘤的侵袭及转移的早期阶段。近年来的研究表明,Snail蛋白异常表达在某些时候参与了肿瘤细胞的侵袭、转移过程,其表达增高可能意味着患者预后较差[7]。Snail可以被许多肿瘤刺激因子所诱导,如TGF-β、EGF、Wnt 和Notch 等因子。 TGF-β可以调节PI3K/Akt信号通路,而PI3K/Akt信号通路的激活是EMT过程中的核心信号[8],因此,PI3K/ Akt信号通路和TGF-β可以协调诱导EMT过程。这些结果表明,Snail与EMT过程之间是有联系的。本研究通过免疫组化方法检测CSCC组织中Snail 蛋白的表达。发现在154例CSCC组织中,Snail蛋白的阳性表达率66.2%,明显高于其在CIN 组和正常组中表达,且 CIN组中的阳性表达率也显著高于正常组中的阳性表达率,这说明Slug蛋白的表达异常增高参与了CSCC的发生。并且Snail蛋白阳性表达率与CSCC患者肿瘤组织的分化程度、浸润深度、淋巴结转移与否及FIGO分期均有关,即Snail蛋白阳性表达的肿瘤细胞分化差、易于浸润及转移。Kaplan-Meier 生存曲线表明,Snail 蛋白阳性表达的患者生存时间短于其阴性表达患者,即 Snail阳性表达的患者预后差。以上结果与其他学者的研究结果一致[6-7, 9-10]。
Slug和Snail同属于Snail家族,都含有锌指结构,都是EMT过程中的关键调节因子,且都可以抑制细胞黏附分子E-cadherin的表达。Slug在上皮性恶性肿瘤表达增高往往意味着其发生EMT和易于侵袭[11]。近年来的研究已经发现在多种上皮性恶性肿瘤中有Slug蛋白的表达异常增高,例如乳腺癌、前列腺癌、胰腺癌、头颈部鳞癌和子宫内膜癌等[12-16]。本研究发现,Slug蛋白的阳性表达率在CSCC组中明显高于其在CIN组和正常组,且Slug蛋白的阳性表达率与CSCC肿瘤的分化程度、浸润深度、淋巴结转移与否及FIGO分期高低均有相关性,且Slug蛋白阳性表达的患者其生存时间明显短于其阴性表达患者,这些结果说明Slug蛋白的表达异常增高参与了CSCC的发生、发展、浸润及转移,与文献报道结果一致[11-17]。
KAI1最早是作为前列腺癌特异性转移抑制因子而被发现,后来发现其在多种肿瘤都能起到抑制肿瘤转移的作用。KAI1在肿瘤中的表达异常主要表现为表达缺失。在本实验中,我们发现KAI1的阳性表达率在正常组、CIN组和CSCC组中是逐步降低,差异有统计学意义;且随着KAI1蛋白阳性表达率越低,CSCC组织的分化越低、浸润越深、易于发生淋巴结转移及FIGO分期越高,说明KAI1蛋白的表达缺失参与了CSCC的发生、发展、浸润及转移。Kaplan-Meier生存分析也显示KAI1 蛋白阳性表达的患者生存时间明显高于其阴性表达患者。这些结果与国内外文献报道相一致[5, 18-20]。
在本研究中,Snail和Slug在正常宫颈组织中低表达或不表达,而在CIN组和CSCC组中表达是逐步升高的,差异有统计学意义;并且随着肿瘤的进展,Snail和 Slug的阳性表达率越高。Spearman相关分析发现在癌组织中随着KAI1蛋白阳性表达率的降低,Snail和Slug 蛋白的阳性表达率明显升高,呈负相关性,提示KAI1蛋白的表达降低或缺失与Snail和Slug的表达增高可能存在某种联系。目前的研究表明,E-cadherin是EMT发生过程中的关键上皮标记分子,其不仅参与了EMT的形成过程,并且还影响KAI1抑制肿瘤细胞侵袭与运动能力。一方面,E-cadherin的表达降低是上皮性肿瘤发生 EMT的最常用标记。当E-cadherin表达降低时,上皮细胞彼此之间的黏附力降低,且细胞的形态由圆形或扁平形变成梭形,导致运动能力增强及向间叶细胞分化,此时间叶源性相关标记明显升高,如Snail、Slug、Twist 等。另一方面,KAI1 主要通过维持E-cadherin/ β-cantenin 复合体的稳定性来发挥其抑制肿瘤侵袭、 转移的作用[21-22]。当KAI1 表达降低时,其所维系的 E-cadherin/β-cantenin复合体的稳定性降低,导致上皮性肿瘤的运动性增强,从而促进EMT的发生。随着肿瘤的发展,上皮细胞之间的黏附力降低,部分肿瘤细胞的形态由原来的扁平形转变为梭形,导致其运动能力增强,促进其间质标记Snail 和Slug 的表达增强,导致 EMT 的发生;而此时KAI1 的表达降低又抑制了 E-cadherin的表达,进一步促进CSCC的EMT,从而促进肿瘤的侵袭及转移。同时,本研究的多因素分析表明,Snail 和KAI1 蛋白的表达以及FIGO 分期是影响 CSCC患者预后的独立危险因素。
综上所述,Snail和Slug作为EMT过程的关键转录因子,其表达异常增高可能参与了CSCC的发生、发展、 浸润及转移过程,而KAI1蛋白的表达降低或缺失可能进一步促进了CSCC细胞的侵袭及转移。因此,早期联合检测Snail、Slug和KAI1有助于预测CSCC的浸润及转移,同时也可以作为预测CSCC患者预后的新指标。
| [1] | Larue L, Bellacosa A. Epithelial-mesenchymal transition in development and cancer: role of phosphatidylinositol 3'kinase/AKT pathways[J]. Oncogene, 2005, 24 (50): 7443-54. DOI: 10.1038/sj.onc.1209091. |
| [2] | Nassour M, Idoux-Gillet Y, Selmi A, et al. Slug controls stem/ progenitor cell growth dynamics during mammary gland morphogenesis[J]. PLoS One, 2012, 7 (12): e53498. DOI: 10.1371/journal.pone.0053498. |
| [3] | Jethwa P, Naqvi M, Hardy RG, et al. Overexpression of slug is associated with malignant progression of esophageal adenocarcinoma[J]. World Journal of Gastroenterology, 2008, 14 (7): 1044-52. DOI: 10.3748/wjg.14.1044. |
| [4] | Gellersen B, Briese J, Oberndörfer M, et al. Expression of the metastasis suppressor KAI1 in decidual cells at the human maternal-fetal interface: Regulation and functional implications[J]. Am J Pathol, 2007, 170 (1): 126-39. DOI: 10.2353/ajpath.2007.060175. |
| [5] | 武世伍, 承泽农, 俞岚, 等. CD82/KAI1和HIF-1α在非小细胞肺癌中的表达及其与血管生成拟态的关系[J]. 中国肺癌杂志, 2011, 14 (12): 918-25. |
| [6] | Liu CW, Li CH, Peng YJ, et al. Snail regulates Nanog status during the epithelial-mesenchymal transition via the Smad1/Akt/GSK3β signaling pathway in non-small-cell lung cancer[J]. Oncotarget, 2014, 5 (11): 3880-94. DOI: 10.18632/oncotarget. |
| [7] | Peinado H, Olmeda D, Cano A. Snail, Zeb and bHLH factors in tumor progression: an alliance against the epithelial phenotype?[J]. Nat Rev Cance, 2007, 7 (6): 415-28. DOI: 10.1038/nrc2131. |
| [8] | Hong KO, Kim JH, Hong JS, et al. Inhibition of Akt activity induces the mesenchymal-to-epithelial reverting transition with restoring E-cadherin expression in KB and KOSCC-25B oral squamous cell carcinoma cells[J]. J Exp Clin Cancer Res, 2009, 28 : 28. DOI: 10.1186/1756-9966-28-28. |
| [9] | Cai W, Ye Q, She QB. Loss of 4E-BP1 function induces EMT and promotes cancer cell migration and invasion via cap-dependent translational activation of snail[J]. Oncotarget, 2014, 5 (15): 6015-27. DOI: 10.18632/oncotarget. |
| [10] | Smith BN, Burton LJ, Henderson V, et al. Snail promotes epithelial mesenchymal transition in breast cancer cells in part via activation of nuclear ERK2[J]. PLoS One, 2014, 9 (8): e104987. DOI: 10.1371/journal.pone.0104987. |
| [11] | Tang P, Yu Z, Zhang K, et al. Slug down-regulation by RNA interference inhibits invasion growth in human esophageal squamous cell carcinoma[J]. BMC Gastroenterol, 2011, 11 (4): 60. |
| [12] | Markiewicz A, Ahrends T, Welnicka-Jaśkiewicz M, et al. Expression of epithelial to mesenchymal transition-related markers in lymph node metastases as a surrogate for primary tumor metastatic potential in breast cancer[J]. J Transl Med, 2012, 10 (6): 226. |
| [13] | Behnsawy HM, Miyake H, Harada K, et al. Expression patterns of epithelial-mesenchymal transition markers in localized prostate cancer: significance in clinicopathological outcomes following radical prostatectomy[J]. BJU Int, 2013, 111 (1): 30-7. DOI: 10.1111/j.1464-410X.2012.11551.x. |
| [14] | Zhang K, Chen D, Jiao X, et al. Slug enhances invasion ability of pancreatic cancer cells through upregulation of matrix metalloproteinase-9 and actin cytoskeleton remodeling[J]. Lab Invest, 2011, 91 (3): 426-38. DOI: 10.1038/labinvest.2010.201. |
| [15] | Smith A, Teknos TN, Pan Q. Epithelial to mesenchymal transition in head and neck squamous cell carcinoma[J]. Oral Oncol, 2013, 49 (4): 287-92. DOI: 10.1016/j.oraloncology.2012.10.009. |
| [16] | Tanaka Y, Terai Y, Kawaguchi H, et al. Prognostic impact of EMT (epithelial-mesenchymal-transition)-related protein expression in endometrial cancer[J]. Cancer Biol Ther, 2013, 14 (1): 13-9. DOI: 10.4161/cbt.22625. |
| [17] | Hasan MR, Sharma R, Saraya A, et al. Slug is a predictor of poor prognosis in esophageal squamous cell carcinoma patients[J]. PLoS One, 2013, 8 (12): e82846. DOI: 10.1371/journal.pone.0082846. |
| [18] | Liu X, Guo XZ, Li HY, et al. KAI1 inhibits lymphangiogenesis and lymphatic metastasis of pancreatic cancer in vivo[J]. Hepatobiliary Pancreat Dis Int, 2014, 13 (1): 87-92. DOI: 10.1016/S1499-3872(14)60012-6. |
| [19] | Yu L, Zhou L, Wu S, et al. Clinicopathological significance of cancer stem cells marked by CD133 and KAI1/CD82 expression in laryngeal squamous cell carcinoma[J]. World J Surg Oncol, 2014, 12 (7): 118. |
| [20] | 周蕾, 武世伍, 俞岚, 等. 胃腺癌中KAI1的表达及其与血管淋巴管生成的关系[J]. 四川大学学报: 医学版, 2014, 45 (1): 43-8. |
| [21] | Shiwu WU, Lan Y, Wenqing S, et al. Expression and clinical significance of CD82/KAI1 and E-cadherin in non-small cell lung cancer[J]. Arch Iran Med, 2012, 15 (11): 707-12. |
| [22] | 刘静, 杨桂芳, 龚玲玲, 等. KAI1/CD82和E钙黏着糖蛋白及整合素β 1 表达与胃癌侵袭转移的关系[J]. 中华病理学杂志, 2007, 38 (8): 558-9. |
 2015, Vol. 35
2015, Vol. 35

