心血管疾病(CVD)是慢性肾脏病(CKD)最常见的并发症[1],其中尿毒症心肌病(UCM)一直是治疗的难点及研究的热点[2]。尿毒症心肌病是由慢性肾功能不全导致的心肌损害,主要特点为左室肥厚、毛细血管密度下降、纤维化及心室重塑,易致心源性猝死、心律失常及心功能不全。流行病学研究[3]显示,终末期肾病患者心因性死亡主要见于心源性猝死、心律失常或充血性心力衰竭,故防治尿毒症心肌病意义重大。现临床单纯运用西药治疗尿毒症心肌病的疗效并不能让人满意[4]。既往研究表明[5-6],基于多靶点,多途径,多环节等作用特点,中药治疗尿毒症心肌病效果明显。真武汤是出自张仲景《伤寒论》的经典名方,现主要用于肾功能不全和心功能不全的治疗且疗效尚可[7-8]。邱模炎等[9]运用真武汤处理慢性肾衰竭大鼠,发现真武汤具有抗肾间质纤维化的作用。谢志翔等[10]研究发现真武汤可以逆转大鼠慢性压力负荷性心肌肥厚。目前尚未见关于真武汤治疗尿毒症心肌病的报道。本实验运用真武汤干预肾大部分切除小鼠,观察真武汤对术后小鼠心脏功能与结构的影响,探讨真武汤对尿毒症心肌病的防治效果。
1 材料与方法 1.1 材料 1.1.1 动物健康2月龄SPF级C57BL/6雄性小鼠购于广东省医学实验动物中心,许可证号:SCXK(粤) 2013-0002。
1.1.2 药物真武汤由中药配方颗粒(广东一方制药有限公司)淡附片1.7836 g,茯苓0.7594 g,生姜2.5480 g,白芍1.5288 g,白术3.0576 g混合溶解于112 mL温蒸馏水制成[11]。
1.2 方法 1.2.1 分组将小鼠随机分为假手术组(Sham,n=10)、 模型组(STNx,n=10)、真武汤组(ZWT,n=10)。
1.2.2 制模[12-13]予1%戊巴比妥钠50 mg/kg腹腔注射麻醉小鼠,约2 min后,小鼠呈麻醉状态,仰卧位固定小鼠,腹部备皮,消毒,铺巾,沿腹中线切开皮肤,切口长约 2 cm,用棉签小心暴露右肾,结扎右肾肾蒂后切除右肾。小心暴露左肾,切除左肾上级约1/3肾脏组织,明胶海绵压迫止血,切除左肾下级约1/3 肾脏组织,明胶海绵压迫止血。左肾残留肾门处约2 mm宽肾脏组织。约5 min后小心夹除明胶海绵,观察切口有无渗血,若有渗血换明胶海绵继续压迫,若无则复位左肾,逐层缝合腹部切口。假手术组只剥离两肾肾包膜。手术过程中注意勿损伤肾上腺。
1.2.3 给药术后第1 天开始给药,予真武汤配方颗粒 6.37 g/kg/d[14]灌胃,假手术组和模型组予等量蒸馏水灌胃。
1.2.4 心脏超声检查给药8周后在异氟烷经口鼻吸入麻醉下,用Vevo2100 Imaging System(Visual Sonics Inc.Toronto Canada)400探头30 MHz行心脏超声检查,分别检测舒张期左室后壁厚度(LVPWd)、收缩期左室后壁厚度(LVPWs)、舒张期左室内径(LVEDd)、收缩期左室内径(LVESd)、左室射血分数(LVEF)及左室短轴缩短率(LVFS)。
1.2.5 生化指标检测称体质量(BW)后采用摘眼球取血法收集小鼠血液标本,室温下静置1 h后离心(4 ℃,3000 r/min,10 min),收集血清使用全自动化生化分析仪检测血尿素氮(BUN)及血肌酐(Scr)。
1.2.6 心脏组织病理染色取血后立即开胸取出心脏,剪除左右心耳及残存大血管后纱布吸干血迹,电子秤称心脏质量(HW)。将心脏分为两部分,一部分置于-80 ℃ 冰箱中备用,另一部分置于10%福尔马林溶液中固定。 固定24 h后进行脱水、包埋、切片及HE染色。
1.2.7 心脏组织行Western blotting 检测目的蛋白取-80 ℃保存的心脏组织约50 mg置于1.5 mL EP管中,加入预冷的组织裂解液(碧云天)1 mL,超声破碎仪匀浆3次后置于冰上30 min,离心(4 ℃,12 000 r/min,15 min),吸取上清置于另一EP管中。取少量上清液按 BCA蛋白定量试剂盒(Pierce)操作步骤进行定量。将所有蛋白样品调至等浓度,充分混合后加5×上样缓冲液后100 ℃煮沸变性8 min,取蛋白样品冰浴5 min后上样,加样量25 μL。积层胶60 V,分离胶120 V电泳。电泳结束后,转至PVDF膜1 h,将转有蛋白的PVDF膜置于10%脱脂奶粉中封闭2 h,PBST洗膜5次,每次5 min。 置于一抗(AMPK,p-AMPK,mTOR,p-mTOR(Cell Signaling Technology,USA)分别用封闭液1∶1000 稀释,GAPDH抗体按1∶5000 稀释)中,4 ℃摇床震荡过夜。PBST洗膜5次,每次5 min。置于辣根过氧化物酶标记的二抗(武汉博士德,封闭液1∶5000稀释)4 ℃孵育 1 h,PBST洗膜5次,每次5 min。暗室中取ECL荧光底物(Pierce)A液和B液各1 mL,混匀后将PVDF膜浸泡其中,室温孵育3 min后,用滤纸将PVDF膜表面液体擦干,并将其置于暗盒,取医用X光底片覆盖,曝光1 min 后,依次显影、定影。
1.3 统计学分析计量资料数据以均数±标准差表示,使用SPSS 19.0软件处理,数据行one-way ANOVA,组间两两比较方差齐时采用LSD法,方差不齐时采用Dunnett's T3法,P<0.05表示差异具有统计学意义。
2 结果 2.1 小鼠肾功能指标模型组和真武汤组小鼠尿素氮及血肌酐较假手术组明显升高(P<0.05),真武汤组尿素氮及血肌酐较模型组无明显变化(表 1)。
| 表 1 各组小鼠尿素氮及血肌酐比较 Table 1 Comparison of BUN and Scr in different groups |
模型组及真武汤组小鼠体质量较假手术组明显降低(P<0.05),模型组心脏质量及心脏指数较假手术组明显增加(P<0.05),真武汤组小鼠心脏质量及心脏指数较模型组明显降低(P<0.05,表 2)。
| 表 2 各组小鼠体质量、心脏质量、心脏指数比较 Table 2 Comparison of BW,HW and HW/BW among the 3 groups |
模型组小鼠LVPWd及LVPWs较假手术组明显增大(P<0.05),真武汤组小鼠LVPWd及LVPWs较模型组明显减小(P<0.05),LVEDd,LVEDd,LVEF及LVFS无明显变化(表 3,图 1)。
| 表 3 各组小鼠心脏超声指标比较 Table 3 Comparison of echocardiography parameters among the 3 groups |
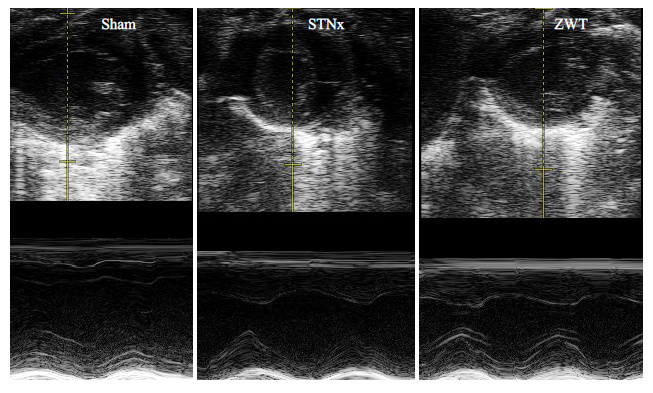
|
图 1 各组小鼠心脏超声图像表现 Figure 1 Echocardiographic presentation in different groups. |
假手术组小鼠心肌细胞排列整齐,细胞核大小均一,胞浆染色均匀,心肌纤维排列整齐;模型组小鼠心肌细胞肥大,细胞核增大,形态不规则,核仁浓染,胞浆染色加深,心肌纤维增粗,排列紊乱;真武汤组小鼠心肌细胞病理改变较模型组减轻(图 2)。
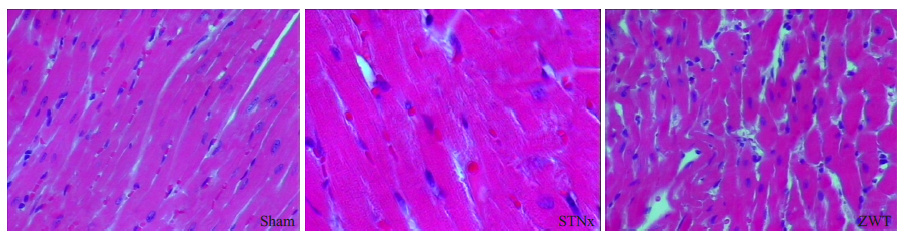
|
图 2 心肌组织HE染色 Figure 2 Pathological changes of the heart tissues in different groups (HE staining,original magnification: ×400). |
模型组小鼠与假手术组相比p-AMPK表达明显降低,真武汤组小鼠与模型组相比p-AMPK表达明显升高,模型组小鼠与假手术组相比p-mTOR表达明显升高,真武汤组小鼠与模型组相比p-mTOR表达明显降低 (图 3)。
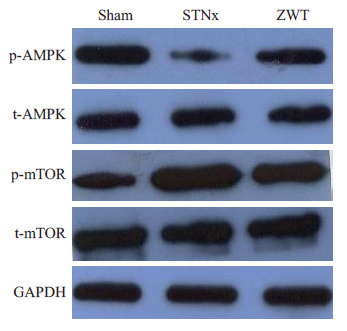
|
图 3 小鼠心脏组织AMPK,p-AMPK,mTOR,p-mTOR表达情况 Figure 3 Expression of AMPK,p-AMPK,mTOR,and p-mTOR in heart tissues. |
尿毒症心肌病发病机制复杂[15]:包括压力负荷及容量负荷增加,继发性甲状旁腺功能亢进和钙磷代谢紊乱,尿毒症毒素直接毒性作用及贫血等。以往认为压力负荷及容量负荷增加是导致尿毒症心肌病心肌肥厚的最主要原因,然而近年来的研究发现尿毒症心肌病具有独立于负荷增加的其他发病机制。Taylor等[16]运用大鼠大部分肾切除模型研究线粒体氧化功能及其对缺血再灌注的敏感性,发现在尿毒症心肌病大鼠心肌中线粒体呼吸链慢性解偶联,从而导致线粒体功能严重受损。
尿毒症心肌病最主要表现为左心室肥厚。本实验以真武汤治疗大部分肾切除导致的尿毒症心肌病小鼠,发现真武汤可抑制术后小鼠的心肌肥厚。进一步研究显示模型组小鼠与假手术组相比p-AMPK表达明显降低,p-mTOR表达明显升高,真武汤组小鼠与模型组相比p-AMPK表达明显升高,p-mTOR表达明显降低,说明真武汤抑制尿毒症心肌肥厚作用与AMPK-mTOR信号密切相关。AMPK[17]刚被发现是作为脂质合成代谢的关键负向调节酶,后来发现其在抑制许多合成代谢过程的同时也激活一系列分解代谢过程。雷帕霉素靶蛋白(TOR)最初被发现是作为雷帕霉素抗真菌的作用靶点。Zhou等[18]用艾塞那肽处理苯肾上腺素导致的肥厚心肌细胞,发现其可通过AMPK-mTOR信号途径抑制心肌细胞肥厚。结合本研究结果,我们认为真武汤抑制尿毒症心肌病心肌肥厚效应可能经AMPK-mTOR信号途径实现。
既往研究[19]证实真武汤可通过抑制肾小球肥大、系膜细胞增生及足突肿胀,抑制血管紧张素Ⅱ及膜蛋白的表达,从而降低尿蛋白含量,改善肾功能。真武汤还可通过上调心肌组织B细胞淋巴瘤基因-2(Bcl-2)表达,下调Bcl-2 相关X蛋白(Bax)表达抑制心肌细胞凋亡而改善心功能[20]。刘聪等[21]研究发现,以真武汤治疗冠脉结扎构建的大鼠心力衰竭模型时,大鼠血清中血管紧张素Ⅱ明显降低,提示真武汤可能通过对肾素-血管紧张素-醛固酮系统(RASS)激活的抑制发挥其抗心肌重构作用。而关于真武汤对尿毒症心肌病的作用目前仍未见相关研究。本实验运用真武汤治疗尿毒症心肌病小鼠有效,并且进一步从分子生物学层面显示其治疗作用可能是通过AMPK-mTOR信号途径实现。本研究为深入阐明尿毒症心肌病发病机制,发掘尿毒症心肌病治疗靶点提供了新的思路与途径,为临床运用中药治疗尿毒症心肌病提供了理论依据。
| [1] | Schiffrin EL, Lipman ML, Mann JF. Chronic kidney disease: effects on the cardiovascular system[J]. Circulation, 2007, 116 (1): 85-97. DOI: 10.1161/CIRCULATIONAHA.106.678342. |
| [2] | Semple D, Smith K, Bhandari S, et al. Uremic cardiomyopathy and insulin resistance: a critical role for akt?[J]. J Am Soc Nephrol, 2011, 22 (2): 207-15. DOI: 10.1681/ASN.2009090900. |
| [3] | Edwards NC, Moody WE, Chue CD, et al. Defining the natural history of uremic cardiomyopathy in chronic kidney disease: the role of cardiovascular magnetic resonance[J]. JACC Cardiovasc Imaging, 2014, 7 (7): 703-14. DOI: 10.1016/j.jcmg.2013.09.025. |
| [4] | Collins AJ, Foley RN, Gilbertson DT, et al. United States renal data system public health surveillance of chronic kidney disease and end-stage renal disease[J]. Kidney Int Suppl, 2015, 5 (1): 2-7. DOI: 10.1038/kisup.2015.2. |
| [5] | 黄敏, 李骅, 曹锋生. 参附注射液对尿毒症心肌病并心功能衰竭患者的疗效观察[J]. 临床急诊杂志, 2014 (10): 625-7. |
| [6] | 陈红艳, 刘烨. 芪苈强心胶囊治疗尿毒症性心肌病临床效果分析[J]. 中国实用医药, 2015 (24): 159-60. |
| [7] | 陈玉洁. 真武汤加味治疗慢性肾功能不全疗效观察[J]. 河南中医, 2014 (9): 1658-9. |
| [8] | 叶欣, 邹立华, 冯德勇, 等. 真武汤治疗慢性充血性心力衰竭疗效观察[J]. 中国实用医药, 2013 (30): 145-6. |
| [9] | 邱模炎, 姜岳, 赵宗江, 等. 真武汤抗大鼠肾间质纤维化作用的研究[J]. 中国实验方剂学杂志, 2010, 16 (17): 177-80. |
| [10] | 谢志翔, 陈科, 梁智敏, 等. 真武汤逆转大鼠心肌肥厚的病理学研究[J]. 中华临床医师杂志:电子版, 2012 (1): 103-6. |
| [11] | 徐中菊, 张悦, 舒适, 等. 真武汤对链脲佐菌素所致大鼠糖尿病肾病的保护作用[J]. 中国病理生理杂志, 2014 (9): 1677-81. |
| [12] | Kramann R, Erpenbeck J, Schneider RK, et al. Speckle tracking echocardiography detects uremic cardiomyopathy early and predicts cardiovascular mortality in ESRD[J]. J Am Soc Nephrol, 2014, 25 (10): 2351-65. DOI: 10.1681/ASN.2013070734. |
| [13] | Kennedy DJ, Elkareh J, Shidyak A, et al. Partial nephrectomy as a model for uremic cardiomyopathy in the mouse[J]. Am J Physiol Renal Physiol, 2008, 294 (2): F450-4. |
| [14] | 徐叔云. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002. |
| [15] | Alhaj E, Alhaj N, Rahman I, et al. Uremic cardiomyopathy: an underdiagnosed disease[J]. Congest Heart Fail, 2013, 19 (4): E40-5. DOI: 10.1111/chf.2013.19.issue-4. |
| [16] | Taylor D, Bhandari S, Seymour AM. Mitochondrial dysfunction in uremic cardiomyopathy[J]. Am J Physiol Renal Physiol, 2015, 308 (6): F579-87. DOI: 10.1152/ajprenal.00442.2014. |
| [17] | 陈保林, 熊肇军, 张成喜, 等. AMPK对心肌细胞FOXO1转录因子活性及泛素连接酶MuRF1表达的影响[J]. 南方医科大学学报, 2010 (11): 2419-22. |
| [18] | Zhou Y, He X, Chen Y, et al. Exendin-4 attenuates cardiac hypertrophy via AMPK/mTOR signaling pathway activation[J]. Biochem Biophys Res Commun, 2015, 468 (1/2): 394-9. |
| [19] | Cai Y, Chen J, Jiang J, et al. Zhen-wu-tang, a blended traditional Chinese herbal medicine, ameliorates proteinuria and renal damage of streptozotocin-induced diabetic nephropathy in rats[J]. J Ethnopharmacol, 2010, 131 (1): 88-94. DOI: 10.1016/j.jep.2010.06.004. |
| [20] | 陈国庆, 姚淮芳. 真武汤对慢性心力衰竭大鼠心肌细胞凋亡的影响[J]. 中国中医急症, 2011 (6): 909-10. |
| [21] | 刘聪, 李文杰, 谢静. 真武汤对心力衰竭大鼠血清AngⅡ及ALD的影响[J]. 中华中医药学刊, 2015 (6): 1374-6. |
 2015, Vol. 35
2015, Vol. 35

