2. 烟台龙矿中心医院,山东 烟台 265700
2. Yantai Longkuang Central Hospital, Yantai 265700, China
趋化因子是一类对不同靶细胞具有趋化作用的细胞因子,可通过与靶细胞膜上相应的趋化因子受体结合,发挥趋化靶细胞定向迁移的作用。现已有许多研究报道,趋化因子参与机体的炎症、肿瘤、自身免疫疾病等病理过程[1]。I-TAC是干扰素诱导的T细胞α亚族趋化因子,属于CXC趋化因子亚族。外周血淋巴细胞、子宫内膜细胞、星形胶质细胞、单核细胞、内皮细胞以及巨噬细胞中均有I-TAC表达。I-TAC与受体CXCR3结合,可发挥趋化T细胞、B细胞、NK细胞亚群等作用,并可抑制血管内皮细胞增殖[2]。高剂量的I-TAC可以引起快速强烈的CD4+T细胞表面CXCR3表达,从而有强烈的趋化作用[3],且对记忆性T细胞的趋化作用强于初始T 细胞[4]。有研究表明,表达于肿瘤细胞表面的I-TAC和表达于T细胞表面的CXCR3结合,引起特异性细胞毒性T淋巴细胞(CTL)向肿瘤细胞的移动[5]。有研究发现[6],成纤维细胞分泌的I-TAC通过趋化因子受体CXCR3促进卵巢癌细胞增殖及迁移,而I-TAC在卵巢癌组织高表达。另有研究报道[1]表面能稳定表达CXCR3 的 CD27NK细胞,可优先被趋化至肿瘤组织,发挥效应。 以上研究表明I-TAC有潜在抗肿瘤的作用。
本实验室已经建立了细胞膜表面锚定修饰平台[7-13],通过链亲合素和生物素之间快速且几乎不可逆的结合,将融合蛋白修饰到已生物素化的肿瘤细胞表面。借助该平台,本研究制备了SA/hI-TAC融合蛋白,并对其表达、纯化、复性及体外活性进行了研究。淋巴细胞趋化实验结果显示,融合蛋白可发挥趋化作用且此作用与融合蛋白呈剂量依赖性。本研究为今后开展该融合蛋白的动物实验和研制新型肿瘤疫苗打下基础。
1 材料与方法 1.1 材料 1.1.1 菌株与细胞大肠杆菌Max Efficiency DH5αTM 和E.coli Rosetta(DE3)购自Novagen 公司,pET24a (+)-SA-IFN-α、pET21a(+)- IL-7-SA质粒由本室保存。 小鼠前列腺癌细胞株(MB49)由本室保存。
1.1.2 试剂dNTP、IPTG 购自Sigma 公司;Platinum Pfx DNA聚合酶和T4 DNA连接酶购自Invitrogen;限制性内切酶购自TaKaRa;PCR 产物纯化试剂盒、凝胶回收试剂盒、质粒提取试剂盒、Ni-NTA螯合层析填料购自Qiagen,链亲合素- 小鼠干扰素诱导蛋白10 (IP-10-SA)(本室保存);Sulfo-NHS-LC-Biotin 购自美国Pierce 公司;辣根过氧化物酶标记山羊抗小鼠IgG、 DAB显色试剂盒、FITC标记山羊抗小鼠IgG、硝酸纤维素膜等均购自上海碧云天公司。
1.2 方法 1.2.1 目的基因的克隆以及重组表达载体的构建Trizol 抽提经PHA -活化和hIFN刺激48 h的外周血单个核细胞的总RNA,作为模板进行RT- PCR 扩增,得到hI-TAC基因。
SA-hI-TAC中h I-TAC的引物:
上游引物(EcoRⅠ酶切位点): 5'-atagaattcatgttccccatgttcaaaaga-3'
下游引物(HindⅢ酶切位点):
5'-ggtaagcttcttaaaaattctttctttcaac-3'
反应条件如下:94 ℃,3 min;94 ℃,30 s;52 ℃,30 s; 72 ℃,30 s;29个循环后再72 ℃,10 min。
hI-TAC-SA中h I-TAC的引物:
上游引物(NdeⅠ酶切位点): 5'-atacatatgttccccatgttcaaaagag-3'
下游引物(EcoR I酶切位点):
5'-ggggaattcaaaattctttctttcaac-3'
反应条件除退火温度为54℃外,其它条件同上。
将上述SA和hI-TAC基因片段根据酶切位点不同分别克隆至pET24a 和pET21a 载体中,获得pET24a- SA-hI-TAC和pET21a-hI-TAC-SA表达质粒。表达质粒经限制性内切酶酶切鉴定及DNA测序分析。
1.2.2 SA/h I-TAC 融合蛋白的表达将pET24a-SAhI- TAC和pET21a-hI-TAC-SA质粒转化大肠杆菌BL21 感受态细胞,挑取单克隆菌落,分别接种于含50 μg/mL 卡那霉素、34 μg/mL氯霉素的LB 培养基和含50 μg/mL 氨苄青霉素、34 μg/mL氯霉素的LB 培养基中,37 ℃培养,A600为0.4~0.6 时加入IPTG 诱导。选择高表达的菌落大量诱导培养,12% SDS-PAGE检测融合蛋白的表达情况。
1.2.3 SA/h I-TAC融合蛋白的纯化将细菌用高压破碎,离心收集包涵体,包涵体洗涤液(专利 CN1169998A)初步洗涤后用包涵体溶解液(8M尿素,50 mmol/L 磷酸盐缓冲液,10 mm β-巯基乙醇)溶解,4 ℃搅拌过夜,12 000 r/min,离心15 min,上清过滤后上样Ni-NTA柱,依次用含30、50、75、100、150、200 mmol/L 咪唑的平衡液(20 mmol/L Tris-HCl,5 mmol/L β-巯基乙醇,0.5 mol/L NaCl,6 mol/L 尿素)洗脱,收集洗脱峰。取浓度较高的Ni-NTA 亲和层析纯化后的SA/ hI-TAC融合蛋白(浓度约为0.2~0.3 mg/mL)过滤后上 S-100凝胶过滤层析柱(1 mL/min)。洗脱液洗脱,收集蛋白,12% SDS-PAGE电泳检测目的蛋白纯化情况,BCA法测蛋白浓度。
1.2.4 SA/hI-TAC融合蛋白的复性及鉴定调整纯化后的目的蛋白浓度至100~200 μg/mL,在大于蛋白体积20倍的透析液(20 mmol/L Tris-HCl、4 mol/L Urea、50 mmol/L NaCl、1 mmol/L GSH、0.125 mmol/L GSSG、0.5 mmol/L EDTA、5%甘油)中4 ℃透析复性,逐渐降低尿素浓度,最后用PBS透析8 h。不溶物经离心去除,上清过滤除菌,分装后保存(-70 ℃),WB鉴定。
1.2.5 SA/hI-TAC融合蛋白的活性测定淋巴细胞趋化实验检测SA/hI-TAC融合蛋白I-TAC的生物学活性:将复性后的SA/hI-TAC融合蛋白调整至以下浓度(40、4、 0.4、0.04、0.004 μg/mL),阴性对照为PBS,IP-10-SA蛋白(40 μg/mL)作为阳性对照,将蛋白以500 μL/孔加至趋化小室下层,每个蛋白浓度设3个复孔。将SA-hIL15 刺激培养的淋巴细胞用PBS洗涤3次,调整细胞数为5× 106/mL,并用RPMI 1640无血清培养基重悬细胞;趋化小室上层加入细胞(100 μL/孔);将趋化小室放入37 ℃,5% CO2培养箱中,孵育3~4 h;取出趋化小室上层,将下层细胞混匀,计数各孔细胞数,计算趋化指数:
| $趋化指数=\frac{实验组趋化的细胞数}{阴性对照组趋化的细胞数}$ |
流式细胞仪测定融合蛋白对表面已生物素化的 MB49膀胱癌细胞的修饰效率:调整MB49细胞密度为2× 106/mL,加入Sulfo-NHS-LC-Biotin至终浓度为1 mg/mL,37 ℃处理30 min,PBS洗涤后加入融合蛋白作用1 h,PBS洗涤后加入抗His鼠单克隆抗体,室温作用30 min,PBS洗涤后加入FITC标记的山羊抗小鼠IgG,室温避光作用30 min,500 μL PBS 重悬上机检测,流式细胞仪检测SA-hI-TAC和hI-TAC-SA对MB49细胞的修饰效率。
2 结果 2.1 pET24a-SA-hI-TAC和pET21a-hI-TAC-SA重组表达质粒构建经PCR扩增出hI-TAC-SA和SA-hI-TAC的I-TAC 两片段(图 1A),将其分别克隆到表达载体pET21a-SA 和pET24a-SA质粒中,构建了重组表达载体。将重组质粒分别用EcoRⅠ和HindⅢ,NdeⅠ和EcoRⅠ进行双酶切鉴定,获得和预期大小相同的片段(图 1B、C)。经 DNA测序,所得结果与GenBank收录hI-TAC和SA序列完全一致,基因阅读框架正确,无移码。
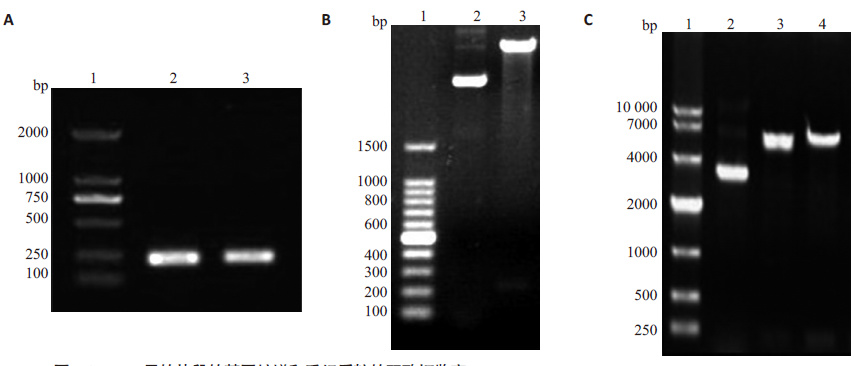
|
图 1 hI-TAC目的片段的基因扩增和重组质粒的双酶切鉴定 Figure 1 hI-TAC DNA and identification of recombinant expression plasmid. A: 1. Marker,2. I-TAC-SA(I-TAC part),3. SA-I-TAC (I-TA part); B: 1. Marker 2. pET24a-SA -hI-TAC recombinant expression plasmid. 3.digesting fragment of recombinant plasmid by EcoR I and Hind III(SA-L-hI-TAC); C: 1. Marker,2. pET21a-hI-TAC-SA recombinant expression plasmid,3. digesting fragment of recombinant plasmid by Nde I and EcoR I (hI-TAC-L-SA). |
将重组质粒pET24a-SA-hI-TAC 和pET21a-hITAC- SA分别转入大肠杆菌Rosetta 中,经表达筛选后获得较高表达量的工程菌。12% SDS-PAGE蛋白质电泳检测其诱导表达情况。结果显示:SA-hI-TAC(图 2) 和hI-TAC-SA(图 3)均在相对分子质量29 000 处有明显的蛋白带,与预测的目的融合蛋白的相对分子质量相符,未经诱导的工程菌在同一位置均未见蛋白带。通过薄层扫描分析,SA-hI-TAC和hI-TAC-SA目的蛋白分别约占工程菌表达的总蛋白12%和25%,目的蛋白主要以包涵体形式表达。
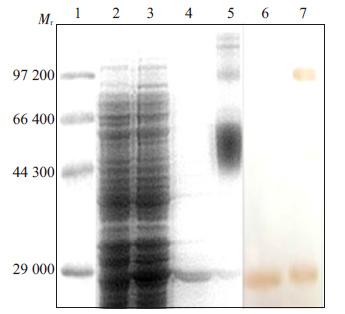
|
图 2 SA-hI-TAC融合蛋白的表达纯化、复性及其Western blot鉴定 Figure 2 Analysis of expression and purification of SA-hI-TAC fusion protein by SDS-PAGE and Western blotting. 1: Marker; 2: Total protein of bacteria not induced by IPTG; 3: Total protein of bacteria induced by IPTG; 4: the protein after purification; 5: The oxidation of protein after refolding; 6: The reduction of protein after purification identified by Western blot; 7: The oxidation of protein after refolding identified by Western blot. |
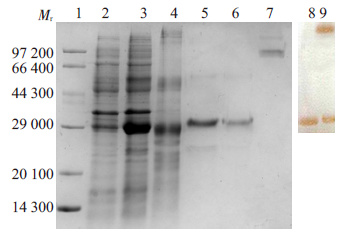
|
图 3 hI-TAC-SA融合蛋白的表达纯化、复性及其Western blotting鉴定 Figure 3 Analysis of the expression and purification of hI-TAC-SA fusion protein by SDS-PAGE and Western blotting. 1: Marker; 2: Total protein of bacteria not induced by IPTG; 3: Total protein of bacteria induced by IPTG; 4: inclusion body washed; 5: hI-TAC-SA fusion protein purified by Ni-NTA; 6: hI-TAC-SA fusion protein purified by S-100; 7: The oxidation of protein after refolding; 8: The reduction of protein after purified identified by Western blot; 9: The oxidation of protein after refolding identified by Western blot. |
含SA-hI-TAC融合蛋白的包涵体用8 mol/L 尿素溶解后,上清经Ni-NTA柱纯化,目的蛋白纯度约85%。 取镍柱纯化的SA-I-TAC融合蛋白用S-100凝胶柱进行分子筛纯化,纯化后目的蛋白的纯度基本达到98%以上。将纯化后的SA-hI-TAC浓度调至0.1~0.2 mg/mL,用梯度透析对蛋白进行复性,10% SDS-PAGE电泳结果显示,蛋白复性后非还原泳道在相对分子质量100 000~ 140 000处可见清晰条带。Western blotting结果显示,在相对分子质量约为29 000 和120 000~140 000 的地方有明显的蛋白条带(图 2)。
含hI-TAC-SA融合蛋白的包涵体用8 mol/L 尿素溶解后,离心收集上清经Ni-NTA柱纯化,目的蛋白纯度为90%~95%;取Ni-NTA亲和纯化后的目的蛋白,调整其浓度为0.2~0.2 mg/mL,用S-100 凝胶柱进行凝胶过滤层析,经分子筛纯化后,目的蛋白的纯度可达 98%以上(图 3)。将纯化后的hI-TAC-SA浓度调至0.1~ 0.2 mg/mL,用梯度透析对蛋白进行复性,10% SDSPAGE 电泳结果显示,蛋白复性后非还原泳道在相对分子质量约为120 000~140 000 处可见清晰多聚体条带。纯化和复性后的融合蛋白经Western blotting 鉴定,结果显示,在相对分子质量约为29 000和120 000~ 140 000的地方有明显的蛋白条带(图 3)。
2.3 SA/hI-TAC融合蛋白的活性测定 2.3.1 SA/hI-TAC融合蛋白的MB49 细胞表面锚定结果用复性后的hI-TAC-SA和SA-hI-TAC融合蛋白与经生物素处理的MB49肿瘤细胞进行表面锚定结合,并用流式细胞仪(BD FACS Aria)检测锚定情况。结果显示:hI-TAC-SA和SA-hI-TAC融合蛋白均能够高效锚定于生物素化的MB49肿瘤细胞表面,hI-TAC-SA融合蛋白修饰效率高达98.8%,SA-hI-TAC融合蛋白锚定修饰率为91.3%(图 4)。
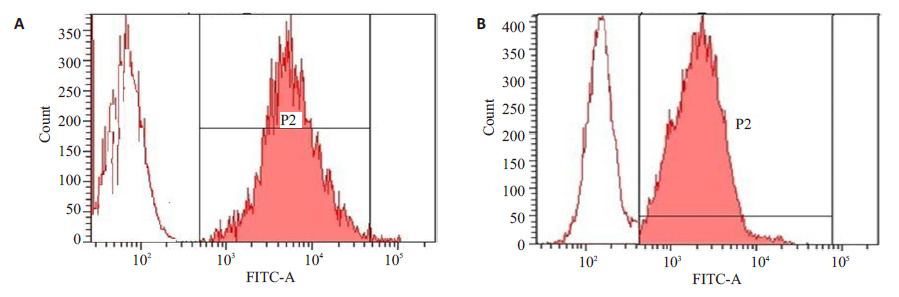
|
图 4 hI -TAC-SA(A)和SA- hI-TAC(B)融合蛋白对生物素化的MB49细胞锚定的流式细胞仪检测 Figure 4 Flow cytometric analysis of hI-TAC-SA (A) and SA-hI-TAC (B) anchored on biotinylated surface of MB49 tumor cells. |
趋化实验结果显示(图 5),与空白对照组相比,hI-TAC-SA 和SA-hI-TAC融合蛋白均对人外周血淋巴细胞可产生趋化效应,且此趋化效应与融合蛋白浓度呈剂量依赖关系。hI-TAC-SA的趋化效应强于IP-10-SA,SA-hI-TAC 的趋化效应弱于IP-10-SA。hI-TAC-SA融合蛋白浓度为40 ng/mL时,其对淋巴细胞的趋化效应最强,趋化指数约为5.1;SA-hI-TAC融合蛋白浓度为4 ng/mL时,其对淋巴细胞的趋化效应最强,趋化指数约为3.1。
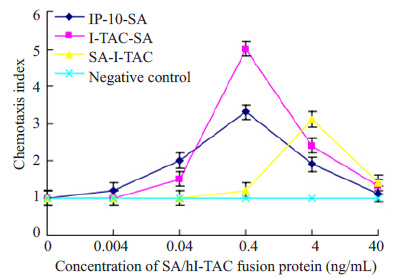
|
图 5 不同浓度的SA/hI-TAC融合蛋白对外周血淋巴细胞的趋化指数 Figure 5 Chemotaxis index of SA/hI-TAC fusion protein in peripheral blood lymphocytes. |
本实验室已经建立了简便快捷、高效、安全的细胞膜表面锚定修饰技术平台,利用该平台制备了一系列链亲和素连接的双功能融合蛋白(sCD40L[10]、GM-CSF[12]、 TNFα[14]、IL-2[15]、IL-4[16]、IL-7[17]、IL-15[18-20]、IL-21[21]、 IL-24[22]等),并且部分蛋白已建立了中试制备工艺,从而为研制新型膜表面修饰的肿瘤细胞疫苗提供了技术平台。本平台制备的双功能蛋白能对肿瘤细胞快速表面修饰,使多种具有免疫协同作用的免疫刺激因子共同迅速持久地锚定在肿瘤细胞的表面,且锚定的量可进行精确控制;而整个锚定修饰过程对细胞、组织和机体无明显的毒副作用。目前,我们已研发出SA-GM-CSF[7, 11, 23]、 SA-hIL-2[8-9]、SA-hTNFα[24]、SA-sCD40L[10]锚定修饰的浅表性膀胱癌原位肿瘤细胞疫苗和GM-CSF/TNFα细胞膜表面双重锚定修饰的前列腺癌治疗性疫苗[25]。研究结果显示:链亲和素连接的细胞因子/免疫刺激分子双功能融合蛋白锚定修饰的浅表性膀胱癌原位肿瘤疫苗可诱导小鼠机体产生有效的抗肿瘤免疫反应,尤其能有效防治浅表性膀胱癌的复发[7-11, 13, 17, 25]。
I-TAC在许多病理和生理过程中发挥着不同的作用。I-TAC通过与肿瘤表面表达的CXCR3和CXCR7 结合,在肿瘤的生长和转移中发挥作用[26]。有研究报道,表达于肿瘤细胞表面的I-TAC和表达于T细胞表面的CXCR3结合,引起特异性CTL向肿瘤细胞的移动,此过程可以通过加入CXCR3或I-TAC抗体,或高浓度的I-TAC阻断,提示I-TAC有治疗三期黑色素瘤的潜在优势[2]。有研究报告,在大鼠模型体内,I-TAC诱导T淋巴母细胞和脾T细胞迁移,肿瘤细胞分泌的I-TAC增强了总CD8+和CD8+CXCR3+T细胞以及巨噬细胞在肿瘤部位的侵润,有抗肿瘤作用[27]。此外,I-TAC对肿瘤的转移同样有抑制作用[28]。因此,I-TAC可能对肿瘤的免疫治疗是有效的。患者可用I-TAC转导的肿瘤细胞疫苗或融合趋化因子的肿瘤相关抗原免疫;另外,也可用具有抗肿瘤抗体/趋化因子融合蛋白治疗,这将吸引淋巴细胞到肿瘤区域[29]。因此,为了能寻找到更有效的肿瘤细胞治疗性疫苗,本文构建了pET24a-SA-hI-TAC 和pET21a-hI-TAC-SA原核表达质粒,为便于融合蛋白的纯化,分别在N端/C 端设计了6 个His 标签;SA 和 hI-TAC之间是富含甘氨酸和丝氨酸的肽链(15肽),有助于融合蛋白中各单元蛋白质分子的独立折叠,从而保留各自的生物活性。I-TAC与受体结合及活化受体的关键部位是N端和N-L00P区[30],当SA与I-TAC的N端链接,即使SA与I-TAC之间为富含甘氨酸和丝氨酸的 15肽,仍对I-TAC蛋白N端的正确折叠和/或与受体结合有一定影响,故SA-hI-TAC的活性弱于hI-TAC-SA; 在CXC趋化因子家族中,I-TAC与CXCR3受体的结合力强于IP-10[31],故IP-10-SA活性弱于hI-TAC-SA。
本研究在大肠杆菌BL21中实现了SA/hI-TAC 融合蛋白的高效表达,制备的SA/hI-TAC融合蛋白具有双重生物学活性,且hI-TAC-SA融合蛋白的锚定修饰率以及趋化效应均强于SA-hI-TAC融合蛋白。本研究为SA/hI-TAC 双功能融合蛋白今后应用于肿瘤局部治疗以及肿瘤疫苗奠定了基础。
| [1] | Wendel M, Galani IE, Suri-Payer E, et al. Natural killer cell accumulation in tumors is dependent on IFN-gamma and CXCR3 ligands[J]. Cancer Res, 2008, 68 (20): 8437-45. DOI: 10.1158/0008-5472.CAN-08-1440. |
| [2] | Ludwig A, Schiemann F, Mentlein R, et al. Dipeptidyl peptidase IV (CD26) on T cells cleaves the CXC chemokine CXCL11 (I-TAC) and abolishes the stimulating but not the desensitizing potential of the chemokine[J]. J Leukoc Biol, 2002, 72 (1): 183-91. |
| [3] | Sauty A, Dziejman M, Taha RA, et al. The T cell-specific CXC chemokines IP-10, Mig, and I-TAC are expressed by activated human bronchial epithelial cells[J]. J Immunol, 1999, 162 (6): 3549-58. |
| [4] | Mohan K, Ding Z, Hanly J, et al. IFN-gamma-inducible T cell alpha chemoattractant is a potent stimulator of normal human blood T lymphocyte transendothelial migration: differential regulation by IFN-gamma and TNF-alpha[J]. J Immunol, 2002, 168 (12): 6420-8. DOI: 10.4049/jimmunol.168.12.6420. |
| [5] | Mullins IM, Slingluff CL, Lee JK, et al. CXC chemokine receptor 3 expression by activated CD8+ T cells is associated with survival in melanoma patients with stage III disease[J]. Cancer Res, 2004, 64 (21): 7697-701. DOI: 10.1158/0008-5472.CAN-04-2059. |
| [6] | Lau TS, Chung TK, Cheung TH, et al. Cancer cell-derived lymphotoxin mediates reciprocal tumour-stromal interactions in human ovarian cancer by inducing CXCL11 in fibroblasts[J]. J Pathol, 2014, 232 (1): 43-56. DOI: 10.1002/path.2014.232.issue-1. |
| [7] | Hu Z, Tan W, Zhang L, et al. A novel immunotherapy for superficial bladder cancer by intravesical immobilization of GM-CSF[J]. J Cell Mol Med, 2010, 14 (6B): 1836-44. |
| [8] | Huang X, Yu HS, Chen Z, et al. A novel immunotherapy for superficial bladder cancer by the immobilization of streptavidintagged bioactive IL-2 on the biotinylated mucosal surface of the bladder wall[J]. Chin J Cancer, 2010, 29 (6): 611-6. DOI: 10.5732/cjc.009.10640. |
| [9] | Zhang X, Shi X, Li J, et al. Novel immunotherapy for metastatic bladder cancer using vaccine of human interleukin-2 surfacemodified MB 49 cells[J]. Urology, 2011, 78 (3): 722.e1-6. DOI: 10.1016/j.urology.2011.04.044. |
| [10] | Zhang Z, Xu X, Zhang X, et al. The therapeutic potential of SA-sCD40L in the orthotopic model of superficial bladder cancer[J]. Acta Oncol, 2011, 50 (7): 1111-8. DOI: 10.3109/0284186X.2010.549838. |
| [11] | Zhang X, Shi X, Li J, et al. A novel therapeutic vaccine of mouse GM-CSF surface modified MB49 cells against metastatic bladder cancer[J]. J Urol, 2012, 187 (3): 1071-9. DOI: 10.1016/j.juro.2011.10.126. |
| [12] | 白莉, 胡志明, 王菲, 等. 链亲和素标记的人粒细胞巨噬细胞-集落刺激因子融合蛋白的制备[J]. 南方医科大学学报, 2012, 32 (10): 1389-93. |
| [13] | Shi X, Zhang X, Li J, et al. Sequential administration of GM-CSF and IL-2 surface-modified MB49 cells vaccines against the metastatic bladder cancer[J]. Urol Oncol, 2013, 31 (6): 883-93. DOI: 10.1016/j.urolonc.2011.08.001. |
| [14] | 徐翠香, 胡志明, 李金龙, 等. SA-TNF-α融合蛋白高效表达、纯化及复性研究[J]. 南方医科大学学报, 2009, 29 (3): 412-5. |
| [15] | 张琳, 胡志明, 法萍萍, 等. SA-hIL2双功能融合蛋白的研制及其生物学鉴定[J]. 中国生物工程杂志, 2009, 29 (7): 12-6. |
| [16] | 张振, 许晓玲, 马磊, 等. 链亲和素标记的白细胞介素4双功能融合蛋白锚定治疗小鼠浅表性膀胱癌[J]. 中华肿瘤杂志, 2012, 34 (5): 331-5. |
| [17] | 张振, 贺利民, 马磊, 等. SA-IL-7融合蛋白的制备及其膀胱内灌注对小鼠表浅性膀胱癌的治疗效应[J]. 中国肿瘤生物治疗杂志, 2013, 20 (5): 529-34. |
| [18] | 苏华, 陈艳丽, 陈素云, 等. SA/hIL-15融合蛋白的制备及生物学活性鉴定[J]. 南方医科大学学报, 2009, 29 (3): 397-401. |
| [19] | 余宏盛, 严耀明, 茅奇峰, 等. hIL-15-SA 双功能融合蛋白的制备[J]. 温州医学院学报, 2010, 40 (4): 326-9. |
| [20] | 陈艳丽, 许晓玲, 唐佳, 等. SA/mlL15双功能融合蛋白的制备及其生物学鉴定[J]. 细胞与分子免疫学杂志, 2010, 26 (2): 107-10. |
| [21] | 法萍萍, 张振, 李金龙, 等. SA/hIL21双功能融合蛋白的表达、纯化及生物学活性检测[J]. 南方医科大学学报, 2010, 30 (6): 1240-3. |
| [22] | 陈惜倩, 高基民. SA/hIL24双功能融合蛋白的制备及其生物学活性的鉴定[J]. 温州医学院学报, 2013, 43 (2): 78-83. |
| [23] | Gao J, Huang S, Li M, et al. GM-CSF- modified mouse B16.F10 melanoma whole cell vaccine[J]. Vaccine, 2006, 24 : 5265-8. DOI: 10.1016/j.vaccine.2006.04.031. |
| [24] | 陈忠, 谭万龙, 黄鑫, 等. SA-hTNF-α膜锚定修饰治疗表浅膀胱癌的实验研究[J]. 南方医科大学学报, 2010, 30 (5): 936-40. |
| [25] | Yin W, He Q, Hu Z, et al. A novel therapeutic vaccine of GM-CSF/ TNFα surface-modified RM-1 cells against the orthotopic prostate cancer[J]. Vaccine, 2010, 28 : 4946-53. |
| [26] | Miekus K, Jarocha D, Trzyna E, et al. Role of I-TAC-binding receptors CXCR3 and CXCR7 in proliferation, activation of intracellular signaling pathways and migration of various tumor cell lines[J]. Folia Histochem Cytobiol, 2010, 48 (1): 104-11. |
| [27] | Hensbergen PJ, Wijnands PG, Schreurs MW, et al. The CXCR3 targeting chemokine CXCL11 has potent antitumor activity in vivo involving attraction of CD8+ T lymphocytes but not inhibition of angiogenesis[J]. J Immunother, 2005, 28 (4): 343-51. DOI: 10.1097/01.cji.0000165355.26795.27. |
| [28] | Chu Y, Yang X, Xu W, et al. In situ expression of IFN-gammainducible T cell alpha chemoattractant in breast cancer mounts an enhanced specific anti-tumor immunity which leads to tumor regression[J]. Cancer Immunol Immunother, 2007, 56 (10): 1539-49. DOI: 10.1007/s00262-007-0296-1. |
| [29] | Berencsi K, Meropol NJ, Hoffman JP, et al. Colon carcinoma cells induce CXCL11-dependent migration of CXCR3-expressing cytotoxic T lymphocytes in organotypic culture[J]. Cancer Immunol Immunother, 2007, 56 (3): 359-70. |
| [30] | Booth V, Clark-Lewis I, Sykes BD. NMR structure of CXCR3 binding chemokine CXCL11 (ITAC)[J]. Protein Sci, 2004, 13 (8): 2022-8. DOI: 10.1110/(ISSN)1469-896X. |
| [31] | Cole KE, Strick CA, Paradis TJ, et al. Interferon-inducible T cell alpha chemoattractant (I-TAC): a novel non-ELR CXC chemokine with potent activity on activated T cells through selective high affinity binding to CXCR3[J]. J Exp Med, 1998, 187 (12): 2009-21. DOI: 10.1084/jem.187.12.2009. |
 2015, Vol. 35
2015, Vol. 35

