2. 四川农业大学资源学院微生物学,四川 成都 611130
2. Department of Microbiology, College of Resources, Sichuan Agriculture University, Chengdu 611130, China
口腔是人体内微生物最多、最丰富的生境之一。 2007 年启动的人类微生物组计划(human microbiome project,HMP)旨在绘制包括口腔在内的人体几大部位微生物组图谱,以解析微生物菌群结构变化对人类健康的影响[1]。由此可见解析口腔基本微生物谱及菌群结构建立基础细菌数据库的重要性。我们之前的测序研究数据表明[2],奈瑟菌属、棒状杆菌属、纤毛菌属、链球菌属、普雷沃菌属、韦荣菌属、梭杆菌属、二氧化碳嗜纤维菌属、放线菌属、嗜血杆菌属等在健康人的菌斑中具有更高的细菌丰度。那么,可培养的口腔细菌组成结构及检出率是否与之吻合呢?其中的高丰度厌氧菌在几十年来已有了较深入和全面的研究,集中在某一种厌氧菌[3] 或某一种疾病中的厌氧菌[4]的分离培养谱的确定。厌氧菌的致病作用已得到深入和广泛的研究,尤其是厌氧菌快速检测的自动化问题已引起世界各国学者的广泛重视,而需氧菌及兼性厌氧菌扮演了怎样的角色,却较少有研究涉及[5],也尚未有人系统建立国人口腔需氧或兼性厌氧菌的基本组成谱数据库。随着分子系统生物学的发展,应用16s rRNA结合形态学、生理生化指标、 生物系统分类学的多相分类,已逐渐成为微生物分类鉴定的一种有力手段,是鉴定细菌种类和发现新种的基础[6]。本研究对口腔中的需氧菌及兼性厌氧菌做了全面的分离鉴定,并对不同鉴定方法进行对比,建立口腔需氧与兼性厌氧菌的基础数据库,为今后研究口腔需氧菌及兼性厌氧菌在健康与疾病中的作用以及同厌氧菌的相互关系提供依据。
1 材料和方法 1.1 材料 1.1.1 样本收集唾液标本:收取26 名志愿者唾液标本。样本采集时间集中在两餐之间(上午10:00至下午 16:00),采集前让受检者用温开水轻轻漱去口中的食物残渣,采集受检人的非刺激性唾液2 mL。
菌斑样本收集:采集26名志愿者中有菌斑者的菌斑样本。采集时间集中在两餐之间(上午10:00至下午 16:00),采集前让受检者用温开水轻轻漱去口中的食物残渣,在棉卷隔湿下用龈上刮治器刮取其龈上菌斑,立即置于含1 mL无菌PBS 转运液的EP 管中。刮净龈上菌斑,吹干牙面,再刮取龈下菌斑。
根尖肉芽样本收集:手术切取26名志愿者中1名慢性根尖周炎患者根尖肉芽样本,装于含1 mL无菌PBS 转运液的EP管中立即送检。
1.1.2 试剂和仪器GP/GN/NH/ANC生化鉴定卡(生物梅里埃公司,法国),细菌基因组DNA 提取试剂盒 (TIANGEN),PCR扩增试剂盒(TIANGEN);VITEK全自动微生物鉴定及药敏分析仪(生物梅里埃公司,法国),扫描电镜(InspectF FEI,荷兰),体视显微镜(Leica EZ4HD)。
1.2 实验方法 1.2.1 细菌的分离培养采用10倍连续梯度稀释法,用 PBS对样本进行稀释,稀释度为104~106 CFU/mL,进行无菌操作涂布于胰蛋白胨大豆琼脂(TSB,OXOID公司)血平板,放入37 ℃兼性厌氧环境或需氧中培养24~ 48 h。挑取大小、形态、颜色、质地等不同的菌落转种于另一培养板,进行连续传代培养直至经革兰染色确定分离出纯种细菌。
1.2.2 细菌形态学鉴定菌落形态观察:观察TSB血平板中菌落外形、颜色、透明度、光泽、凸度、硬度、边缘、溶血情况,记录,并用体视显微镜拍照。
革兰染色观察:采用革兰染色法观察细菌的形状、 排列、染色性,记录,并用显微镜拍照。
扫描电镜观察:直接用小块盖玻片印取菌落,放入 2.5%戊二醛中固定2 h(4 ℃冰箱),再用磷酸盐缓冲液清洗2次,用不同梯度的乙醇脱水,脱水后再放入100%乙酸正戊酯溶液中置换处理20 min。在二氧化碳临界点干燥机中进行二氧化碳临界点干燥。用离子溅射仪喷金。扫描观察样品,并保存图像。
1.2.3 细菌鉴定仪的生化反应鉴定根据菌种的初步鉴定特征选择鉴定卡片(GN/GP/NH/ANC等),并根据说明书要求将培养了18~24 h的培养物用生理盐水配制成一定浊度的菌悬液,利用梅里埃全自动细菌鉴定仪中进行鉴定。待鉴定完毕后,读取鉴定结果。
1.2.4 16s rRNA基因测序鉴定挑取适量菌苔,按照细菌DNA提取试剂盒说明书的步骤提取细菌DNA。以所提取的细菌DNA为模版,用通用引物27F和1492R 扩增16s rRNA基因序列,1%琼脂糖凝胶电泳检测PCR 产物条带约为1.5 kb,送PCR产物至上海生工进行测序。将测序所得的拼接序列与HOMD(human oral microbiome database)数据库和EzTaxon 数据库 (EzTaxon server 2.1)中的国际标准模式菌株进行 BLAST序列比对,根据进化树获得亲缘关系最近、相似度最高的菌种名称。
1.2.5 菌种冻干保藏将纯培养的菌种固体培养物用棉签刮于装有脱脂牛奶的玻璃菌种管中,混匀后进行冻干保种。将制备好的牛奶管置于-20 ℃冰箱进行长期保存。
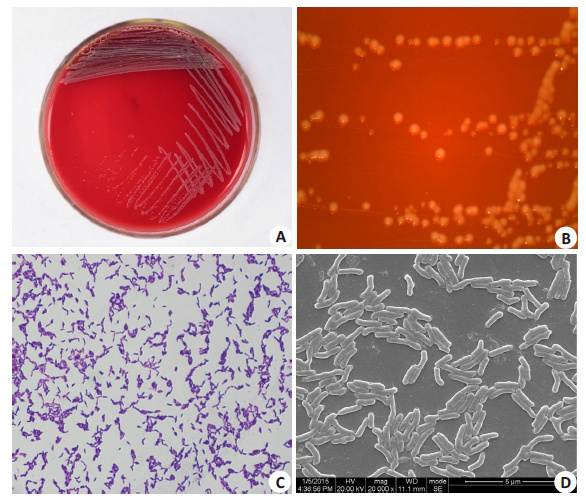
2 结果 2.1 菌落细胞形态鉴定以自编菌种号COCC19天空罗斯菌(Rothia aeria) 为例,平板上的菌落表面光滑,乳白色,有光泽(图 1A、B),革兰染色示该菌为革兰染色阳性,具有不规则的、膨大的棒状末端,排列成V、T、Y等形状(图 1C),扫描电镜示菌体为中等长短的杆菌,略弯(图 1D)。
|
图 1 天空罗斯菌的菌落菌细胞形态 Figure 1 Morphological observation of isolated Rothia aeria. A: Plate culture; B: Stereoscopic microscope; C: Gram staining; D: Scanning electron microscopy. |
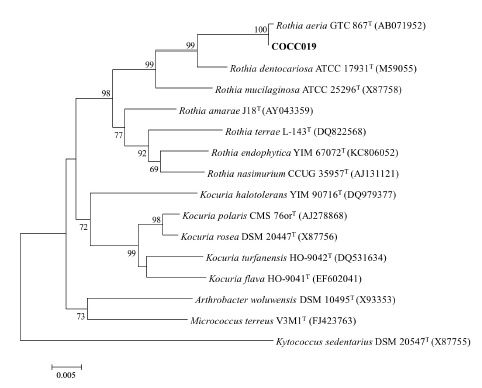
共分离鉴定出可培养口腔菌种共175株,包含7株真菌。菌株分属于10多个不同的菌属,63个菌种。鉴定方法同时采用16s rRNA基因测序鉴定和梅里埃生化鉴定仪鉴定,对于同时使用2种鉴定方法的菌株检测出二者的符合度仅为22.39%,不符合的菌株结合形态学特征最后以基因测序为准。所有分离菌株序列均分别与HOMD数据库和EzTaxon数据库中的国际标准株进行BLAST序列比对,根据进化树亲缘关系远近进行鉴定。以菌种COCC019为例,如图 2所示,经比对确定该菌为天空罗斯菌。
|
图 2 基于COCC19及相邻的微球菌科16S rRNA基因序列的邻接系统进化树 Figure 2 Phylogenetic tree of 16S rRNA gene sequence of COCC19 and the neighboring micrococcus. |
本次试验从口腔中分离鉴定出常见的需氧及兼性厌氧菌,如链球菌、放线菌、葡萄球菌及梭杆菌等,也分离出少见的或近年来新发现的细菌,如毗邻颗粒链菌、 鲍曼不动杆菌、嗜麦芽寡养单胞菌、苏黎世链球菌及似肺炎克雷伯菌等(表 1)。结果显示,口腔中种类和检出率最高的为链球菌属,占到了46.55%,其次是放线菌属 (14.85%)和葡萄菌属(10.28%)。高检出率菌种为咽峡炎链球菌(9.71%)、口腔放线菌(8.57%)、变异链球菌 (6.86%)、缓症链球菌(6.86%)。这些细菌均为革兰阳性菌。
| 表 1 口腔需氧及兼性厌氧菌分离鉴定结果 Table 1 Isolation and identification of aerobic and facultative anaerobic microorganism |
根据我们的分离结果,回顾了在International Journal of Systematic and Evolutionary Microbiology 上2010 年后分离的新菌种,发现有些菌种是第1次分离自口腔,如桑肠杆菌(Enterobacter mori)、密歇根克雷伯菌 (Klebsiella michiganensis)、香坊肠杆菌 (Enterobacter xiangfangensis)等(表 2)。
| 表 2 首次分离自口腔的新菌种 Table 2 Bacterial species isolated for the first time from the oral cavity |
口腔微生物与人类口腔的健康和全身健康有紧密联系。探究口腔细菌种类及其与健康和疾病的关联是非常有必要的。对于样本选取,本实验不单采集唾液样本,还采集了牙菌斑样本(包括龈上菌斑,龈下菌斑)、黏膜样本等,通过增加取样部位,全面分离鉴定口腔内的需氧和兼性厌氧细菌种类,且样本采集对象年龄分布包括新生儿、 幼儿、青少年、中年人和老年人等多个年龄层面。我们发现在口腔健康和疾病人群中链球菌、葡萄球菌、放线菌、梭杆菌等的种类较多,均为正常成年人口腔内的优势菌群。口腔放线菌是口腔生物膜内常见的细菌之一,研究认为,它在龋病的发病机理中扮演着重要的角色,还可侵及牙根面及牙周组织,并在口外感染中也有分离得到 [13]。此外,我们也分离得到了口腔少见菌种,如玫瑰色库克菌、毗邻颗粒链菌、鲍曼不动杆菌、马赛根瘤菌等。 以及近年来新发现的菌种,如桑肠杆菌、苏黎世链球菌、 似肺炎克雷伯菌、香坊肠杆菌等,丰富对国人口腔微生物的认识。
分离到的少见细菌多为条件致病菌,在口腔生态失衡及自身免疫失衡时会诱发疾病。天空罗斯菌是1997 年从俄罗斯空间站中的空气和冷凝水样品中首次被分离出来[14],并且被确定为新生儿败血症的致病菌[15],后来在急性支气管炎和急性心内膜炎患者中分离得到[16],而我们首次分离自24岁、26岁、27岁3名女性健康人的唾液。苏黎世链球菌(Streptococcus tigurinus)在2012年首次被报道。该种细菌可产生α-溶血环,形成直径为 0.5~1 mm的光滑灰色或白色菌落。苏黎世链球菌可导致严重的炎症,主要寄居在人类口腔,一旦进入血液,则会导致侵袭性感染,如感染性心内膜炎、骨髓炎、关节炎、脑膜炎等[7]。我们首次从健康人及猛性龋患者口腔中分离到该菌。近年来发现,假肺炎链球菌主要与下呼吸道感染有关,多见于慢性阻塞性肺疾病患者。研究还推测假肺炎链球菌还可导致草绿色链球菌的耐药性增加[17]。咽峡炎链球菌属于人类口腔正常菌群,但有时会导致严重的侵袭性感染,主要与口腔感染有关,个人的易感性在感染过程中起到了关键作用。有研究发现,咽峡炎链球菌在接受根管治疗的病人的根管中检出率较高,且可产生大量细胞外蛋白,其很可能是根管治疗后发生根尖周炎的病原菌之一[18],还可导致严重的肺炎,甚至脑脓肿,但较罕见[19-20]。猛性龋是儿童常见口腔疾病之一,对儿童健康可造成严重损害。许多研究发现,在猛性龋患者中,变异链球菌的含量无论在龋损部位或是在相对健康的部位都显著高于普通龋病患者或正常人,提示了变异链球菌成为优势菌与猛性龋的发生密切相关[21-22]。我们的研究还显示,青年人的微生物种类最丰富,中年人次之,而老年人和婴幼儿较少,这可能与牙齿的萌出与缺失、口腔环境的改变等有关。
本次菌种鉴定从细菌的表性特征、生理生化特性、 分子水平等多方面进行分析鉴定,并记录其重要的表型特征。通过基因测序鉴定和全自动生化仪鉴定方法的比较发现,许多微生物表型的相似往往导致分类的困难。并且,梅里埃鉴定仪数据库中仅含30余种口腔细菌,而目前认为口腔细菌有成百上千种。遇到这种情况,我们进一步进行了DNA测序鉴定,并发现测序鉴定结果和菌落菌细胞形态特征更吻合,可作为最终确定菌种的准绳。比如,在使用梅里埃生化鉴定系统鉴定出菌株为少动鞘氨醇单胞菌,生化鉴定可信度为97%,然而用16s rRNA基因测序鉴定结果为中间链球菌,分子鉴定可信度为99.18%。此外,梅里埃生化鉴定系统价格昂贵,而全长16s rRNA基因测序成本较低,具有可重复性,并且基因型与微生物功能、致病性等密切相关[23-24]。
对于口腔需氧及兼性厌氧菌的研究有待进一步深入。本次试验从较小人群范围内建立了口腔可培养微生物的系统收集、分离鉴定的方法,可为口腔微生物资源的研究提供基础而随着微生物培养和分离鉴定技术的继续革新,以及人群样本的不断扩大,相信将会有更多种类的口腔微生物被发现,更多的致病机制被揭晓。
| [1] | NIH HMP Working Group, Peterson J, Garges S, et al. The NIH human microbiome project[J]. Genome Res, 2009, 19 (12): 2317-23. DOI: 10.1101/gr.096651.109. |
| [2] | Li Y, He J, He Z, et al. Phylogenetic and functional gene structure shifts of the oral microbiomes in periodontitis patients[J]. ISME J, 2014, 8 (9): 1879-91. DOI: 10.1038/ismej.2014.28. |
| [3] | 薛毅, 许丽华, 史俊南, 等. 牙龈卟啉杆菌的分离培养与鉴定[J]. 中国微生态学杂志, 1994, 1 (1): 38-41. |
| [4] | 陈莉丽, 唐琪, 吴燕岷, 等. 成人牙周炎龈下厌氧菌分离鉴定及药敏试验结果分析[J]. 微生物学杂志, 2001, 4 (4): 39-40. |
| [5] | Lam OL, Mcgrath C, Li LS. Effectiveness of oral hygiene interventions against oral and oropharyngeal reservoirs of aerobic and facultatively anaerobic gram-negative bacilli[J]. Am J Infect Control, 2012, 40 (2): 175-82. DOI: 10.1016/j.ajic.2011.03.004. |
| [6] | Dewhirst FE, Klein EA, Bennett ML, et al. The feline oral microbiome: a provisional 16S rRNA gene based taxonomy with full-length reference sequences[J]. Vet Microbiol, 2015, 175 (2/4): 294-303. |
| [7] | Zhu B, Lou MM, Xie GL, et al. Enterobacter mori sp. nov., associated with bacterial wilt on Morus alba L[J]. Int J Syst Evol Microbiol, 2011, 61 (Pt 11): 2769-74. |
| [8] | Zbinden A, Mueller NJ, Tarr PE, et al. Streptococcus tigurinus, a novel member of the Streptococcus mitis group, causes invasive infections[J]. J Clin Microbiol, 2012, 50 (9): 2969-73. DOI: 10.1128/JCM.00849-12. |
| [9] | Saha R, Farrance CE, Verghese B, et al. Klebsiella michiganensis sp. nov., a new bacterium isolated from a tooth brush holder[J]. Curr Microbiol, 2013, 66 (1): 72-8. DOI: 10.1007/s00284-012-0245-x. |
| [10] | Brisse S, Passet V, Grimont P A. Description of Klebsiella quasipneumoniae sp nov., isolated from human infections, with two subspecies, klebsiella quasipneumoniae subsp quasipneumoniae subsp nov and klebsiella quasipneumoniae subsp similipneumoniae subsp nov., and demonstration that klebsiella singaporensis is a Junior heterotypic synonym of klebsiella variicola[J]. Int J Syst Evol Microbiol, 2014, 64 (Pt 9): 3146-52. DOI: 10.1099/ijs.0.062737-0. |
| [11] | Gu CT, Li CY, Yang LJ, et al. Enterobacter xiangfangensis sp. nov., isolated from Chinese traditional sourdough, and reclassification of Enterobacter sacchari Zhu et al. 2013 as Kosakonia sacchari comb. nov[J]. Int J Syst Evol Microbiol, 2014, 64 (Pt 8): 2650-6. DOI: 10.1099/ijs.0.064709-0. |
| [12] | Camelo-Castillo A, Benítez-Páez A, Belda-Ferre P, et al. Streptococcus dentisani sp. nov., a novel member of the mitis group[J]. Int J Syst Evol Microbiol, 2014, 64 (Pt 1): 60-5. DOI: 10.1099/ijs.0.054098-0. |
| [13] | Henssge U, Do T, Radford DR, et al. Emended description of Actinomyces naeslundii and descriptions of Actinomyces oris sp. nov. and Actinomyces johnsonii sp. nov., previously identified as Actinomyces naeslundii genospecies 1, 2 and WVA 963[J]. Int J Syst Evol Microbiol, 2009, 59 (Pt 3): 509-16. |
| [14] | Li Y, Kawamura Y, Fujiwara N, et al. Rothia aeria sp. nov., Rhodococcus baikonurensis sp. nov. and Arthrobacter russicus sp. nov., isolated from air in the Russian space laboratory Mir[J]. Int J Syst Evol Microbiol, 2004, 54 (Pt 3): 827-35. |
| [15] | Monju A, Shimizu N, Yamamoto M, et al. First case report of sepsis due to Rothia aeria in a neonate[J]. J Clin Microbiol, 2009, 47 (5): 1605-6. DOI: 10.1128/JCM.02337-08. |
| [16] | Michon J, Jeulin D, Lang JM, et al. Rothia aeria acute bronchitis: the first reported case[J]. Infection, 2010, 38 (4): 335-7. DOI: 10.1007/s15010-010-0012-5. |
| [17] | Shahinas D, Thornton CS, Tamber GS, et al. Comparative genomic analyses of Streptococcus pseudopneumoniae provide insight into virulence and commensalism dynamics[J]. PLoS One, 2013, 8 (6): e65670. DOI: 10.1371/journal.pone.0065670. |
| [18] | Chávez De Paz L, Svenséter G, Dahlén G, et al. Streptococci from root canals in teeth with apical periodontitis receiving endodontic treatment[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2005, 100 (2): 232-41. DOI: 10.1016/j.tripleo.2004.10.008. |
| [19] | Giuliano S, Simone G, Rubini G, et al. Streptococcus anginosus group disseminated infection: case report and review of literature[J]. Infez Med, 2012, 20 (3): 145-54. |
| [20] | Al-Saffar F, Torres-Miranda D, Ibrahim S, et al. How an opportunistic infection can mess with Your brain and take Your breath away: a rare case of simultaneous lung and brain abscess due to streptococcus anginosus[J]. Case Rep Infect Dis, 2015 (2015): 1-3. |
| [21] | 刘艳玲, 刘正, 冯希平, 等. 幼儿猛性龋病原菌的分离鉴定[J]. 华西口腔医学杂志, 2001, 19 (4): 219-21. |
| [22] | 胡丹阳, 崔伟, 罗燕萍, 等. 高龋学龄前儿童变形链球菌的水平传播方式[J]. 南方医科大学学报, 2014 (5): 636-40. |
| [23] | Lasken RS, Mclean JS. Recent advances in genomic DNA sequencing of microbial species from single cells[J]. Nat Rev Genet, 2014, 15 (9): 577-84. |
| [24] | 盛华芳, 周宏伟. 微生物组学大数据分析方法、挑战与机遇[J]. 南方医科大学学报, 2015 (7): 1-4. |
 2015, Vol. 35
2015, Vol. 35

