2. 蚌埠医学院第一附属医院 肿瘤内科,安徽 蚌埠 233004
2. Department of Medical Oncology, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
慢性炎症是引起肝脏肿瘤的重要诱因,尤其与肝细胞癌(HCC)关系密切[1]。HCC通常发生在慢性肝损伤的基础上,如病毒性肝炎和酒精性肝炎,这些慢性炎症反应是肝脏损伤修复的重要机制。但多种炎性反应在发挥肝脏修复等作用的同时,也导致了一系列副作用的产生,包括肝纤维化甚至肝硬化,促进肿瘤生长及转移等。在此过程中,由炎性细胞因子介导的异常信号转导发挥重要作用。髓样细胞触发受体-1(TREM-1)是一种免疫球蛋白超家族激活型受体,在炎症反应发生、级联放大中具有重要作用[2-3],可影响肿瘤微环境中多种相关细胞因子水平,通过损伤、抑制修复等机制参与肿瘤发生发展等病理过程[4-6]。目前,关于TREM-1的研究多集中于炎性疾病和天然免疫[7-9],而在肿瘤领域的研究较少,尤其是在HCC发生发展中的作用尚不清楚。本研究首先通过免疫组化法检测TREM-1在人HCC及非癌肝组织(NCL)(包括正常肝、慢性肝炎、肝硬化组织)中的表达及定位,分析其与HCC临床病理因素的相关性,并进一步在体外使用同种族来源的人正常肝细胞LO2 和肝癌细胞SMMC-7721证实组织学结果,以此探讨该因子在HCC发生发展过程中的作用。
1 材料与方法 1.1 标本来源收集本院2008年1月~2013年12月存档的手术切除经病理学证实的HCC标本76例,患者术前均未进行任何治疗,且有完整临床资料,按Edmondson分级标准 Ⅰ~Ⅱ级48例,Ⅲ~Ⅳ级28例,其中男性61例,女性15 例;年龄22~76岁,中位年龄50岁。收集肝硬化穿刺标本33例,其中男性23例,女性10例;年龄20~77岁,中位年龄47岁。肝炎穿刺标本30例,其中男性21例,女性9 例;年龄18~49岁,中位年龄33.5岁。使用外伤性肝切除或意外死亡(生前体健)的成人肝脏标本20例作为正常对照,其中男性11例,女性9例;年龄21~73岁,中位年龄54.5岁。
1.2 主要试剂羊抗人TREM-1(1∶200)多克隆抗体购于美国 R&D公司;SP试剂盒EliVisionTM plus KIT-9719(A、B) 购自福州迈新生物技术开发公司;DMEM干粉、胎牛血清(FBS)及胰蛋白酶(typsin)购于Gibco公司;Trizol为 Invitrogen 公司产品;逆转录试剂盒及PCR 所用酶、 buffer、dNTP等均购于Promega公司;BSA蛋白定量试剂盒及丙烯酰胺/甲叉双丙烯酰胺均为Bio-rad 公司产品;ECL-plus化学发光试剂盒购自Millipore公司。其它常用试剂均为国产分析纯级。
1.3 实验方法 1.3.1 免疫组化标本均经10%中性甲醛溶液固定,常规石蜡包埋。病理切片厚度4 μm,每个样本连续切片2 张,分别用于HE染色和免疫组织化学染色。159例石蜡切片脱蜡水化,用柠檬酸缓冲液(pH 6.0)电炉上加热进行抗原修复,然后进行免疫组化法Elivision法染色。 具体步骤严格按照试剂盒说明书进行。用PBS代替一抗作为阴性对照。光学显微镜下观察阳性染色及细胞定位,并拍照。结果判断标准:TREM-1阳性定位于细胞质或细胞核。细胞内出现清晰的黄褐色至棕黄色颗粒者为阳性表达。阴性为细胞核和细胞质均不染色。
1.3.2 细胞培养人正常肝细胞株LO2购自南京凯基生物科技发展有限公司(KeyGEN BioTECH);人肝癌细胞株SMMC-7721 购自中国科学院上海细胞库 (Chinese Type Culture Collection)。细胞培养于含 10%胎牛血清和1%青链霉素的DMEM培养液中,并置于37 ℃、含5% CO2及饱和湿度的细胞培养箱中培养。 取对数生长期细胞进行实验。
1.3.3 RT-PCR 法检测TREM-1 mRNA 表达应用 Trizol试剂提取LO2和SMMC-7721细胞总RNA,核酸蛋白分析仪检测含量。1.0 μg总RNA按逆转录试剂盒说明逆转录为cDNA。人TREM-1引物序列为5'-ATT CCCATCCAGTCCAAGTG-3'(上游),5'-AACAGCAT GTGAGGCTCCTT-3'(下游),产物长度为151 bp;人 β-actin 为内参照,引物序列为5'-TCCTCCTGAGCG CAAGTACTC-3'(上游),5'-GCATTTGCGGTGGAC GAT-3'(下游),产物长度为130 bp。PCR反应总体积为 20 μL,反应条件为:94 ℃预变性3 min;循环参数:94 ℃ 变性45 s,55℃退火45 s,72 ℃延伸45 s,共30个循环; 最后72 ℃延伸10 min。取10 μL PCR扩增产物,进行 1.5%琼脂糖凝胶(含0.5 μg/ mL溴乙锭)电泳,凝胶成像系统照相并分析。
1.3.4 Western blotting法检测TREM-1蛋白表达收集 LO2和SMMC-7721细胞,冰上裂解,12 000 r/min 4 ℃ 离心30 min,取上清。制作蛋白标准曲线后测定样品蛋白实际浓度。每孔取10 μg 蛋白上样、SDS-PAGE电泳。电泳完毕后电转印至PVDF膜上。用封闭液在室温摇床上封闭2 h,加入TREM-1一抗(1∶2000),置4 ℃冰箱过夜。PBS洗3次×15 min,加入HRP标记的小鼠抗羊二抗(1∶5000),置37 ℃温箱2 h后洗膜,用化学发光检测试剂盒(ECL)化学发光显影。β-actin作为内参对照。
1.4 统计学方法采用SPSS 17.0统计软件对计数资料进行统计,各组间样本率差异的比较视数据类型采用χ2检验和Fisher 精确检验。计量资料用均数±标准误表示,差异分析采用t Test 进行检验,P<0.05认为差异有统计学意义。
2 结果 2.1 TREM-1在人HCC及非癌肝组织中的表达免疫组化结果显示TREM-1阳性颗粒可见定位于细胞核和细胞质(图 1)。正常肝组织中表达阴性(图 1A),其他3组均有阳性表达(图 1B~D),但阳性表达率较为一致,在肝炎、肝硬化及HCC组分别为20.00%(6/ 30)、24.24%(8/33)和21.05%(16/76),3组间比较无明显统计学差异(P>0.05,表 1)。
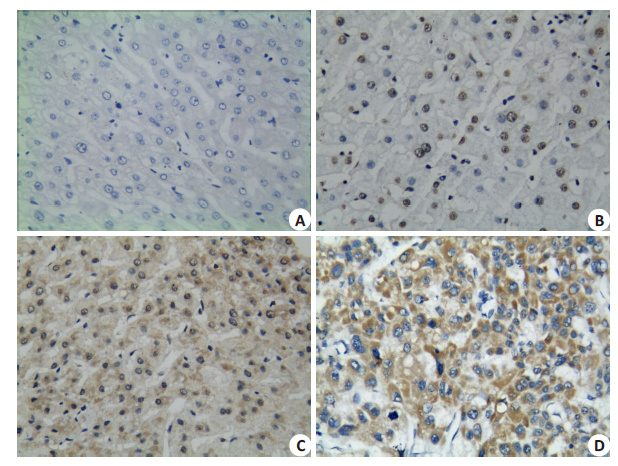
|
图 1 TREM-1在肝癌与非癌肝组织中的表达 Figure 1 Immunohistochemical staining for TREM-1 in HCC and NCL tissues (Original magnification: ×400). A: Normal liver; B: Hepatitis; C: Cirrhosis; D: HCC. |
| 表 1 肝癌及非癌肝组织中TREM-1蛋白的表达 Table 1 TREM-1 expression in human HCC and NCL tissues |
在非癌肝组织中,阳性表达的TREM-1在肝炎组定位于细胞核,在肝硬化组多数定位于细胞核,少数定位于细胞质,有2例可见同时有细胞核和细胞质共表达,而在HCC组阳性颗粒只位于细胞质,未见细胞核着色。即随着正常肝细胞至HCC的演变进程,TREM-1 发生明显的细胞核向细胞质定位改变,差异有统计学意义(P<0.05,表 2)。
| 表 2 肝癌及非癌肝组织中TREM-1蛋白的定位 Table 2 TREM-1 localization in human HCC and NCL tissues |
HCC组织中TREM-1蛋白表达与患者年龄、性别、 肿瘤大小、TNM分期、肝病背景、淋巴结转移及脉管癌栓均无关(均P>0.05),而与组织学分级有关(χ2=5.161,P=0.039,表 3)。组织学分级越高,TREM-1蛋白阳性表达率越低,二者呈负相关(r=-0.261,P=0.023)。
| 表 3 TREM-1蛋白的表达与HCC临床病理特征的关系 Table 3 Relationship between TREM-1 expression and clinicopathological parameters of HCC |
RT-PCR 联合Western blotting 法检测结果显示,LO2 细胞有部分TREM-1 mRNA 及蛋白表达,而在 SMMC-7721 肝癌细胞中,两者的表达水平显著上调,上调率分别为110%和53%(图 2)。
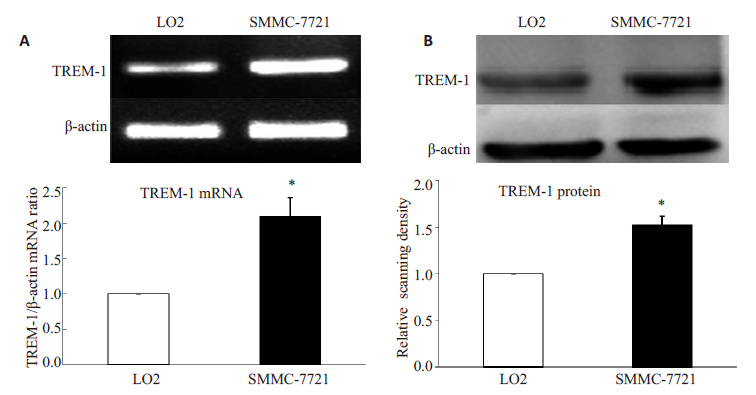
|
图 2 TREM-1在人正常肝细胞LO2和肝癌细胞SMMC-7721中的表达 Figure 2 Expression of TREM-1 in human normal hepatic LO2 and hepatoma SMMC-7721 cell lines. A: RT-PCR; B: Western blotting; *P<0.05 vs LO2 group. |
TREM-1是一种相对分子质量约为30 000的跨膜糖蛋白,属于免疫球蛋白家族成员,可分为可溶性 TREM-1(sTREM-1)和分布于细胞表面的胞膜型 TREM-1两种形式。胞膜型TREM-1包括Ig类似物的胞外区、跨膜区和基因信号序列的胞质尾区[10]。最初的研究认为TREM-1主要表达在单核/巨噬细胞和中性粒细胞表面,通过与细胞外受体蛋白DAP-12 结合,促使磷脂酰肌醇-3 激酶(PI3K)、Akt、细胞外调节蛋白激酶 (ERK)等的磷酸化,激活下游信号转导通路,引起多种炎症介质和因子的分泌,预激和级联放大炎症反应而参与多种感染性疾病的发生[2, 9]。随后的研究显示 TREM-1 在急性内毒素血症小鼠的肝脏内皮细胞[11]、 HCC激活的肝星状细胞[12]以及肝Kupffer细胞[7]均有表达。在肺癌和HCC等恶性肿瘤,已经证实肿瘤微环境中的髓样细胞上TREM-1的表达与癌细胞存在交互对话[7-8, 12]。这些结果提示TREM-1的表达可能不局限于髓样细胞,可能与肿瘤也有着密切的关系。鉴于既往的研究多集中在巨噬细胞/成纤维细胞上TREM-1的表达与肿瘤的相关性,对于癌细胞上是否表达TREM-1及其与肿瘤的关系如何关注较少。本研究以肝脏疾病为切入点,观察TREM-1在正常肝细胞和HCC细胞自身的表达情况,并首次探讨其与HCC发生发展之间的关系。
免疫组化结果发现TREM-1在正常肝组织中无表达,而在肝炎、肝硬化、HCC组织中的表达显著上调,但阳性表达率在该3组间较一致。体外细胞学实验也证实较人正常肝细胞LO2 相比,SMMC-7721 肝癌细胞 TREM-1的表达水平明显上升。本实验中细胞学和组织学标本均来源于亚洲人种,但正常肝细胞LO2上有部分TREM-1的表达,而在正常肝组织中却未见TREM-1 的表达,我们推测可能与细胞体外建系的过程中伴随的改变有关,实验技术和样本量较小的原因也不能除外。既往涉及到HCC癌细胞与TREM-1 表达的2 篇文献[12-13]均表明HCC细胞系上有TREM-1表达并且在HCC组织学标本上得到证实。如Liao等[12]发现在 HBV感染相关性HCC组织中TREM-1 有部分定位于癌细胞胞质中,Duan等[13]进一步对HCC癌细胞上表达的TREM-1进行功能学研究,发现肝癌细胞MHCC97L 和PLC细胞高表达TREM-1,TREM-1 在HCC中的过表达能够显著促进癌细胞的增殖、侵袭及抗凋亡作用,而抑制其表达会减弱此种现象。我们的研究结果与既往的这些报道一致。我们推测这可能源于静息状态下正常肝细胞不表达或少量表达TREM-1,而当细胞受到炎症刺激因素或致癌因子作用下,肝细胞大量启动 TREM-1表达并在肝炎至HCC进展过程中发挥重要作用。由此可见,作为炎症级联放大因子,TREM-1的过表达在HCC发生过程中可能扮演着促肿瘤生成的作用。其他证据还包括在早期的促肿瘤形成过程中,TREM-1的表达缺失可降低二乙基亚硝胺(DEN)诱导的肝脏损害和纤维化增生[14]。流行病学研究已经发现可以通过抑制癌前病变或肿瘤易感者体内慢性炎症反应,来达到降低患者罹患肿瘤及复发的目的[15]。如在结肠的炎症和肿瘤中,TREM-1的抑制剂LP17可阻断肠粘膜上皮TREM-1的表达,显著降低炎症反应和肿瘤的发生发展[16],因而TREM-1的抑制剂可被作为一种辅助抗肿瘤手段。结合本研究发现,我们推测TREM-1过表达可能是HCC发生发展过程中的一个重要生物学事件,抑制TREM-1的表达可能为HCC的治疗提供新靶点。
本研究中还有一个重要的发现是,TREM-1 在肝炎、肝硬化、HCC组织中的定位发生着从胞核到胞质的显著改变,在非癌肝组织中,阳性表达的TREM-1大多位于细胞核,少数定位于细胞质,而HCC组阳性颗粒均位于细胞质,未见细胞核着色。目前导致这种变化的原因不明。我们推测可能与HCC癌变过程中TREM-1定位改变的需要有关。因为TREM-1的活化需要其自身天然配体和Toll样受体TLR的协同作用[17-18]。天然配体可能存在于血清中[19]或血小板的表面[20]。而TLR配体中细菌脂多糖的作用最强[4]。脂多糖通过与脂多糖结合蛋白(LBP)结合转运到细胞膜上,募集TLR4等脂多糖受体分子启动脂多糖信号转导通路,最终引起炎症反应的扩大[21]。结合本实验结果,我们推测在炎症的早期阶段,细胞核表达的TREM-1和TLR4等配体位置相距甚远而不能发生信号传递,这样处于失活状态的 TREM-1可以避免过度的炎症反应;而在炎症及纤维化进行性加重并致癌形成的过程中,TREM-1在多种趋化因子的作用下大量合成并向细胞质输入增多,配合自身配体和TLR配体而活化,活化后的TREM-1还可以反向调控TLR4信号途径关键的受体和效应蛋白的表达[17],两者相互作用和影响,从而导致炎症信号级联放大而参与HCC的发生发展。朱亚飞等[22]发现卵巢癌组织中 TREM-1蛋白阳性表达率为100%,其中70%表达强阳性,主要定位在肿瘤相关巨噬细胞胞质中,未见细胞膜及细胞核染色。这也提示肿瘤发生过程中伴随 TREM-1细胞质定位的重要性。
我们后续通过对TREM-1表达与HCC组织病理学特征关系的分析时发现,该蛋白与组织学分级呈负相关,提示TREM-1表达量的多少可能在反映HCC癌组织分化程度上有重要价值。高分化者TREM-1表达量多,癌细胞恶性程度低,HCC侵袭、复发和转移机率低,低分化者则相反。提示TREM-1在HCC形成前阶段通过介导炎症反应促肿瘤生成,而在HCC形成后阶段,其在肿瘤细胞生物学行为上可能起到某种保护性作用。
综上所述,本研究首次证实肝炎至HCC的演变过程中,TREM-1 蛋白存在表达上调及胞质中的异常定位。表明TREM-1 的表达不局限于髓样细胞,为研究 TREM-1的生物学功能提供新视点。更重要的是,基于 TREM-1在HCC发生发展中发挥的重要作用,未来对其作用机制及信号通路的进一步揭示可能为HCC的诊断和治疗提供新靶点和新策略。
| [1] | Nikolaou K, Sarris M, Talianidis I. Molecular pathways: the complex roles of inflammation pathways in the development and treatment of liver cancer[J]. Clin Cancer Res, 2013, 19 (11): 2810-6. DOI: 10.1158/1078-0432.CCR-12-1961. |
| [2] | Bouchon A, Dietrich J, Colonna M. Cutting edge: inflammatory responses can be triggered by TREM-1, a novel receptor expressed on neutrophils and monocytes[J]. J Immunol, 2000, 164 (10): 4991-5. DOI: 10.4049/jimmunol.164.10.4991. |
| [3] | Dower K, Ellis DK, Saraf K, J, et al. Innate immune responses to TREM-1 activation: overlap, divergence, and positive and negative cross-talk with bacterial lipopolysaccharide[J]. J Immunol, 2008, 180 (5): 3520-34. DOI: 10.4049/jimmunol.180.5.3520. |
| [4] | Kawamura K, Komohara Y, Takaishi K, et al. Detection of M2 macrophages and colony-stimulating factor 1 expression in serous and mucinous ovarian epithelial tumors[J]. Pathol Int, 2009, 59 (5): 300-5. DOI: 10.1111/pin.2009.59.issue-5. |
| [5] | Wu J, Li J, Salcedo R, et al. The proinflammatory myeloid cell receptor TREM-1 controls Kupffer cell activation and development of hepatocellular carcinoma[J]. Cancer Res, 2012, 72 (16): 3977-86. DOI: 10.1158/0008-5472.CAN-12-0938. |
| [6] | Yuan Z, Mehta HJ, Mohammed K, et al. TREM-1 is induced in tumor associated macrophages by cyclo-oxygenase pathway in human non-small cell lung cancer[J]. PLoS One, 2014, 9 (5): e94241. DOI: 10.1371/journal.pone.0094241. |
| [7] | 张超男, 黄学宽, 骆言, 等. 电针对急性痛风性关节炎大鼠踝关节髓样细胞表达激发受体表达的影响[J]. 南方医科大学学报, 2015, 35 (1): 133-6. |
| [8] | 廖锐, 刘作金, 龚建平, 等. 人髓样细胞触发性受体-1在急性梗阻性化脓性胆管炎外周血单核细胞中的表达[J]. 南方医科大学学报, 2009, 29 (11): 2179-81. |
| [9] | Ford JW, McVicar DW. TREM and TREM-like receptors in inflammation and disease[J]. Curr Opin Immunol, 2009, 21 (1): 38-46. DOI: 10.1016/j.coi.2009.01.009. |
| [10] | Galli R, Starace D, Busa R, et al. TLR stimulation of prostate tumor cells induces chemokine-mediated recruitment of specific immune cell types[J]. J Immunol, 2010, 184 (12): 6658-69. DOI: 10.4049/jimmunol.0902401. |
| [11] | Chen LC, Laskin JD, Gordon MK, et al. Regulation of TREM expression in hepatic macrophages and endothelial cells during acute endotoxemia[J]. Exp Mol Pathol, 2008, 84 (2): 145-55. DOI: 10.1016/j.yexmp.2007.11.004. |
| [12] | Liao R, Sun TW, Yi Y, et al. Expression of TREM-1 in hepatic stellate cells and prognostic value in hepatitis B-related hepatocellular carcinoma[J]. Cancer Sci, 2012, 103 (6): 984-92. DOI: 10.1111/cas.2012.103.issue-6. |
| [13] | Duan M, Wang ZC, Wang XY, et al. TREM-1, an Inflammatory Modulator, is Expressed in Hepatocellular Carcinoma Cells and Significantly Promotes Tumor Progression[J]. Ann Surg Oncol, 2015, 22 (9): 3121-9. DOI: 10.1245/s10434-014-4191-7. |
| [14] | Martin M, Herceg Z. From hepatitis to hepatocellular carcinoma: a proposed model for cross-talk between inflammation and epigenetic mechanisms[J]. Genome Med, 2012, 4 (1): 8. DOI: 10.1186/gm307. |
| [15] | Agundez JA, Garcia-Martin E, Devesa MJ, et al. Polymorphism of the TLR4 gene reduces the risk of hepatitis C virus-induced hepatocellular carcinoma[J]. Oncology, 2012, 82 (1): 35-40. DOI: 10.1159/000335606. |
| [16] | Zhou J, Chai F, Lu G, et al. TREM-1 inhibition attenuates inflammation and tumor within the colon[J]. Int Immunopharmacol, 2013, 17 (2): 155-61. DOI: 10.1016/j.intimp.2013.06.009. |
| [17] | Netea MG, Azam T, Ferwerda G, et al. Triggering receptor expressed on myeloid cells-1 (TREM-1) amplifies the signals induced by the NACHT-LRR (NLR) pattern recognition receptors[J]. J Leukoc Biol, 2006, 80 (6): 1454-61. DOI: 10.1189/jlb.1205758. |
| [18] | Latour-Perez J, Alcala-Lopez A, Garcia-Garcia MA, et al. Diagnostic accuracy of sTREM-1 to identify infection in critically ill patients with systemic inflammatory response syndrome[J]. Clin Biochem, 2010, 43 (9): 720-4. DOI: 10.1016/j.clinbiochem.2010.03.001. |
| [19] | Buckland KF, Ramaprakash H, Murray LA, et al. Triggering receptor expressed on myeloid cells-1 (TREM-1) modulates immune responses to Aspergillus fumigatus during fungal asthma in mice[J]. Immunol Invest, 2011, 40 (7-8): 692-722. DOI: 10.3109/08820139.2011.578270. |
| [20] | Haselmayer P, Grosse-Hovest L, von Landenberg P, et al. TREM-1 ligand expression on platelets enhances neutrophil activation[J]. Blood, 2007, 110 (3): 1029-35. DOI: 10.1182/blood-2007-01-069195. |
| [21] | Arts RJ, Joosten LA, van der Meer JW, et al. TREM-1: intracellular signaling pathways and interaction with pattern recognition receptors[J]. J Leukoc Biol, 2013, 93 (2): 209-15. DOI: 10.1189/jlb.0312145. |
| [22] | 朱亚飞, 张振东, 高国兰. 髓系细胞触发受体-1在人卵巢组织中的表达及其与淋巴结转移的相关性研究[J]. 现代妇产科进展, 2013, 22 (1): 6-9. |
 2015, Vol. 35
2015, Vol. 35

