2. 第四军医大学 军事口腔医学国家重点实验室,陕西 西安 710032
2. State Key Laboratory of Military Stomatology, Fourth Military Medical University, Xi'an 710032, China
骨髓间充质干细胞(BMMSCs)是最早发现且研究最为广泛的一种间充质干细胞(MSCs),具有自我更新的能力和向多种组织分化的潜能[1],其中自体来源 BMMSCs是组织工程和干细胞治疗领域研究和应用的热点[2]。然而,自体来源BMMSCs的生物学特性与供体年龄密切相关,衰老个体来源BMMSCs的增殖能力和分化潜能明显低于年轻个体,在很大程度上限制了自体来源BMMSCs的体外扩增和应用[3]。研究表明,衰老个体来源BMMSCs增殖能力降低主要是由于端粒缩短、 端粒酶活性下降导致的,其中端粒酶逆转录酶(TERT) 的表达水平降低是端粒酶活性下降的关键因素[4-5]。
近年来,维生素C(Vc)作为一种制取容易、安全性高的小分子化合物,广泛用于各类细胞尤其是干细胞的培养体系中。研究表明,Vc能够增强BMMSCs体外培养时的增殖能力,并能保持细胞的固有表型和分化潜能,具有显著的延缓体外复制性衰老的作用[6]。此外,Wei等[7]发现Vc可以增强牙周膜干细胞的端粒酶活性和TERT基因表达水平,同时细胞的增殖能力也有明显提高。然而,Vc能否增强衰老个体来源BMMSCs的增殖能力还未见研究。本研究以骨特异性早衰小鼠 (SAMP6)为模型,取其BMMSCs进行相关检测,旨在探讨不同浓度Vc能否通过升高端粒酶活性增强衰老个体来源BMMSCs 的增殖能力,从而促进自体来源 BMMSCs的体外扩增和应用。
1 材料和方法 1.1 材料 1.1.1 实验动物以SAMP6小鼠为实验组,不发生早衰的R品系小鼠(senescence accelerated mouse resistant 1,SAMR1)为对照组,两种小鼠均繁殖自日本Kyoto大学SAM研究所提供的种鼠。随机抽取6月龄雌雄性小鼠用于实验,每组8只,雌雄各4只。
1.1.2 主要试剂α-MEM液体培养基、胎牛血清和Vc 购自Invitrogen公司;0.25%胰蛋白酶和MTT试剂购自 MP Biomedicals 公司;TeloTAGGG Telomerase PCR ELISA 试剂盒购自Roche 公司;Trizol Reagent 和 RT-PCR试剂盒购自Takara公司;PCR引物由上海生工生物工程有限公司根据设计合成;PVDF 膜购自 Millipore公司;TERT兔来源小鼠一抗购自Santa公司; β-actin兔来源小鼠一抗购自Abcam公司;FITC标记二抗购自Boster公司。
1.2 主要方法 1.2.1 显微CT(micro-CT)检测SAMP6 实验组和 SAMR1对照组小鼠经颈椎脱臼处死后,取出股骨,去除附着的肌肉及软组织,固定在4%多聚甲醛中。采用 micro-CT 系统(eXplore Locus SP,GE Healthcare,Fairfield,AL,USA)对含远端的一段10 mm股骨进行扫描(电压80 kV,电流80 μA)[8],扫描结束后采用自带的分析软件进行三维图像重建和三维结构分析。选取距股骨远端生长板0.3~0.6 mm的一段区域作为感兴趣区 (region of interest,ROI),分析骨小梁的密度 (trabecular bone mineral density,Tb. BMD),距股骨远端生长板2.3~2.6 mm的一段区域作为ROI分析皮质骨的厚度(cortical thickness,Cor.Th)。
1.2.2 BMMSCs分离培养及形态学观察颈椎脱臼处死SAMP6组和SAMR1组小鼠,浸泡于75%酒精中2~ 3 min,取其股骨、胫骨,剔除附着的肌肉及软组织,剪去两端暴露骨髓腔,使用1 mL注射器吹出骨髓,吹散后接种于含20%胎牛血清的α-MEM培养液中,37 ℃、5% CO2常规培养。每2 d进行换液,当细胞融合密度达到 80%以后,以2×105/mL密度传代。采用倒置显微镜观察P3代细胞的生长形态。
1.2.3 BMMSCs的增殖能力检测取两组小鼠P3代的 BMMSCs,PBS 清洗,胰酶消化后,离心弃上清,用含 20%胎牛血清的α-MEM培养液重悬,以1×103/孔的密度接种到96孔板中。接种1、2、3、4、5、6 d每孔加入20 μL 5 mg/mL MTT液孵育4 h,吸出液体后使用180 μL二甲基亚砜提取沉淀物,酶联免疫检测仪测定490 nm波长处吸光度值,绘制出细胞生长曲线,并对第6 d吸光度值进行统计学分析。
按照培养液中加入Vc 浓度的不同将SAMP6 组 BMMSCs 分为6 组,分别加入0、1、10、50、100、 1000 μg/mL Vc,依照上述方法检测加入Vc后SAMP6 各组及对照SAMR1 组BMMSCs的增殖能力,绘制出细胞生长曲线,并对第6 d吸光度值进行统计学分析。
1.2.4 BMMSCs的端粒酶活性检测各组分别取1×106 个细胞进行裂解,裂解液离心后取2 μL 上清液按照 TeloTAGGG Telomerase PCR ELISA 试剂盒的说明书进行检测。首先进行端粒酶催化的特异底物反应的 PCR,后用DIG 标记的特异探针与变性后的产物杂交,抗DIG抗体进行ELISA 反应,用酶标仪测定波长 450 nm处的吸光度值,减去阴性对照后所得结果代表端粒酶活性。
1.2.5 RT-PCR检测使用Trizol提取各组细胞总RNA,检测RNA的浓度后反转录合成cDNA,以cDNA为模板,按照PCR试剂盒说明书进行TERT和β-actin基因扩增,并用ABI7500 RT-PCR仪进行检测。20 μL PCR反应体系为:ddH2O 4 μL、cDNA 2 μL、上游引物2 μL、下游引物2 μL、SYBR 10 μL。引物序列:TERT F-5'ACT CAGCAACCTCCAGCCTA',R-5'CATATTGGCACTC TGCATGG3';β-actin F-5'CATCCGTAAAGACCTCT ATGCCAAC3',R-5'ATGGAGCCACCGATCCACA3'。
1.2.6 Western blot 检测使用细胞裂解液裂解各组细胞,提取细胞总蛋白,测定蛋白浓度。蛋白样品经SDS 聚丙烯酰胺凝胶电泳分离,转移到PVDF膜上,5%脱脂奶粉封闭1 h,印迹膜用一抗1∶1000 4 ℃孵育过夜,PBS 洗涤,二抗1∶4000 室温孵育1 h,PBS 洗涤后使用 BioRad成像系统进行分析。
1.3 数据处理运用SPSS 17.0 统计软件进行分析,Microsoft Excel 2010进行作图,两组数据间差异采用双尾成组t 检验(two-tailed unpaired Student's t test)分析,多组数据间差异采用单因素方差(ANOVA)分析。数据以均数±标准误表示,以P<0.05为差异有统计学意义。
2 结果 2.1 SAMP6小鼠和SAMR1小鼠的骨表型和BMMSCs 表型比较作为一种骨特异性早衰模型,SAMP6小鼠在3~4 个月骨量达到峰值,然后随年龄增加骨量降低,但其峰值骨密度和骨量均低于SAMR1小鼠[9]。通过比较两组小鼠股骨micro-CT扫描后断面(图 1A)及三维重建的图像(图 1B)和相应形态学参数,可以发现6 月龄 SAMP6小鼠股骨的骨小梁密度(Tb.BMD)及皮质骨厚度(Cor.Th)均显著低于同龄SAMR1小鼠,差异具有统计学意义(P<0.05),表明SAMP6小鼠具有骨衰老表型。
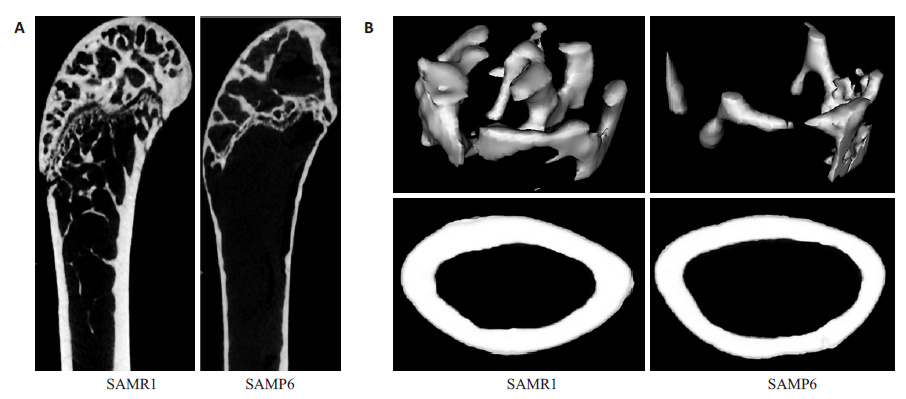
|
图 1 SAMP6小鼠和SAMR1小鼠的骨表型 Figure 1 Bone phenotypes of SAMP6 mice and SAMR1 mice. A: Micro-CT images of the trabecular metaphyses of the femora; B: Micro-CT images of the cortical metaphyses of the femora. |
倒置显微镜观察P3代SAMP6小鼠和SAMR1小鼠的BMMSCs(图 2A、B),可以看到传代后第3天SAMR1 小鼠来源的BMMSCs密度达到80%左右,大部分细胞呈细长梭形,放射状贴壁生长,有克隆集落形成。而 SAMP6 小鼠来源的BMMSCs密度较低,形态较不规则,克隆数目减少。观察两组细胞的生长曲线(图 2C),SAMP6组细胞生长曲线低于SAMR1组(0.394+0.011 vs 0.446+0.004),且两组细胞在6 d所测得的吸光度值有显著性差异(P<0.05),表明SAMP6 小鼠来源 BMMSCs的增殖能力低于SAMR1来源的BMMSCs。
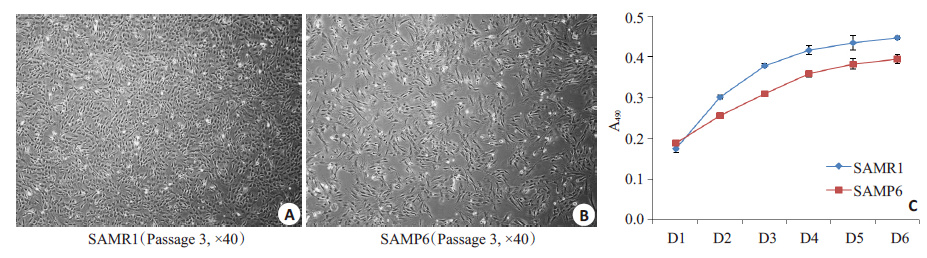
|
图 2 SAMP6小鼠和SAMR1小鼠BMMSCs的增殖能力 Figure 2 Proliferation ability of BMMSCs derived from SAMP6 mice and SAMR1 mice. A,B: Microscopic images of passage 3 BMMSCs; C: Growth curves of BMMSCs. |
观察各组细胞的生长曲线及6 d所测得的吸光度值(图 3),随Vc浓度增加,SAMP6组BMMSCs增殖能力逐渐增强,其中100 μg/mL组的增殖能力最强,几乎可以达到与SAMR1组相同的水平,表明Vc可以促进 SAMP6小鼠BMMSCs的增殖能力,且这种促进作用具有浓度依赖性。但是,1000 μg/mL组BMMSCs的生长曲线明显降低,表明过高浓度Vc对BMMSCs具有抑制增殖甚至诱导凋亡作用。
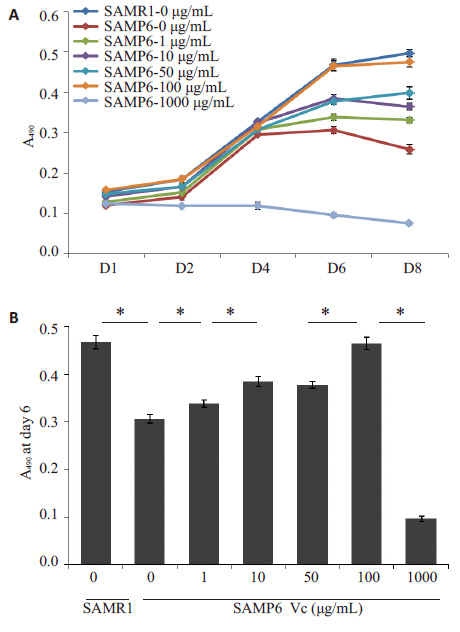
|
图 3 不同浓度Vc处理后BMMSCs的增殖能力 Figure 3 Proliferation ability of BMMSCs treated with different concentrations of Vc. A: Growth curves of BMMSCs treated with different concentrations of Vc; B: Absorbance at 490 nm measured at 6 days after cell seeding in 96-well plates. *P<0.05 vs SAMR1 mice (n=8). |
端粒酶活性试剂盒检测结果(图 4A)表明SAMP6 小鼠BMMSCs 的端粒酶活性低于SAMR1 小鼠的 BMMSCs(P<0.05),加入Vc 可以提高SAMP6 小鼠 BMMSCs的端粒酶活性,且随Vc浓度增加,端粒酶活性逐渐升高,其中100 μg/mL组的端粒酶活性最强,几乎可以达到与SAMR1组相同的水平,与细胞生长曲线及6 d所测得吸光度值的变化趋势一致。
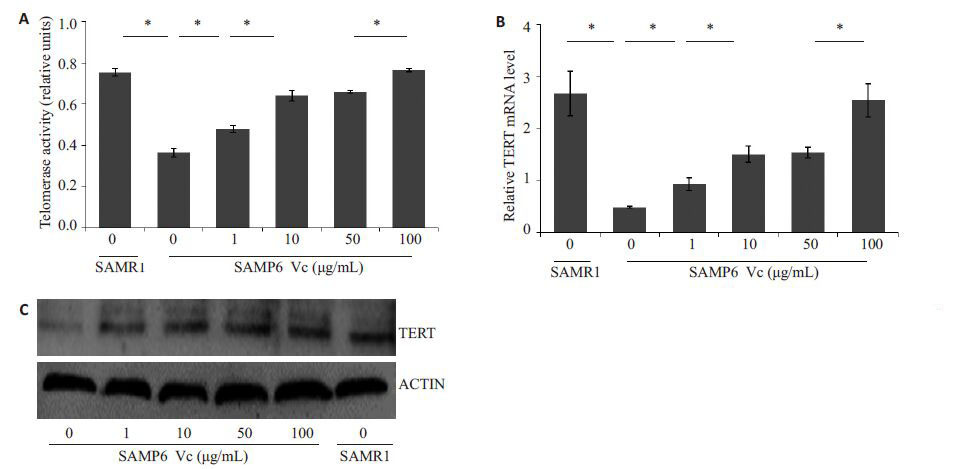
|
图 4 不同浓度Vc处理后BMMSCs的端粒酶活性和TERT表达水平 Figure 4 Telomerase activity and TERT expression level in BMMSCs treated with different concentrations of Vc. A: Telomerase activity in the treated BMMSCs; B: Expression levels of TERT mRNA in BMMSCs detected by qRT-PCR; C: Expression level of TERT protein in BMMSCs detected by Western blotting. *P<0.05 vs SAMR1 mice (n=8). |
TERT 基因表达的PCR 和Western blot 结果(图 4B、C)显示,与SAMR1来源的BMMSCs相比,SAMP6 小鼠的BMMSCs TERT 基因的表达水平降低(P<0.05)。Vc干预组BMMSCs的TERT表达水平随Vc浓度增加逐渐升高,与非干预组相比差异具有统计学意义 (P<0.05),其中100 μg/mL组的TERT表达水平最高,几乎可以达到与SAMR1组相同的水平,与端粒酶活性的检测结果一致。
3 讨论随着供体年龄的增长以及体外扩增代数的增加,BMMSCs的增殖能力和分化潜能随之降低,在很大程度上限制了自体来源BMMSCs的应用[10]。因而,越来越多的研究开始探索在培养体系中应用外源性物质以改善BMMSCs的增殖能力从而促进其体外扩增和临床应用[11]。Vc是一种广泛存在于多种新鲜蔬果中的人类必需的营养素。研究表明,Vc在细胞培养方面具有很好的应用价值,可以有效增强BMMSCs体外培养过程中的增殖能力并能保持细胞原有的生物学特性[6]。本研究中,我们通过micro-CT扫描、细胞分离培养及MTT 实验证实SAMP6 小鼠出现了骨衰老表型,其来源 BMMSCs的增殖能力下降。我们将不同浓度Vc分别加入到SAMP6 小鼠来源的BMMSCs培养液中,并与 SAMR1小鼠的BMMSCs进行比较,发现Vc在一定浓度范围内可以显著增强SAMP6小鼠来源BMMSCs的增殖能力,且这种改善作用随Vc浓度增加而增强。其中,Vc 的浓度在100 μg/mL时效应最强,几乎可以使 SAMP6 小鼠BMMSCs的增殖能力达到与SAMR1 小鼠BMMSCs相当的程度,表明100 μg/mL可能是这种效应的最适浓度。然而,Vc在1000 μg/mL时抑制细胞增殖,提示浓度过高则对细胞产生毒性作用。由于我们的实验是在早衰小鼠来源的BMMSCs上进行的,还需要开展进一步的实验来明确Vc 增强衰老人体来源 BMMSCs增殖能力的最适浓度。
目前认为,细胞衰老主要是端粒缩短产生DNA损伤信号,使细胞停止分裂导致的[12-13]。与年轻个体相比,衰老个体BMMSCs中端粒酶活性明显下降,导致其端粒长度不断缩短,细胞增殖能力显著降低[4]。TERT是构成端粒酶的催化亚基,其表达水平与端粒酶的活性密切相关。研究表明,在细胞中转染并表达外源性TERT可以提高细胞端粒酶活性,进而增强其增殖能力[14]。本研究中,我们发现Vc可以提高SAMP6小鼠来源BMMSCs 的端粒酶活性和TERT表达水平,且这种作用具有浓度依赖性,在100 μg/mL组达到最强,与增殖能力的变化趋势一致,表明提高端粒酶的活性可能是Vc促进衰老个体来源BMMSCs增殖能力的一种机制。后续还需要进一步使用抑制剂等干预手段来抑制端粒酶的活性或其蛋白的表达,进而观察Vc对衰老个体来源BMMSCs 的促增殖作用是否受到拮抗,从而进一步验证端粒酶在 Vc促进细胞增殖中的作用。Vc作为体内多种二价铁离子/α-酮戊二酸依赖型加氧酶的辅酶,能够影响与表观遗传修饰相关的DNA去甲基化酶和组蛋白去甲基化酶,具有重要的表观遗传调控功能[15]。TERT基因的表达水平也受到表观遗传机制的调控,与DNA甲基化和组蛋白修饰均相关[16]。在我们的研究中,Vc处理SAMP6小鼠BMMSCs后其TERT基因的mRNA和蛋白表达水平均有所提高,提示Vc可能通过表观遗传调控的方式促进TERT 的表达,进而增强BMMSCs端粒酶的活性。 Vc还具有供应电子,清除自由基,保护机体免受自由基损伤的作用。Kim等[17]发现Vc可以通过抑制活性氧的生成减轻P53诱导的细胞复制性衰老,从而增强细胞的增殖能力,是否与端粒酶活性和TERT基因表达水平相关则未见报道。Vc对衰老个体来源BMMSCs增殖能力的促进作用是否具有表观遗传效应,抗氧化机制是否在其中发挥作用,还需要通过进一步的体内外实验来揭示。
综上所述,Vc可以有效促进衰老小鼠来源BMMSCs 的增殖能力。我们的研究结果提示可以将Vc应用到 BMMSCs的培养体系中,有效促进自体来源BMMSCs 的体外扩增和临床应用。
| [1] | Bianco P, Cao X, Frenette PS, et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine[J]. Nat Med, 2013, 19 (1): 35-42. DOI: 10.1038/nm.3028. |
| [2] | Aldahmash A, Zaher W, Al-Nbaheen M, et al. Human stromal (mesenchymal) stem cells: basic biology and current clinical use for tissue regeneration[J]. Ann Saudi Med, 2012, 32 (1): 68-77. |
| [3] | Stolzing A, Jones E, McGonagle D, et al. Age-related changes in human bone marrow-derived mesenchymal stem cells: Consequences for cell therapies[J]. Mech Ageing Dev, 2008, 129 (3): 163-73. DOI: 10.1016/j.mad.2007.12.002. |
| [4] | Huang G, Zheng Q, Sun J, et al. Stabilization of cellular properties and differentiation mutilpotential of human mesenchymal stem cells transduced with hTERT gene in a long-term culture[J]. J Cell Biochem, 2008, 103 (4): 1256-69. DOI: 10.1002/(ISSN)1097-4644. |
| [5] | Sethe S, Scutt A, Stolzing A. Aging of mesenchymal stem cells[J]. Ageing Res Rev, 2006, 5 (1): 91-116. DOI: 10.1016/j.arr.2005.10.001. |
| [6] | Choi KM, Seo YK, Yoon HH, et al. Effect of ascorbic acid on bone marrow-derived mesenchymal stem cell proliferation and differentiation[J]. J Biosci Bioeng, 2008, 105 (6): 586-94. DOI: 10.1263/jbb.105.586. |
| [7] | Wei F, Qu C, Song T, et al. Vitamin C treatment promotes mesenchymal stem cell sheet formation and tissue regeneration by elevating telomerase activity[J]. J Cell Physiol, 2012, 227 (9): 3216-24. DOI: 10.1002/jcp.24012. |
| [8] | Hanyu R, Wehbi VL, Hayata T, et al. Anabolic action of parathyroid hormone regulated by the β2-adrenergic receptor[J]. Proc Natl Acad Sci USA, 2012, 109 (19): 7433-8. DOI: 10.1073/pnas.1109036109. |
| [9] | Takeda T. Senescence-accelerated mouse (SAM): a biogerontological resource in aging research[J]. Neurobiol Aging, 1999, 20 (2): 105-10. DOI: 10.1016/S0197-4580(99)00008-1. |
| [10] | Katsara O, Mahaira LG, Iliopoulou EG, et al. Effects of donor age, gender, and in vitro cellular aging on the phenotypic, functional, and molecular characteristics of mouse bone marrow-derived mesenchymal stem cells[J]. Stem Cells Dev, 2011, 20 (9): 1549-61. DOI: 10.1089/scd.2010.0280. |
| [11] | Yamaza T, Miura Y, Bi Y, et al. Pharmacologic stem cell based intervention as a new approach to osteoporosis treatment in rodents[J]. PLoS One, 2008, 3 (7): e2615. DOI: 10.1371/journal.pone.0002615. |
| [12] | Shawi M, Autexier C. Telomerase, senescence and aging[J]. Mech Ageing Dev, 2008, 129 (1-2): 3-10. DOI: 10.1016/j.mad.2007.11.007. |
| [13] | Bernardes de Jesus B, Blasco MA. Assessing cell and organ senescence biomarkers[J]. Circ Res, 2012, 111 (1): 97-109. DOI: 10.1161/CIRCRESAHA.111.247866. |
| [14] | Simonsen JL, Rosada C, Serakinci N, et al. Telomerase expression extends the proliferative life-span and maintains the osteogenic potential of human bone marrow stromal cells[J]. Nat Biotechnol, 2002, 20 (6): 592-6. DOI: 10.1038/nbt0602-592. |
| [15] | Wang T, Chen K, Zeng X, et al. The histone demethylases Jhdm1a/ 1b enhance somatic cell reprogramming in a vitamin-C-dependent manner[J]. Cell Stem Cell, 2011, 9 (6): 575-87. DOI: 10.1016/j.stem.2011.10.005. |
| [16] | Sui X, Kong N, Wang Z, et al. Epigenetic regulation of the human telomerase reverse transciptase gene: A potential therapeutic target for the treatment of leukemia (Review)[J]. Oncol Lett, 2013, 6 (2): 317-22. |
| [17] | Kim JE, Jin DH, Lee SD, et al. Vitamin C inhibits p53-induced replicative senescence through suppression of ROS production and p38 MAPK activity[J]. Int J Mol Med, 2008, 22 (5): 651-5. |
 2015, Vol. 35
2015, Vol. 35

