2. 南方医科大学第三附属医院 病理科,广东 广州 510630
2. Department of Pathology, Third Affiliated Hospital of SouthernMedical University, Guangzhou 510630, China
IgA肾病1968年由Berger等[1]首次提出,原发性IgA 肾病是世界范围内最常见的原发性肾小球疾病[2-4]。在中国,原发性IgA 肾病占原发性肾小球疾病的45%~ 50%[5-6]。大约1/3未经治疗的患者最终进展至终末期肾脏病(ESRD)[7-9]。IgA肾病的临床表现变化较大,从孤立性镜检血尿至终末期肾脏病。IgA肾病的诊断依赖于组织病理学免疫病理分析,它是以肾小球系膜区IgA 沉积伴补体C3沉积为特征。肾活检是有创伤性的技术操作。根据相关的报道,肾活检出血率高达24.2%[10]少数患者由于肾活检的并发症甚至需要手术止血或者行肾切除术。另外,对无症状的单纯镜检血尿患者是否行肾活检是有争议的[4]。因此,寻找IgA肾病无需操作、简单且容易获得的标志物是迫切需要的。血清IgA/C3比值作为一个简单易行的检测指标,在鉴别IgA肾病与非 IgA肾病上的价值仍然是有争议的。需要在不同的人群、不同种族中去验证。另外关于血清IgA/C3比值与 IgA肾病的牛津分级及Lee氏分级间的关系研究较少。 我们本次研究的目的是评价血清IgA/C3 比值在IgA 肾病诊断中的价值及其与IgA肾病临床与病理之间的联系。
1 资料和方法 1.1 研究对象收集从2009年11月~2015年2月份在南方医科大学第三附属医院肾活检诊断为IgA肾病患者66例,111 例其他肾小球疾病患者(40例膜性肾病,33例微小病变性肾病,27例非IgA沉积的系膜增生和11例局灶节段性肾小球硬化症)和40例健康对照者。并且排除下列疾病:(1)系统性红斑狼疮、紫癜肾炎、肿瘤、血液病等系统性疾病所致继发性IgA肾病;(2)患者肾活检光镜下肾小球数目小于8个;(3)肾活检时eGFR<10 mL/min/ 1.73 m2。IgA肾病诊断依靠组织病理学免疫荧光分析,以IgA和补体C3为主沉积于肾小球系膜区,伴或者不伴IgG和IgM沉积。健康对照组40例参与者均无高血压、糖尿病、慢性肾炎病史,均无蛋白尿。所有患者在肾活检时均未长期服用糖皮质激素和(或)免疫抑制剂。 所有参与者获得知情同意。
1.2 临床指标我们收集患者的年龄、性别、收缩压、舒张压、血肌酐、24小时尿蛋白、血清白蛋白(Alb)、血红蛋白(Hb)、 血尿素氮(BUN)、尿酸、高密度脂蛋白(HDL)、胆固醇、 甘油三酯(TG)、低密度脂蛋白(LDL-C)。eGFR使用适合中国人的MDRD公式计算,eGFR=[175×(Scr)-1.234× (Age)-0.179×(if female,×0.79)][11]。血清IgA、C3 使用 CRM470调整后的标准化免疫比浊法检测。
1.3 病理分级所有肾活检样本均行光镜、免疫荧光和电镜检查。 除了对IgA肾病进行Lee氏[12]分级外,我们还对其进行牛津分级[13]:(1)系膜细胞增生(M):M1和M0;(2)内皮细胞增生E1、E0;(3)节段性肾小球硬化S1或S0;(4)肾小管萎缩或/和间质纤维化(T)T0:0%~50%,T1:>50%。 MEST得分=M+E+S+T,范围从0-4。肾活检的诊断是经两位病理医生独立的诊断,最终的诊断经所有作者参与临床病理讨论后决定。
1.4 统计学分析统计分析均使用SPSS 19.0软件。正态分布计量资料使用均数±标准差表示。偏态分别计量资料使用中位数与四分位数间距表示。计数资料使用率来表示。 对于非正态分布3组间比较使用Kruskal-Wallis检验。 对于正态分布资料,两组间比较使用t检验,多组间比较使用单因素方差分析(One-Way ANOVA)。对于不满足方差齐性的资料使用Brown-Foreythe检验。多组间比较,满足方差齐性条件的使用SNK检验,不满足方差齐性的使用Dunnett T3检验。对于分类变量使用卡方检验。在判别血清IgA、C3 和IgA/C3 比值在IgA肾病诊断中的价值时使用ROC曲线。双侧P值小于0.05认为差异有统计学意义。
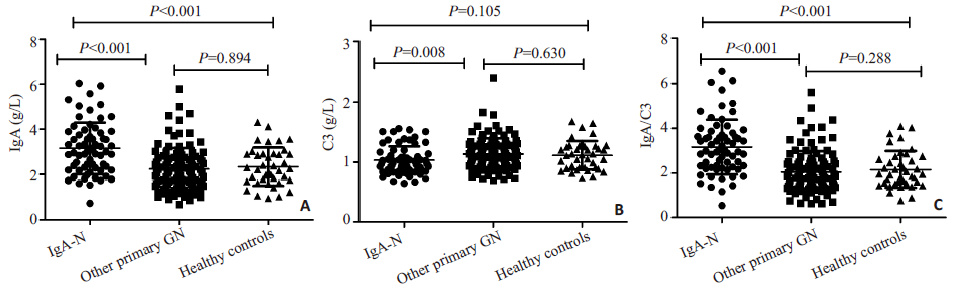
2 结果 2.1 基本特征比较如表 1所示,IgA肾病患者、其他肾小球疾病患者和健康对照组平均年龄分别为37.42 岁、43.49 岁、46.33 岁。与其他肾小球疾病组相比,IgA肾病组患者有较高的血清IgG、低补体C3和低补体IgM水平。与健康对照组相比,IgA肾病患者有较高的血清尿素氮、高血肌酐、较高的尿蛋白、低eGFR、高血尿酸。与健康对照组及其他肾小球疾病患者对比(图 1),IgA肾病患者有较高水平的血清IgA(IgA 肾病vs 其他肾小球疾病,P<0.001;IgA肾病vs健康对照组,P<0.001)及血清IgA/C3 比值(IgA肾病vs其他肾小球疾病,P<0.001;IgA肾病vs 健康对照组,P<0.001)。
|
图 1 在IgA肾病、其他肾小球疾病和健康对照者中血清IgA、补体C3和血清IgA/C3比值水平。 Figure 1 Serum immunoglobulin A (IgA) and complement factor 3 (C3) levels and the IgA/C3 ratio in IgA nephropathy,other primary GN and healthy control groups. |
| 表 1 IgA肾病、其他肾小球疾病和健康对照组的基本特征 Table 1 Baseline characteristics of patients with immunoglobulin A nephropathy (IgA-N),patients with other glomerular diseases,and healthy control subjects |
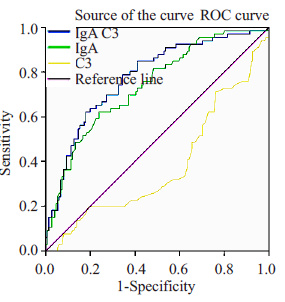
表 2及ROC曲线示:血清IgA/C3比值区分IgA肾病与非IgA 肾病的敏感性及特异性分别为78.79%和 65.5%,曲线下面积是0.776(高于血清IgA),其截断点是2.23。
|
图 2 血清IgA、IgA/C3比值和补体C3 在诊断IgA肾病中的敏感性与特异性 Figure 2 Sensitivity and specificity of serum IgA, serum IgA/C3 and serum C3 in the diagnosis of IgA nephropathy. |
| 表 2 IgA肾病与非IgA肾病的比较 Table 2 Diagnostic value of serum IgA,C3,and IgA/C3 ratio for IgA nephropathy and non-IgA nephropathy |
根据表 2 中的截断点,我们将IgA 肾病分为血清 IgA/C3比值≥2.23组和血清IgA/C3比值<2.23组(表 3)。 与血清IgA/C3比值<2.23组相比,血清IgA/C3比值≥2.23 组相对年轻、胆固醇、甘油三酯水平较低。在IgA/C3比值<2.23组24小时尿蛋白总量高于(P=0.016)血清IgA/ C3比值≥2.23组。在血清IgA/C3比值<2.23组,24小时尿蛋白≥1的比率多(两组比较P=0.031)。两组之间性别、血红蛋白、血尿素氮、血清白蛋白、eGFR、血尿酸、低密度脂蛋白、高密度脂蛋白、血清IgG、血清IgM、收缩压、舒张压、肾组织Lee分级、系膜增生、内皮细胞增生、 肾小球节段硬化、肾小管萎缩/间质纤维化≥25%等指标比较差异无显著意义。
| 表 3 血清IgA/C3比值与IgA肾病的临床及病理的关系 Table 3 Correlation of serum IgA/C3 ratio with the clinicopathological characteristics of patients with IgA nephropathy |
如表 4 所述,我们将IgA 肾病患者根据MEST积分,分为积分≥3组与积分<3组。积分≥3组患者有更高的尿素氮、血肌酐、24小时尿蛋白、24小时尿蛋白≥1率,和较低的eGFR。在年龄、性别、血红蛋白、血清白蛋白、 血清IgG、血清IgA、IgA/C3 比值以及Lee分级IV-V(%) 的比率间均无显著差异。
| 表 4 MEST积分与IgA肾病临床资料的关系 Table 4 Correlation between MEST scores and the clinical characteristics of patients with IgA nephropathy |
IgA 肾病是我国最常见的肾小球疾病。由于IgA 肾病的临床表现差异较大,多数较隐匿,有些患者仅表现为单纯镜检血尿或蛋白尿。若能早期诊断IgA肾病,从而早期对其进行相应干预,多数IgA肾病在治疗后系膜细胞增生、肾小球血管袢坏死、间质纤维化程度均会缓解[14]。这样就可以减少终末期肾脏病的发生,可为国家及患者带来极大益处。尽管肾活检是诊断IgA肾病的金标准,但是在无症状的单纯镜检血尿行肾活检是有争议的。在经济欠发达的地区或基层医院肾活检仍然是比较难以执行的。随着经济及科技的发展,科学家们发现了许多IgA肾病的标记物例如:α-白蛋白、半乳糖缺陷的IgA1分子(Gd-IgA1)、铰链区O-多聚糖、甘露糖结合凝集素、细胞因子、肽质量指纹图谱等[15-16]。已知,IgA1分子的异常糖基化参与了IgA肾病的发病。IgA 患者中异常糖基化的IgA1分子较非IgA肾病者明显升高[17]。由于检测费用昂贵和技术要求较高,这些标记物仅能在实验室检测,尚未推广到临床基层单位应用。由于血清IgA及补体C3商业化试剂盒的成熟及检测技术要求低,即使在经济欠发达的地区或基层医院也是方便可行的。
早在1995年,Sakai等[18]提出血清IgA大于350 mg/dl 作为IgA 肾病一个诊断指标。Ishiguro 等[19]提出血清 IgA/C3也是IgA肾病的一个重要的诊断指标。Komatsu 等[20]的研究提示血清IgA/C3 比值是比单纯血清IgA、 C3 更有价值的诊断IgA 肾病的指标。并且认为血清 IgA/C3比值≥4.5可作为鉴别IgA肾病与非IgA肾病的重要指标,并且是IgA肾病预后不良的指标。任丽等[21] 对复旦大学附属中山医院239 例IgA 肾病及108 例非 IgA肾病分析结果提示,血清IgA/C3比值对诊断IgA肾病的预测价值较低。我们的研究结果提示血清IgA/C3 比值在预测IgA肾病中的ROC曲线下面积为0.776,可作为IgA肾病的一个辅助诊断指标。关于血清IgA/C3 比值预测IgA肾病诊断的截点,各种族、各地区研究尚未形成统一标准。Maeda等[22]报道,血清IgA/C3比值在鉴别IgA与非IgA肾病时优于单纯血清IgA,并提出血清IgA/C3比值大于3.01作为鉴别IgA肾病与非IgA 肾病的一个重要指标。Zhang等[23]认为血清IgA/C3比值≥3.23不仅能作为区分IgA肾病与非IgA肾病的重要指标,并且可以作为IgA肾病预后不良的指标。本研究结果提示血清IgA/C3的截点为2.23。关于血清IgA/C3 与临床病理的联系尚未形成统一认识。我们的结果提示:在血清IgA/C3≥2.23组,患者血胆固醇、甘油三酯、 24小时尿蛋白定量以及24小时尿蛋白定量大于1 g的比率,均比血清IgA/C3<2.23组低,但血清IgA/C3比值与肾脏病理系膜增生、内皮细胞增生、肾小球硬化、间质纤维化与小管萎缩≥25%等指标之间无明显关系,我们的结果显示血清IgA/C3比值升高尚不能作为临床预后较差的指标,并且其与病理改变程度无明显相关性。本研究尚有一定局限性,样本量较小,且为横断面研究,需要更大量样本的研究来探讨合适的血清IgA/C3截点来鉴别 IgA肾病与非IgA肾病,及探讨其与临床及预后的关系。
综上所述,血清IgA/C3比值在无条件行肾活检的医院可作为一个简单的辅助诊断指标,但其作用尚不能替代肾活检。积极寻找简单易行、敏感性及特异性更高的IgA 肾病标记物是迫在眉睫的研究课题。
| [1] | Berger J, Hinglais N. Intercapillary deposits of IgA-IgG[J]. J Urol Nephrol(Paris), 1968, 74 (9): 694-5. |
| [2] | D'amico G. The commonest glomerulonephritis in the world: IgA nephropathy[J]. Q J Med, 1987, 64 (245): 709-27. |
| [3] | Julian BA, Waldo FB, Rifai A, et al. IgA nephropathy, the most common glomerulonephritis worldwide. A neglected disease in the United States?[J]. Am J Med, 1988, 84 (1): 129-32. DOI: 10.1016/0002-9343(88)90019-8. |
| [4] | Donadio JV, Grande JP. IgA nephropathy[J]. N Engl J Med, 2002, 347 (10): 738-48. DOI: 10.1056/NEJMra020109. |
| [5] | Zhou FD, Zhao MH, Zou WZ, et al. The changing spectrum of primary glomerular diseases within 15 years: a survey of 3331 patients in a single Chinese centre[J]. Nephrol Dial Transplant, 2009, 24 (3): 870-6. |
| [6] | Li LS, Liu ZH. Epidemiologic data of renal diseases from a single unit in China: Analysis based on 13,519 renal biopsies[J]. Kidney Int, 2004, 66 (3): 920-3. DOI: 10.1111/j.1523-1755.2004.00837.x. |
| [7] | D'amico G. Clinical features and natural history in adults with IgA nephropathy[J]. Am J Kidney Dis, 1988, 12 (5): 353-7. DOI: 10.1016/S0272-6386(88)80023-4. |
| [8] | Koyama A, Igarashi M, Kobayashi M. Natural history and risk factors for immunoglobulin A nephropathy in Japan. Research Group on Progressive Renal Diseases[J]. Am J Kidney Dis, 1997, 29 (4): 526-32. DOI: 10.1016/S0272-6386(97)90333-4. |
| [9] | Li PK, Ho KK, Szeto CC, et al. Prognostic indicators of IgA nephropathy in the Chinese-clinical and pathological perspectives[J]. Nephrol Dial Transplant, 2002, 17 (1): 64-9. DOI: 10.1093/ndt/17.1.64. |
| [10] | Stratta P, Canavese C, Marengo M, et al. Risk management of renal biopsy: 1387 cases over 30 years in a single centre[J]. Eur J Clin Invest, 2007, 37 (12): 954-63. DOI: 10.1111/eci.2007.37.issue-12. |
| [11] | Ma YC, Zuo L, Chen JH, et al. Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J]. J Am Soc Nephrol, 2006, 17 (10): 2937-44. DOI: 10.1681/ASN.2006040368. |
| [12] | Lee SM, Rao VM, Franklin WA, et al. IgA nephropathy: morphologic predictors of progressive renal disease[J]. Hum Pathol, 1982, 13 (4): 314-22. DOI: 10.1016/S0046-8177(82)80221-9. |
| [13] | Working Group of the International IgA Nephropathy Network and the Renal Pathology Society, Cattran DC, Coppo R, et al. The Oxford classification of IgA nephropathy: rationale, clinicopathological correlations, and classification[J]. Kidney Int, 2009, 76 (5): 534-45. DOI: 10.1038/ki.2009.243. |
| [14] | Hotta O, Furuta T, Chiba S, et al. Regression of IgA nephropathy: a repeat biopsy study[J]. Am J Kidney Dis, 2002, 39 (3): 493-502. DOI: 10.1053/ajkd.2002.31399. |
| [15] | Hwang VJ, Ulu A, Van Hoorebeke J, et al. Biomarkers in IgA nephropathy[J]. Biomark Med, 2014, 8 (10): 1263-77. DOI: 10.2217/bmm.14.92. |
| [16] | 高静, 王涌, 温新宇, 等. 肽质量指纹图谱鉴别诊断IgA肾病和非IgA 肾病的可行性分析[J]. 南方医科大学学报, 2011, 32 (8): 1309-13. |
| [17] | Tomana M, Novak J, Julian BA, et al. Circulating immune complexes in IgA nephropathy consist of IgA1 with galactosedeficient hinge region and antiglycan antibodies[J]. J Clin Invest, 1999, 104 (1): 73-81. DOI: 10.1172/JCI5535. |
| [18] | Sakai H, Abe K, Kobayashi Y, et al. Clinical guidelines of IgA nephropathy[J]. Nihon Jinzo Gakkai Shi, 1995, 37 (8): 417-21. |
| [19] | Ishiguro C, Yaguchi Y, Funabiki K, et al. Serum IgA/C3 ratio May predict diagnosis and prognostic grading in patients with IgA nephropathy[J]. Nephron, 2002, 91 (4): 755-8. DOI: 10.1159/000065043. |
| [20] | Komatsu H, Fujimoto S, Hara S, et al. Relationship between serum IgA/C3 ratio and progression of IgA nephropathy[J]. Intern Med, 2004, 43 (11): 1023-8. DOI: 10.2169/internalmedicine.43.1023. |
| [21] | 任丽, 许迅辉, 韩君伟, 等. 血清IgA、IgA/C3比值在IgA肾病的诊断 价值[J]. 检验医学与临床, 2013, 10 (5): 536-7. |
| [22] | Maeda A, Gohda T, Funabiki K, et al. Significance of serum IgA levels and serum IgA/C3 ratio in diagnostic analysis of patients with IgA nephropathy[J]. J Clin Lab Anal, 2003, 17 (3): 73-6. DOI: 10.1002/jcla.10071. |
| [23] | Zhang J, Wang C, Tang Y, et al. Serum immunoglobulin A/C3 ratio predicts progression of immunoglobulin A nephropathy[J]. Nephrology(Carlton), 2013, 18 (2): 125-31. |
 2015, Vol. 35
2015, Vol. 35

