缺血性脑卒中是脑卒中的主要形式[1],具有高致残率和高致死率的特点,严重威胁着人类的健康,且围手术期患者的脑缺血再灌注(I/R)损伤十分常见。丙泊酚作为一种临床常用的麻醉药近年来被证实对肾脏、肝脏、心脏的缺血性损伤都有一定的保护作用[2-3]。研究发现,丙泊酚预处理能够减轻脑缺血再灌注损伤,但作用机制并不完全清楚,仍有待进一步深入探讨[4]。缝隙连接(GJ)是细胞中广泛存在的一种特殊连接通道,在脑组织中以缝隙连接蛋白43(Cx43)组成的缝隙连接最为多见[5],研究表明,抑制缝隙连接(GJ)功能可以减轻脑缺血再灌注损伤[6],且有研究发现,丙泊酚可通过抑制缝隙连接功能降低原位肝移植导致的急性肾损伤[7]。但丙泊酚对脑缺血再灌注损伤的保护作用是否与抑制GJ 功能有关,尚不明确。B细胞淋巴瘤-2基因(Bcl-2)家族的 Bcl-2、Bax基因组成一个平衡体系,共同参与脑缺血再灌注损伤的细胞凋亡过程,有文献报道丙泊酚可降低缺血再灌注脑损伤大鼠海马区凋亡因子Bax的表达,提高抑制凋亡因子Bcl-2的表达,对缺血再灌注脑损伤有一定保护作用[8];研究发现,调控缝隙连接功能可以通过影响Bax、Bcl-2的蛋白表达从而对肿瘤细胞的凋亡产生影响[9]。但丙泊酚影响Bax、Bcl-2的蛋白表达是否与其抑制缝隙连接功能有关,尚未见报道。本实验中采用缝隙连接抑制剂甘珀酸(CBX)作为研究整体动物缝隙连接功能的工具药,旨在研究GJ在丙泊酚对大鼠脑I/R损伤保护中的作用,并对其可能机制进行初步探讨。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性SD大鼠70只,体质量300 ±20 g,由浙江省实验动物中心提供,动物许可证号: SCXK(浙)2014-0001。
1.1.2 主要试剂丙泊酚购于四川国瑞药业有限公司 (产品批号1403291);PKC 单克隆抗体购于Abcam; Bax、Bcl-2 单克隆抗体购于BOSTER;Cx43 单克隆抗体、TTC(2,3,5,-氯三苯基四氮唑)、GAPDH单克隆抗体、山羊抗小鼠IgG 二抗、山羊抗兔Ig G二抗均购于 Sigma;其他试剂均为国产分析纯级。
1.2 实验方法 1.2.1 实验分组将70 只大鼠随机分为7 组,每组10 只:假手术(sham)组、缺血再灌注(I/R)组、丙泊酚低剂量(P25,25 mg/kg)组、中剂量(P50,50 mg/kg)组、高剂量 (P100,100 mg/kg)组、甘珀酸(CBX)干预缺血再灌注(I/ R+CBX)组和甘珀酸干预丙泊酚高剂量(P100+CBX)组。
1.2.2 大鼠脑缺血再灌注损伤模型制作参照Zea-land[10] 法稍作改进制备大鼠局灶性I/R 模型。使用直径为 0.28~0.32 mm的线栓阻断大鼠大脑中动脉血流,造成大鼠局灶性脑缺血,缺血2 h后拔出线栓,恢复血流再灌注24 h,即I/R损伤模型。sham组只进行手术操作,但不插入线栓阻断大脑中动脉血流。相应剂量的丙泊酚(25、 50、100 mg/kg)于脑缺血前10 min经腹腔注射给药;甘珀酸(0.2 mg/kg)于再灌注前1 min尾静脉注射给药。
1.2.3 神经行为学评估按照文献报道的神经行为功能缺失的评分方法[11],对再灌注24 h后的大鼠神经功能行为进行评分(每组10只)。0分:无可见的明显神经功能缺失症状,活动正常;1分:不能完全伸展手术对侧前肢; 2分:行走时向手术对侧转圈;3分:行走时向手术对侧倾倒,行动不便;4分:不能行走、意识水平下降或处于昏迷状态。其中神经行为评分≥1分为成功模型。
1.2.4 脑梗死体积测定再灌注24 h后,立即断头取出脑组织(每组6只),置于-20 ℃冰箱冷冻12 min后自额极向后连续等距切取6张冠状脑片。1% TTC避光染色 30 min(37 ℃),正常脑组织染为红色,脑梗死区域为白色。染色后将脑片置于4%多聚甲醛溶液中保存24 h,逐层拍照。采用Image J软件对脑片相应部位面积进行测量,使用公式:脑梗死体积百分率/%=100%×{对侧大脑皮质的面积-[同侧大脑皮质的面积-脑梗塞的面积]}/ 对侧大脑皮质的面积[12],计算脑梗死体积百分率。
1.2.5 Western Blot检测相关蛋白表达变化大鼠再灌注24 h后,立即断头取脑(每组4只),夹取大鼠右侧缺血区脑组织,提取蛋白,进行标准蛋白定量;制备12% SDS-PAGE凝胶,取50 μg/孔蛋白样品进行上样、电泳 (70 V,400 mA,30 min;95 V,400 mA,120 min);转膜 (50 V,250 mA,150 min);洗膜、封闭2 h;洗膜、与Cx43 (1∶2000)、PKC(1∶1000)、Bax(1∶2000)、Bcl-2(1∶1000) 共同孵育,4 ℃恒温过夜;洗涤后于左右摇床上室温孵育二抗(山羊抗鼠抗体:1∶5000;山羊抗兔抗体:1∶5000) 2 h。其中GAPDH(1∶2000)单克隆抗体室温孵育两小时即可。二抗孵育2 h后,采用ECL发光试剂盒发光、 显影,使用凝胶图像分析系统采集图像,图像采集后使用Bio Imaging system(Gene Genius)对图像进行灰度扫描分析。
1.3 统计学分析采用SPSS 17.0软件分析实验结果,数据资料以均数±标准差表示,计量资料比较进行单因素ANOVA分析,P<0.05认为有统计学意义,统计图采用Sigma Plot 10.0绘制。
2 结果 2.1 丙泊酚对脑I/R损伤大鼠神经功能评分的影响大鼠脑缺血2 h,再灌注24 h后,对大鼠进行神经行为学评分,其结果为:sham 组大鼠无神经功能缺失症状,I/R 组神经行为学评分为2.90±0.57,P25组为2.80± 0.42,P50组为2.40±0.70,P100组为2.80±0.42,I/R+CBX 组为1.70±0.67,P100+CBX组为1.30±0.48。以上神经行为学评分结果显示:与I/R组相比,丙泊酚中、高剂量组神经功能缺损评分均显著降低(P<0.05),且高剂量组降低效果更明显,但低剂量组无显著性差异。与异丙酚高剂量组相比,甘珀酸干预丙泊酚高剂量组大鼠的神经行为学评分进一步降低(P<0.05)。
2.2 丙泊酚对脑I/R损伤大鼠脑梗死体积的影响大鼠脑组织TTC染色后,脑组织梗死区域呈白色,非梗死区域呈红色,结果显示:sham组无明显梗死灶外,其他各实验组均出现不同程度的梗死灶。丙泊酚中、高剂量组较I/R组脑梗死体积均显著缩小(P<0.05),且高剂量组缩小效果更加显著(P<0.05),但丙泊酚低剂量组无显著性差异;在丙泊酚高剂量的基础上,加用甘珀酸,大鼠脑梗死体积进一步缩小(P<0.05,图 1)。
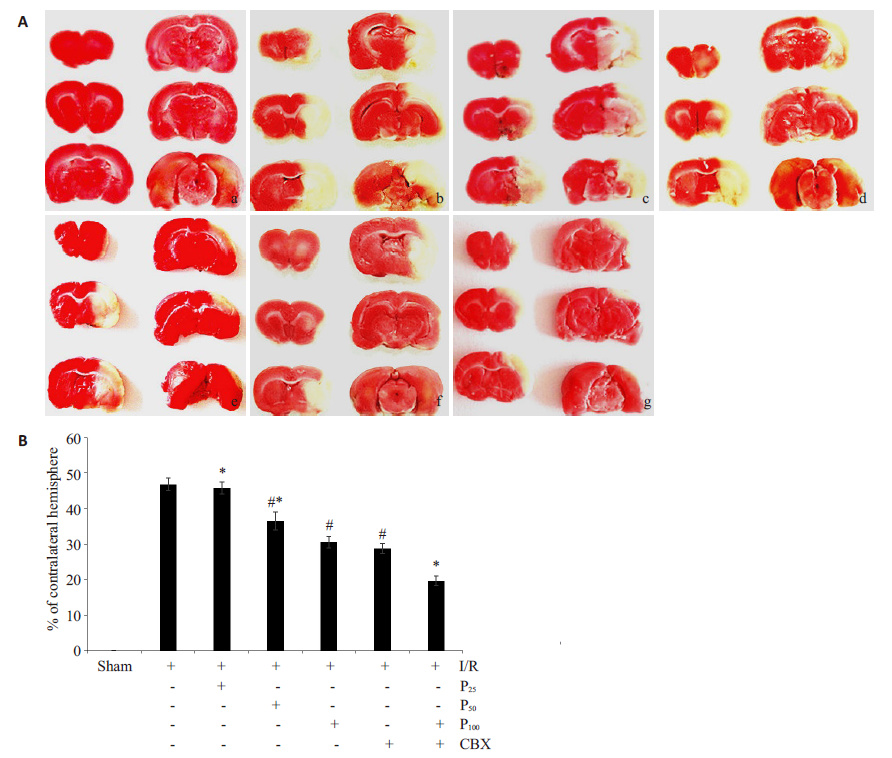
|
图 1 丙泊酚对脑缺血再灌注损伤后大鼠的脑梗死体积的影响 Figure 1 Effect of propofol on brain infarct volume in rats with focal cerebral I/R injury detected by TTC staining. A: Slices of brain tissue. a: Sham; b: I/R; c: P25; d: P50; e: P100; f: I/R + CBX; g: P100 + CBX. B: Quantitative analysis of brain infarct volume (n=6). Bars are standard deviation. #P<0.05 vs I/R group. *P<0.05 vs P100 group. |
由神经行为学评分和TTC染色结果可知,丙泊酚高剂量对大鼠脑缺血再灌注损伤的保护作用最佳,因此选用丙泊酚高剂量(100 mg/kg)用于后续机制研究的实验。采用Western blot检测Cx43、PKC蛋白表达变化。 结果显示:与sham组相比,I/R组Cx43蛋白表达显著增高(P<0.05);丙泊酚高剂量组较I/R组Cx43蛋白表达显著降低(P<0.05);甘珀酸干预丙泊酚高剂量组较丙泊酚高剂量组Cx43蛋白表达进一步降低(P<0.05)。各组大鼠的PKC蛋白表达趋势与Cx43蛋白表达趋势相反(图 2)。
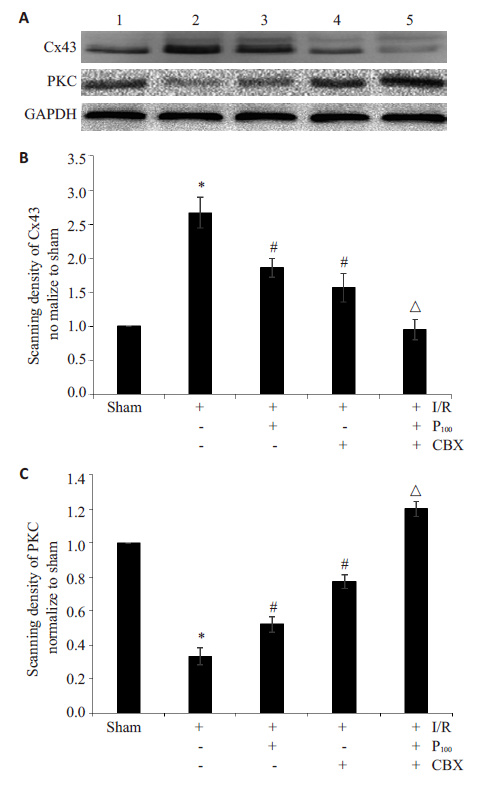
|
图 2 丙泊酚对脑缺血再灌注损伤大鼠脑组织中Cx43和PKC 蛋白表达的影响 Figure 2 Effect of propofol on the expression of Cx43 and PKC in rats with cerebral I/R injury detected by Western blotting. A: Expression of Cx43 and PKC. 1: sham; 2: I/R; 3: P100; 4: I/R+CBX; 5: P100 +CBX; B: Quantitative analysis of Cx43; C: Quantitative analysis of PKC (n=4); Bars indicate standard deviation. *P<0.05 vs sham group. #P<0.05 vs I/R group. △P<0.05 vs P100 group. |
采用Western blot 检测Bax、Bcl-2 的蛋白表达变化,结果显示:I/R 组Bax/Bcl-2 的比值较sham 组明显增加(P<0.05);丙泊酚高剂量预处理后可显著降低脑缺血再灌注损伤Bax/Bcl-2的比值(P<0.05);且CBX可使丙泊酚高剂量组Bax/Bcl-2 的比值进一步降低(P<0.05,图 3)。
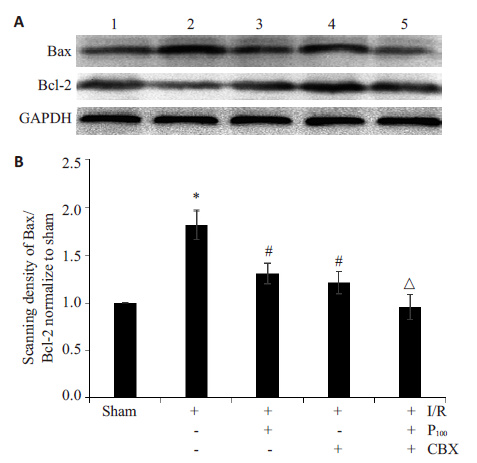
|
图 3 丙泊酚对脑缺血再灌注损伤大鼠脑组织中Bax和Bcl-2 蛋白表达的影响 Figure 3 Effect of propofol on the expression of Bax and Bcl-2 in rats with cerebral I/R injury detected by Western blotting. A: Expression of Bax and Bcl-2. 1: sham; 2: I/R; 3: P100; 4: I/R + CBX; 5: P100 + CBX. B: Quantitative analysis of the Bax/Bcl-2 (n=4); Bars indicate standard deviation. *P<0.05 vs sham group. #P<0.05 vs I/R group. △P<0.05 vs P100 group. |
丙泊酚作为一种静脉麻醉药,具有类维生素E的结构,有抗脂质过氧化的作用;其药代动力学特征为起效快、停药恢复快,因此广泛应用于临床麻醉的诱导和维持。近年来,多个研究[13-15]表明丙泊酚可以减轻大鼠脑缺血再灌注损伤,但其作用机制尚不完全清楚。本实验通过神经行为学评分和TTC染色结果证实丙泊酚对I/ R损伤有一定的保护作用,且高剂量效果较佳,与其他研究者的发现[16]保持一致,因此本实验选用保护作用效果较佳的高剂量丙泊酚(100 mg/kg)进行后续的机制研究。研究发现,脑缺血再灌注过程中GJ功能有明显的增强,抑制GJ功能脑I/R损伤显著降低[7]。CBX具有抑制GJ的功能,且起效快、能通过血脑屏障,可以用于对整体动物缝隙连接功能的研究。从本实验神经功能评分、TTC染色结果可以看出,丙泊酚和CBX都可以降低I/R 损伤,且CBX可使丙泊酚的保护作用增强。 Western blot结果显示,I/R组Cx43蛋白表达较sham组明显增加,丙泊酚可显著降低Cx43蛋白表达,且CBX 可使丙泊酚组Cx43蛋白表达进一步降低。说明丙泊酚的保护作用与抑制缝隙连接功能有关。
缝隙连接(GJ)通道是由两个缝隙连接半通道对接而成,而每个缝隙连接半通道是由六个缝隙连接蛋白 (Cx)组成的六聚体构成。有文献报道,GJ在同步细胞的活动、维持细胞内环境稳定、控制细胞的生长和发育等生命过程中发挥十分重要的作用[17]。脑组织中分布最为广泛的是Cx43蛋白[18],因此本实验以Cx43为研究缝隙连接功能的主要对象。近年来,有研究发现,Cx43蛋白可以作为治疗缺血再灌注损伤的新靶点[19],其作用日益受到研究者们的关注。本实验中,I/R 组 Cx43蛋白表达高于sham组;P100组Cx43蛋白表达低于 I/R组;P100+CBX组Cx43蛋白表达低于I/R+P3组。说明抑制Cx43蛋白表达可以降低脑I/R损伤,且丙泊酚可以通过抑制Cx43的蛋白表达从而减轻I/R损伤;CBX 可以使P100组的Cx43蛋白表达进一步降低,I/R损伤得以进一步减轻。
PKC激酶属于多功能丝氨酸/苏氨酸激酶,广泛调节各个细胞的生理功能,参与缺血再灌注损伤等疾病的发生、发展过程[20]。PKC可以磷酸化Cx43蛋白的特殊位点,从而降低GJ功能[21]。因此本实验观察了丙泊酚处理后PKC 与Cx43 蛋白之间的关系,结果显示,与 sham组相比,I/R组中PKC蛋白显著降低,P3组的PKC 蛋白的表达高于I/R组,CBX可以使P100组的PKC蛋白表达进一步增高,说明PKC蛋白可能参与了丙泊酚抑制缝隙连接功能从而降低I/R损伤的过程。B细胞淋巴瘤-2基因(Bcl-2)家族的Bcl-2、Bax基因组成一个平衡体系,共同参与脑I/R损伤过程中由于活性氧过度释放引起的细胞凋亡[22]。其中抗凋亡基因Bcl-2与抑制细胞凋亡、延长细胞生存有关;而促凋亡基因Bax表达增高时可促进细胞凋亡。因此,研究者采用Bax/Bcl-2的比值作为评价细胞凋亡的一个重要标志[23]。Western blot 结果显示,I/R组Bax/Bcl-2的比值较sham组明显增加,丙泊酚预处理可显著降低脑缺血再灌注损伤Bax/Bcl-2 的比值,且CBX可使丙泊酚组Bax/Bcl-2的比值进一步降低。
综上所述,丙泊酚预处理可减轻I/R损伤,其机制可能与通过影响PKC蛋白表达从而抑制缝隙连接功能及降低Bax/Bcl-2的比值有关。
| [1] | Eshah NF. Lifestyle and health promoting behaviours in Jordanian subjects without prior history of coronary heart disease[J]. Int J Nurs Pract, 2011, 17 (1): 27-35. DOI: 10.1111/ijn.2011.17.issue-1. |
| [2] | Yang S, Chou WP, Pei L. Effects of propofol on renal ischemia/ reperfusion injury in rats[J]. Exp Ther Med, 2013, 6 (5): 1177-83. |
| [3] | Ye L, Luo CZ, Mccluskey SA, et al. Propofol attenuates hepatic ischemia/reperfusion injury in an in vivo rabbit model[J]. J Surg Res, 2012, 178 (2): e65-70. DOI: 10.1016/j.jss.2012.01.037. |
| [4] | Zhou R, Yang Z, Tang X, et al. Propofol protects against focal cerebral ischemia via inhibition of microglia-mediated proinflammatory cytokines in a rat model of experimental stroke[J]. PLoS One, 2013, 8 (12): e82729. DOI: 10.1371/journal.pone.0082729. |
| [5] | Homkajorn B, Sims NR, Muyderman H. Connexin 43 regulates astrocytic migration and proliferation in response to injury[J]. Neurosci Lett, 2010, 486 (3): 197-201. DOI: 10.1016/j.neulet.2010.09.051. |
| [6] | Wang N, De Vuyst E, Ponsaerts R, et al. Selective inhibition of Cx43 hemichannels by Gap19 and its impact on myocardial ischemia/reperfusion injury[J]. Basic Res Cardiol, 2013, 108 (1): 309. DOI: 10.1007/s00395-012-0309-x. |
| [7] | Luo C, Yuan D, Li X, et al. Propofol attenuated acute kidney injury after orthotopic liver transplantation via inhibiting gap junction composed of connexin 32[J]. Anesthesiology, 2015, 122 (1): 72-86. DOI: 10.1097/ALN.0000000000000448. |
| [8] | 肖峰, 周晓清, 李元涛, 等. 异丙酚对大鼠缺血再灌注海马区Bax和 Bcl-2 表达的影响[J]. 华中科技大学学报: 医学版, 2010, 39 (1): 113-5. |
| [9] | Tong X, Han X, Yu B, et al. Role of gap junction intercellular communication in testicular leydig cell apoptosis induced by oxaliplatin via the mitochondrial pathway[J]. Oncol Rep, 2015, 33 (1): 207-14. |
| [10] | Yin D, Zhou C, Kusaka I, et al. Inhibition of apoptosis by hyperbaric Oxygen in a rat focal cerebral ischemic model[J]. J Cereb Blood Flow Metab, 2003, 23 (7): 855-64. |
| [11] | Ye XH, Wu Y, Guo PP, et al. Lipoxin a4 analogue protects brain and reduces inflammation in a rat model of focal cerebral ischemia reperfusion[J]. Brain Res, 2010, 1323 (15): 174-83. |
| [12] | Zhang YM, Xu H, Sun H, et al. Electroacupuncture treatment improves neurological function associated with regulation of tight junction proteins in rats with cerebral ischemia reperfusion injury[J]. Evid Based Complement Alternat Med, 2014, 15 (6): 989340. |
| [13] | Ji FT, Liang JJ, Miao LP, et al. Propofol postconditioning protects the blood brain barrier by decreasing matrix metalloproteinase9 and aquaporin4 expression and improves the neurobehavioral outcome in a rat model of focal cerebral ischemiareperfusion injury[J]. Mol Med Rep, 2015, 12 (2): 2049-55. |
| [14] | Wang H, Liu S, Wang H, et al. The effect of propofol postconditioning on the expression of K(+)-Cl(-)-co-transporter 2 in GABAergic inhibitory interneurons of acute ischemia/reperfusion injury rats[J]. Brain Res, 2015, 1597 (16): 210-9. |
| [15] | Yue ZY, Dong H, Wang YF, et al. Propofol prevents neuronal mtDNA deletion and cerebral damage due to ischemia/reperfusion injury in rats[J]. Brain Res, 2015, 1594 (8): 108-14. |
| [16] | 宋春雨, 陶涛, 崔晓光, 等. 丙泊酚对全脑缺血/再灌注损伤大鼠保护 作用研究[J]. 国际麻醉学与复苏杂志, 2011, 32 (4): 393-7. |
| [17] | Giaume C, Orellana JA, Abudara V, et al. Connexin-based channels in astrocytes: how to study their properties[J]. Methods Mol Biol, 2012, 814 : 283-303. DOI: 10.1007/978-1-61779-452-0. |
| [18] | 董淑英, 童旭辉, 蒋国君, 等. 星形胶质细胞中缝隙连接蛋白connexin 43 的表达及其功能调控[J]. 南方医科大学学报, 2012, 32 (10): 1423-6. |
| [19] | Schulz R, Görge PM, Görbe A, et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection[J]. Pharmacol Ther, 2015, 153 (7): 90-106. |
| [20] | 张凤云, 赵炎, 吴玉林. 蛋白激酶C在脑缺血再灌注损伤中的作用[J]. 中国临床药理学与治疗学, 2013, 18 (4): 461-8. |
| [21] | Shan H, Wei J, Zhang M, et al. Suppression of PKCε-mediated mitochondrial connexin 43 phosphorylation at serine 368 is involved in myocardial mitochondrial dysfunction in a rat model of dilated cardiomyopathy[J]. Mol Med Rep, 2015, 11 (6): 4720-6. |
| [22] | Sanderson TH, Reynolds CA, Kumar R, et al. Molecular mechanisms of ischemia-reperfusion injury in brain: pivotal role of the mitochondrial membrane potential in reactive Oxygen species Generation[J]. Mol Neurobiol, 2013, 47 (1): 9-23. DOI: 10.1007/s12035-012-8344-z. |
| [23] | Huang X, Choi JK, Park SR, et al. GM-CSF inhibits apoptosis of neural cells via regulating the expression of apoptosis-related proteins[J]. Neurosci Res, 2007, 58 (1): 50-7. DOI: 10.1016/j.neures.2007.01.015. |
 2015, Vol. 35
2015, Vol. 35

