2. 南方医科大学南方医院 药学部,广东 广州 510515
2. Department of Pharmacy, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
硫化氢(H2S)是继一氧化氮和一氧化碳之后发现的第3种气体信号分子,参与多种疾病的病理生理过程,对动脉粥样硬化、缺血再灌注损伤、心力衰竭、高血压等疾病有治疗作用[1]。H2S的给药方式目前有外源性吸入 H2S气体和供体注射两种方式。针对外源性吸入途径,即使吸入很低浓度的H2S,也会因其臭味及对呼吸道的刺激而难以耐受[2]。硫化钠和硫氢化钠是目前广泛应用的H2S供体,由于不同器官对H2S的敏感性不同,全身给药可能产生不必要的副作用,如血压的急剧变化、中枢神经系统毒性及呼吸抑制等[2-4]。因此,若能实现H2S 靶向性给药或可避免其副反应发生。
超声微泡不仅是临床常用的超声造影剂,还可作为携带治疗性气体的良好载体,具有实现靶向传输H2S气体的潜能[5]。利用超声微泡现已实现了一氧化氮和氧气的靶向性传输且取得良好的治疗效果。Tong等[6]制备了载一氧化氮的微泡并证实该微泡联合超声波辐照增加干细胞向心肌归巢,促进血管新生,改善心功能。 McEwan等[7]制备的载氧气微泡可改善肿瘤的缺氧环境,增强声动力治疗效果。然而,载H2S气体超声微泡的制备仍未见报道。因此,本研究拟构建一种载H2S气体的超声微泡并验证其理化特性和超声显影效果,为下一步可视化输送H2S实现靶向治疗提供研究基础。
1 材料与方法 1.1 实验材料及仪器 1.1.1 动物SD大鼠6只,雌雄不限,体质量250~300 g, 由南方医科大学实验动物中心提供。
1.1.2 试剂二棕榈酰磷脂酰胆碱(DPPC,Advanti, 美国)、二棕榈酰磷脂酸(DPPA,Advanti, 美国)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇5000(DPPE-PEG5000,Advanti, 美国)、全氟丙烷(纯度99.9%,佛山市科的气体化工有限公司,中国)、H2S气体(纯度99.9%,佛山市科的气体化工有限公司,中国)、硫化钠(Sigma-Aldrich, 美国)、N,N-二甲基对二苯胺盐酸盐(Sigma-Aldrich, 美国)、醋酸锌(Sigma-Aldrich, 美国)、三氯化铁(光华科技股份有限公司,中国)。其它试剂均为分析纯。
1.1.3 仪器银汞胶囊调合器(杭州中润医疗器械有限公司,中国)、显微镜(OLYMPUS BX51,日本)、库尔特计数仪(Multisizer 3,美国)、离心机(Scanspeed 406,Labogene, 丹麦)、全自动酶标仪(SpectraMax M5/M5e, Molecular Devices, 美国)、Sequoia512 超声心动图仪 (Siemens, 德国)、超声空化治疗仪(DCT-700,深圳市威尔德医疗电子有限公司,中国)。
1.2 载H2S微泡(HSMB)的制备不同比例的H2S 和全氟丙烷按照4∶0、3∶1、2∶2、 1∶3 和0∶4 混合后,采用机械震荡法制备5 种载相应比例的H2S 和全氟丙烷混合气体的HSMB,分别为 HSMB4∶0、HSMB3∶1、HSMB2∶2、HSMB1∶3和HSMB0∶4。按摩尔比10∶82∶8称取DPPC、DPPE-PEG5000及DPPA,加至含丙二醇、甘油和NaCl 的水溶液中,于70 ℃水浴搅拌15 min至完全溶解制成磷脂分散液,分别取2 mL分装于3 mL玻璃瓶中,过量H2S饱和后密封保存[8]。不同比例的混合气体分别置换玻璃瓶顶空气体,置于银汞胶囊调合器上3200 次/min 振荡50 s 制得5 种不同的 HSMB。
1.3 不同时间点5种HSMB的粒径及浓度HSMB制备成功后,在不同时间点(0、1、6、24、72 h) 取一滴微泡溶液于玻片上,置显微镜下观察微泡的形态、大小等;取20 μL在库尔特计数仪下检测、分析微泡的粒径分布和浓度,评估其稳定性,优选出最佳的气体混合比例。
1.4 超声辐照对HSMB微泡浓度及H2S释放的影响选取最佳比例混合气体制备的HSMB,低速离心 (400 g, 1 min)后以蒸馏水洗涤数次置换下清液以去除溶液中溶解的H2S及过量脂质,抽取2 mL于注射器中,顶端用胶塞密封,分为超声组及对照组。超声组采用超声治疗仪发射的超声波(发射频率1.0 MHz, 声压1.0 MPa) 进行辐照,对照组不予超声处理,取20 μL混悬液在库尔特计数仪下检测微泡的浓度,然后低速离心,取下清液75 μL测溶解H2S浓度,每隔5 min测量1次。H2S浓度测量采用亚甲蓝分光光度法,75 μL下清液中加入 250 μL 1%醋酸锌及蒸馏水425 μL孵育10 min, 然后加入N,N-二甲基对苯二胺盐酸盐(20 mmol/L)/HCl (7.2 mol/L)缓冲液133 μL 及FeCl3(30 mmol/L)/HCI (1.2 mol/L)缓冲液133 μL,充分混匀静置20 min。取 200 μL于96孔板中,全自动酶标仪在波长670 nm测定吸光度,根据Na2S标准曲线计算溶液中的H2S浓度,单位为μmol/L。
1.5 HSMB心肌及肾脏超声显影效果在体观察最佳比例混合气体制备的HSMB超声显影效果。SD大鼠采用戊巴比妥50 mg/kg腹腔麻醉后仰卧位固定于鼠板上,心前区、腰部脱毛。尾静脉留置穿刺针以备注射HSMB。用自制支架固定超声探头 (15L8)于大鼠心前区或肾区,获得满意的二维图像切面后保持位置及参数在实验过程中不变。经尾静脉团注 0.1 mL HSMB后,使用Sequoia512超声心动图仪,对比脉冲序列(Contrast Pulse Sequencing,CPS)成像技术行心肌及肾脏对比超声检查,探头发射频率为7.0 MHz, 机械指数为0.18。实验结束后全部声学造影图像存盘。
1.6 统计学分析运用SPSS 19.0软件进行统计学分析,所有数值均以均数±标准差表示。HSMB初始微泡浓度及粒径比较采用单因素方差分析,Bonferroni 进行多重比较。 HSMB微泡稳定性及超声辐照对H2S释放的数据采用重复测量数据的方差分析进行比较。P<0.05为差异有统计学意义。
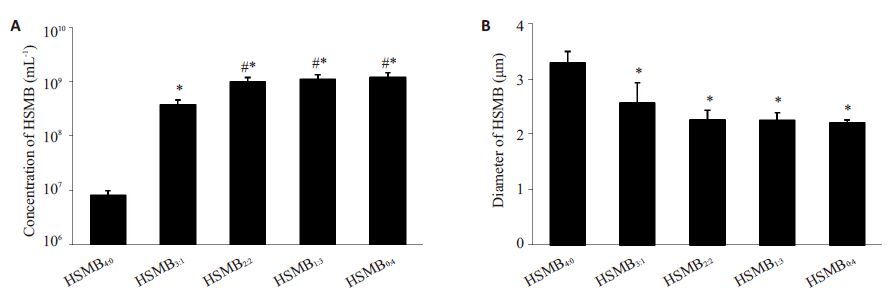
2 结果 2.1 HSMB的浓度、粒径和稳定性制备后即刻观察,5种HSMB外观呈均匀乳白色; HSMB2∶2、HSMB1∶3和HSMB0∶4肉眼观无差别;HSMB4∶0 和HSMB3∶1颜色较其他3 组淡,HSMB4∶0尤为明显(图 1)。显微镜下微泡呈中心透亮,外壳光滑的完整圆球形,分散度好,无明显聚集现象;HSMB2∶2、HSMB1∶3和 HSMB0∶4 形态均匀,数量无明显差别;HSMB4∶0 和 HSMB3∶1数量较其他3组少,HSMB4∶0尤为明显(图 1)。 库尔特计数仪检测结果示,HSMB4∶0微泡浓度明显少于 HSMB3∶1、HSMB2∶2、HSMB1∶3和HSMB0∶(4 所有P<0.05); HSMB3∶1 微泡浓度明显少于HSMB2∶2、HSMB1∶3 和 HSMB0∶4(所有P<0.05);HSMB2∶2、HSMB1∶3和HSMB0∶4 微泡浓度无明显差别(所有P>0.05,图 2A)。HSMB4∶0 平均粒径明显大于HSMB3∶1、HSMB2∶2、HSMB1∶3 和 HSMB0∶4(所有P<0.05)。HSMB3∶1、HSMB2∶2、HSMB1∶3 和HSMB0∶4的平均粒径无差别(所有P>0.05,图 2B)。

|
图 1 载不同比例混合气体的HSMB的外观和光镜下形态特点 Figure 1 Gross appearance and microscopic observation of HSMBs prepared with different ratios of mixture gases. A: HSMB4:0; B: HSMB3:1; C: HSMB2:2; D: HSMB1:3; E: HSMB0:4. |
|
图 2 载不同比例混合气体的HSMB的微泡浓度及粒径 Figure 2 Concentration (A) and diameter (B) of HSMBs prepared with different ratios of mixture gases. *P<0.05 vs HSMB4:0; #P < 0.05 vs HSMB3:1. |
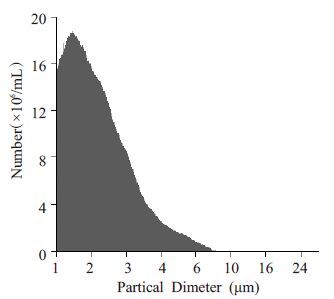
HSMB4∶0微泡浓度于1 h后开始降低。HSMB3∶1微泡浓度于6 h 后开始降低并进行性减少。HSMB2∶2、 HSMB1∶3和HSMB0∶4微泡浓度在72 h内无变化(表 1)。 这说明HSMB4∶0 和HSMB3∶1 稳定性差于HSMB2∶2、 HSMB1∶3和HSMB0∶4。因此,为了尽量提高微泡的H2S 载气量同时保证稳定性,我们认为H2S和全氟丙烷按照 2∶2混合是制备HSMB的最佳比例。下面对HSMB2∶2 进行进一步评价。HSMB2∶2粒径分布于0~9 μm, 绝大部分的微泡粒径小于8 μm(图 3)。
| 表 1 载不同比例混合气体的HSMB微泡浓度随时间的变化 Table 1 Changes of HSMB concentration at different time points |
|
图 3 HSMB2∶2的粒径分布图 Figure 3 Size distribution of HSMB2:2. |
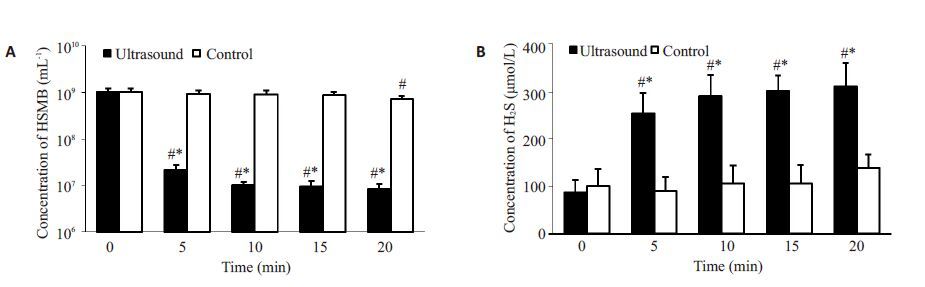
为了验证制备的HSMB2∶2是否包裹H2S及超声能否触发H2S 释放,我们将HSMB2∶2分为超声组及对照组。给予1.0 MHz, 1.0 MPa的超声波辐照后,HSMB2∶2 浓度迅速降低,5 min内从(1.01±0.19)×109/mL减少至 (2.12±0.63)×107/mL(P<0.05),下清液中的H2S浓度从 87.2 ± 25.3 μmol/L 增加至254.66 ± 43.30 μmol/L(P<0.05),5 min后浓度趋于平稳。与对照组相比,各个时间点HSMB数目均显著减少(P<0.05),下清液中H2S浓度显著增加(P<0.05,图 4)。
|
图 4 超声辐照对HSMB2∶2微泡浓度及H2S释放的影响 Figure 4 Effect of ultrasound sonication on HSMB2:2 concentration (A) and H2S release (B).*P<0.05 vs control group; #P<0.05 vs 0 min. |
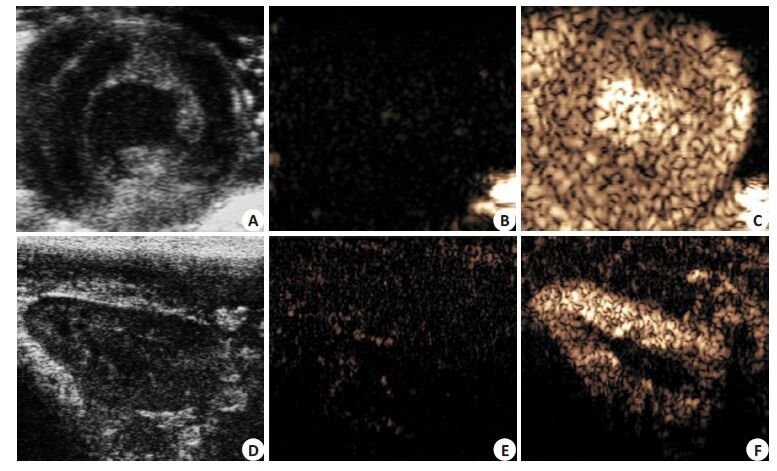
获得满意的心脏或肾脏的二维图像后(图 5A、D),CPS成像模式未见增强显影(图 5B、E)。经静脉注射 HSMB2∶2后3±1s可见心肌和肾脏显影,逐渐增强,12±2 s 后达到平台期,此时HSMB2∶2填充均匀,与周围组织分界清晰(图 5C、F)。随后显影强度逐渐减弱,12±3 min 后消失。
|
图 5 HSMB2∶2的超声造影效果 Figure 5 Ultrasound contrast-enhancing effect of HSMB2:2. A,D: Two-dimensional ultrasound images of the heart and kidney; B,E: Contrast-enhanced ultrasound images of the heart and kidney before HSMB2:2 injection; C,F: Contrast-enhanced ultrasound images of the heart and kidney after HSMB2:2 injection. |
超声微泡是一种由生物外壳包裹气体核心构成的超声造影剂,可作为传输基因[9]、药物[10]甚至治疗性气体[5, 6, 11-13]的良好载体。在高强度的超声波作用下,微泡发生剧烈震荡甚至破裂,破裂后其携带的物质将在局部释放,从而实现靶向输送[5]。因此,若能制备载H2S气体的超声微泡,结合局部的超声辐照即可实现靶向传输 H2S,然而,目前仍未见报道。本实验创新性制备了稳定性良好的载H2S气体的脂质超声微泡;初步探讨了H2S 和全氟丙烷最佳的混合比例;体外验证超声触发H2S释放的可行性;在体证实该微泡具有良好的超声显影效果。这为下一步可视化输送H2S进而实现靶向治疗提供研究基础。
制备稳定的载H2S气体的超声微泡是实现H2S靶向性传输的前提。H2S作为一种小分子的活跃性气体,易受Laplace压力[14]的影响溢出微泡,使得微泡浓度及稳定性均较差。有文献报道在制备载一氧化氮[16]或氧气[11, 17]的微泡过程中,加入全氟丙烷可增加微泡的稳定性和浓度,原因在于全氟丙烷作为大分子的惰性气体难以溢出微泡壳膜[15],因此平衡了微泡和外周的压力,减少了氧气或一氧化氮的外溢。鉴于此,我们拟加入全氟丙烷气体以增加载H2S超声微泡的稳定性,然而,全氟丙烷的加入势必减少了H2S的含量。为了平衡微泡的稳定性及H2S的载气量,我们初步探究H2S和全氟丙烷的最佳混合比例。实验结果显示,随着全氟丙烷气体含量的增加,微泡的稳定性及浓度逐渐增加;当H2S和全氟丙烷的混合比例达到2∶2时,制备的HSMB浓度较高且72 h内的稳定性良好,且不再随全氟丙烷含量的增加而增加。因此,我们认为H2S和全氟丙烷2∶2混合是制备稳定的HSMB的最佳比例。
为了验证最佳比例混合气体制备的HSMB是否包裹H2S 及超声能否触发H2S 释放,我们用超声辐照 HSMB2∶2并观察微泡浓度及下清液中H2S浓度的变化。 结果显示超声辐照之后微泡破裂,微泡浓度迅速减少,而溶液中H2S浓度迅速增加。这说明制备的HSMB2∶2 包裹有H2S且超声能触发H2S气体释放。实验亦发现对照组中第20 min HSMB2∶2数量较基线减少,这可能是由于离心过程造成的微泡丢失。另外,本实验采用的亚甲基蓝分光光度法可准确反映H2S的浓度。该方法目前广泛应用于液体中H2S浓度的测量,检测流程简单,灵敏度高,稳定性好。其原理是∶H2S与醋酸锌反应生成硫化锌沉淀;硫化锌在强酸条件下与N,N-二甲基对苯二胺盐酸盐和三氯化铁反应形成蓝色的亚甲基蓝螯合物,在可见光波长670 nm处有特异性的收峰[18]。测量670 nm处的吸光度,根据绘制的标准曲线即可计算 H2S的浓度。
本实验制备的HSMB2∶2同时具有良好的超声显影效果。我们制备的HSM2∶2的浓度为(1.01±0.19)×109/mL,平均粒径2.25±0.17 μm, 几乎全部小于红细胞直径(8 μm),满足超声造影剂的基本要求。经静脉注射后,该微泡能穿过肺部毛细血管进入体循环,均匀填充于心肌及肾脏组织中,具有良好的超声显影效果,有助于实现H2S气体的可视化传输。
本实验制备的HSMB具有广泛的应用前景。近期研究发现,H2S参与众多疾病的病理生理过程,有望成为新的治疗手段。外源性给予H2S可通过减少oxLDL 诱导的泡沫细胞形成,抑制血管内皮ICAM-1的表达延缓apoE−/−小鼠动脉粥样硬化斑块的进展[19]。H2S通过抑制MAPK1/3/MMP-8信号通路改善糖尿病大鼠心肌纤维化[20]。在压力负荷诱导的心力衰竭小鼠模型上,H2S 能活化一氧化氮合成酶,增加一氧化氮生物活性,从而延缓心力衰竭进展为失代偿性心力衰竭[21]。在小鼠心肌缺血再灌注损伤的模型上,Elrod等[22]在再灌注的同时心腔注射硫化钠,结果显示心梗面积减少72%,心功能显著改善。因此,H2S作为治疗性气体具有诱人的应用前景。然而,H2S系统性给药可能产生毒副作用,如血压的急剧变化、中枢神经系统毒性及呼吸的抑制等[2-4]。 运用我们制备的HSMB结合局部超声波辐照可视化输送H2S或可实现靶向治疗,从而避免H2S全身性给药而产生的副作用。
总之,H2S和全氟丙烷按照2∶2混合制备的HSMB 浓度高、稳定性良好,能携带H2S气体并可被超声触发释放,同时具有良好的超声显像效果,有助于可视化传输H2S气体实现靶向治疗,从而避免系统给药产生的毒副作用。
| [1] | Polhemus DJ, Lefer DJ. Emergence of Hydrogen sulfide as an endogenous gaseous signaling molecule in cardiovascular disease[J]. Circ Res, 2014, 114 (4): 730-7. DOI: 10.1161/CIRCRESAHA.114.300505. |
| [2] | Beauchamp Ro Jr, Bus JS, Popp J A, et al. A critical review of the literature on hydrogen sulfide toxicity[J]. Crit Rev Toxicol, 1984, 13 (1): 25-97. DOI: 10.3109/10408448409029321. |
| [3] | Yoo D, Jupiter RC, Pankey EA, et al. Analysis of cardiovascular responses to the H2S donors Na2S and NaHS in the rat[J]. Am J Physiol Heart Circ Physiol, 2015, 309 (4): H605-14. DOI: 10.1152/ajpheart.00171.2015. |
| [4] | Almeida AF, Guidotti TL. Differential sensitivity of lung and brain to sulfide exposure:a peripheral mechanism for apnea[J]. Toxicol Sci, 1999, 50 (2): 287-93. DOI: 10.1093/toxsci/50.2.287. |
| [5] | Fix SM, Borden MA, Dayton PA. Therapeutic gas delivery via microbubbles and liposomes[J]. J Control Release, 2015, 209 : 139-49. DOI: 10.1016/j.jconrel.2015.04.027. |
| [6] | Tong JY, Ding JD, Shen XB, et al. Mesenchymal stem cell transplantation enhancement in myocardial infarction rat model under ultrasound combined with nitric oxide microbubbles[J]. PLoS One, 2013, 8 (11): e80186. DOI: 10.1371/journal.pone.0080186. |
| [7] | Mcewan C, Owen J, Stride E, et al. Oxygen carrying microbubbles for enhanced sonodynamic therapy of hypoxic tumours[J]. J Control Release, 2015, 203 : 51-6. DOI: 10.1016/j.jconrel.2015.02.004. |
| [8] | 谭开彬, 高云华, 刘平, 等. 机械振荡法制备脂膜超声造影剂的初步实 验研究[J]. 中国超声医学杂志, 2006 (8): 561-3. |
| [9] | Fujii H, Li SH, Wu J, et al. Repeated and targeted transfer of angiogenic plasmids into the infarcted rat heart via ultrasound targeted microbubble destruction enhances cardiac repair[J]. Eur Heart J, 2011, 32 (16): 2075-84. DOI: 10.1093/eurheartj/ehq475. |
| [10] | Sato T, Mori S, Sakamoto M, et al. Direct delivery of a cytotoxic anticancer agent into the metastatic lymph node using nano/ microbubbles and ultrasound[J]. PLoS One, 2015, 10 (4): e123619. |
| [11] | Eisenbrey JR, Albala L, Kramer MR, et al. Development of an ultrasound sensitive Oxygen carrier for Oxygen delivery to hypoxic tissue[J]. Int J Pharm, 2015, 478 (1): 361-7. DOI: 10.1016/j.ijpharm.2014.11.023. |
| [12] | Britton GL, Kim H, Kee PH, et al. In vivo therapeutic gas delivery for neuroprotection with echogenic liposomes[J]. Circulation, 2010, 122 (16): 1578-87. DOI: 10.1161/CIRCULATIONAHA.109.879338. |
| [13] | Mcewan C, Owen J, Stride E, et al. Oxygen carrying microbubbles for enhanced sonodynamic therapy of hypoxic tumours[J]. J Control Release, 2015, 203 : 51-6. DOI: 10.1016/j.jconrel.2015.02.004. |
| [14] | Kwan JJ, Borden MA. Lipid monolayer collapse and microbubble stability[J]. Adv Colloid Interface Sci, 2012, 183 : 82-99. |
| [15] | Szijjarto C, Rossi S, Waton G, et al. Effects of perfluorocarbon gases on the size and stability characteristics of Phospholipid- Coated microbubbles: osmotic effect versus interfacial film stabilization[J]. Langmuir, 2012, 28 (2): 1182-9. DOI: 10.1021/la2043944. |
| [16] | Sutton JT, Raymond JL, Verleye MC, et al. Pulsed ultrasound enhances the delivery of nitric oxide from bubble liposomes to ex vivo porcine carotid tissue[J]. Int J Nanomedicine, 2014, 9 : 4671-83. |
| [17] | Kwan JJ, Kaya M, Borden MA, et al. Theranostic Oxygen delivery using ultrasound and microbubbles[J]. Theranostics, 2012, 2 (12): 1174-84. DOI: 10.7150/thno.4410. |
| [18] | 郑扬, 廖锋, 杜军保, 等. 改良亚甲基蓝法测定血浆硫化氢[J]. 生理 学报, 2012 (6): 681-6. |
| [19] | Wang Y, Zhao X, Jin H, et al. Role of Hydrogen sulfide in the development of atherosclerotic lesions in apolipoprotein E knockout mice[J]. Arterioscler Thromb Vasc Biol, 2009, 29 (2): 173-9. DOI: 10.1161/ATVBAHA.108.179333. |
| [20] | 李芳, 曾欧, 罗健, 等. 硫化氢对糖尿病大鼠心肌纤维化及MAPK1/ 3和MMP-8表达的影响[J]. 南方医科大学学报, 2015 (4): 549-52. |
| [21] | Kondo K, Bhushan S, King AL, et al. H(2)S protects against pressure overload-induced heart failure via upregulation of endothelial nitric oxide synthase[J]. Circulation, 2013, 127 (10): 1116-27. DOI: 10.1161/CIRCULATIONAHA.112.000855. |
| [22] | Elrod JW, Calvert JW, Morrison J, et al. Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function[J]. Proc Natl Acad Sci USA, 2007, 104 (39): 15560-5. DOI: 10.1073/pnas.0705891104. |
 2015, Vol. 35
2015, Vol. 35

