随着基因工程技术的发展,利用植物作为生物反应器生产外源蛋白的研究因其广阔的商业前景在世界范围内受到广泛地关注[1-2]。在植物基因工程中,人们通常将目的基因转入植物体内,以便获得有用的目的蛋白。 与传统的细菌、酵母等微生物表达系统相比,植物是一个生产成本低廉的“绿色工厂”。它仅需水、矿物质和阳光,却能提供很大的产出,不需要昂贵的发酵设备且能进行翻译后加工修饰;与动物表达系统相比,植物种植和培养相对容易,无需动物细胞培养中昂贵的仪器设备。而且植物系统更安全,避免了人体或动物病原的污染[3]。但是,表达量相对较低和下游纯化过程繁琐是当前制约植物生物反应器的发展的主要瓶颈[3]。为了解决上述问题,多肽标签技术被应用于植物表达系统中[4]。 研究表明,融合特定标签的重组蛋白抵抗宿主蛋白水解酶的能力会有所增强[5]。基于这一原理,Ubiquitin[6]、β- 葡萄糖醛酸酶[7]、霍乱毒素B亚基[8]、病毒外壳蛋白[9]和人IgG的α链[10]等被先后用于植物生物反应器中以提高重组蛋白在植物中的积累。此外,一些融合标签的应用也极大地简化了重组蛋白的纯化环节[11-13]。但是,同时具备以上两个功能的蛋白质/多肽标签目前还不多见。
来自丝状真菌瑞氏木霉(Trichoderma reesei)的小分子疏水蛋白质(Hydrophobin,HFBI)具有很高的表面活性,可利用双水相系统(ATPS)被简单地纯化出来[14-18]。另外,HFBI标签也具有提高外源基因在植物中表达水平的作用[19-22]。因此,HFBI是一个理想的双功能植物多肽标签的候选者。进一步研究和评价HFBI在植物表达系统中作用效果、特点和相关作用机制对于推动植物生物反应器的发展具有理论和的实际价值。基于此,以GFP为报道基因,构建了HFBI 融合表达载体。 利用农杆菌渗滤技术,将GFP-HFBI植物表达载体接种植物本明烟(Nicotiana benthamiana)。通过表型、细胞和分子水平的分析,对HFBI 融合标签在植物中表达外源基因的作用效果、特点和可能的作用机制进行了探索。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒农杆菌(Agrobacterium tumefaciens) 菌株GV3101 由本实验室保存;农杆菌二元载体 pCBNoX HC-Pro由本实验室构建保存;农杆菌二元载体pCB302由美国俄勒冈州立大学Valerian V. Dolja实验室惠赠;农杆菌二元载体pJJJ161由加拿大农业与农业食品部Rima Menassa博士惠赠。
1.1.2 植物材料烟草本明烟(Nicotiana benthamiana) 种子由中国检验检疫科学研究院动植物检疫研究所张永江博士提供。
1.1.3 试剂AxygenTM Multisource Total RNA Miniprep Kit购自Axygen BioScience; cDNA合成试剂盒购自北京全式金生物技术有限公司;Anti-GFP兔IgG购自北京博奥森生物技术有限公司;HRP-羊抗兔IgG购自北京中杉金桥生物技术有限公司;ECLWestern Blotting Kit 购自Thermo Pierce; GFP标准品购自BioVision; 其他试剂均为国产分析纯试剂。
1.2 方法 1.2.1 植物表达载体pCBNoX GFP和pJ GFP-HFBI的构建采用基因体外合成和亚克隆技术构建植物表达载体pCBNoX GFP和pJ GFP-HFBI。首先,在金斯瑞生物科技有限公司(南京)合成两端分别有NcoⅠ和XbaⅠ 酶切位点的Pr1b-SP-GFP-KDEL序列,得到重组载体 pUC57-EGFP。用NcoⅠ和XbaⅠ分别双酶切农杆菌二元载体pCB302和克隆载体pUC57-EGFP,分别回收酶切目的片段并经连接、转化和菌落PCR筛选等步骤获得表达载体pCBNoX GFP。采用相同的构建策略,合成Pr1b-SP-GFP-HFBI-KDEL 序列,获得重组载体 pUC57-GFP-HFBI。XhoⅠ和SacⅠ分别双酶切农杆菌二元载体pJJJ161和重组克隆载体pUC57-GFP-HFBI,酶切产物经回收、连接、转化及筛选等步骤获得植物表达载体pJ GFP-HFBI。
1.2.2 重组质粒的农杆菌转化取重组质粒5 μL分别与 95 μL农杆菌GV3101感受态细胞混合,置于冰上1 min 后,进行电击转化;培养后,挑取单菌落进行菌落PCR 鉴定。
1.2.3 农杆菌渗滤(Agro-infiltration)[23]接种烟草植物在温室中培养植物本明烟,培养条件为24 ℃,14 h光照/ 10 h黑暗,相对湿度70%~80%。培育至5~6叶期用于农杆菌渗滤接种实验。将各表达载体的农杆菌菌液分别在LB液体培养基(含50 μg/mL Rif, 50 μg/mL Gen, 50 μg/mL Kan)中28 ℃振荡培养16~18 h。再将菌液按 1∶25转接入10 mL IM培养基(含50 μg/mL Rif, 50 μg/mL Gen, 50 μg/mL Kan, 200 μmol/mL AS)中28 ℃振荡培养至D600值为1.0。离心收集菌体,等体积重悬(10 mmol/L MgCl2,10 mmol/L MES)。再次离心收集菌体,等体积重悬(10 mmol/L MgCl2,10 mmol/L MES,200 μmol/mL AS),温室黑暗静置2~3 h后接种。将pCBNoX GFP和 pJ GFP-HFBI 农杆菌菌悬液分别与pCBNoX HC-Pro 农杆菌菌悬液按1∶1等体积混合。用无针头的1 mL无菌注射器轻轻压入适龄本明烟草叶片背面,每个点接菌量为0.1 mL。
1.2.4 烟草叶片接种部位GFP表达的荧光检测在暗室中,于手持长波紫外灯(Black Ray® B-100AP; UVP,Upland,CA)下对烟草叶片接种部位GFP表达荧光情况观察并用数码相机记录结果。剥取接种叶片下表皮制片,在激光共聚焦显微镜下观察并记录结果。
1.2.5 烟草叶片可溶性总蛋白(TSP)的提取打孔(直径 2 cm)收取烟草叶片样品,称质量后在液氮中研磨烟草叶片。粉末以2.5 mL/g加入蛋白提取缓冲液(50 mmol/L Na3PO4,100 mmol/L NaCl, 10 mmol/L EDTA,0.05% Triton X-100,10 μg/mL亮抑酶肽,pH 7.4)。于4 ℃下放置1.5 h, 12 000×g离心15 min, 取上清-20 ℃保存备用。
1.2.6 Western blotting检测GFP表达量提取的烟草叶片TSP经12.0%的SDS-PAGE后,以Bio-Rad 半干转印仪15 V转移30 min至PVDF膜上。一抗为1∶1000 稀释的Anti-GFP抗体,二抗为1∶5000稀释的HRP标记羊抗兔IgG。
1.2.7 mRNA表达水平的RT-PCR检测分别采收接种后的本明烟叶片0.1 g。用AxygenTM Multisource Total RNA Miniprep Kit提取各样品总RNA。以待测基因的反向引物为反转录引物,用cDNA 合成试剂盒合成 cDNA第1 链并以合成的cDNA为模板分别进行PCR 扩增。引物序列如表 1所示。PCR反应于50 ℃退火温度进行25个循环。反应结束后,琼脂糖凝胶电泳检测扩增产物。
| 表 1 引物序列 Table 1 Sequences of primers |
收取烟草叶片样品,称质量后提取其可溶性总蛋白。以GFP标准样品建立ELISA标准曲线;利用ELISA法对各样品 GFP进行定量,以健康烟草叶片样品为背景扣除。
2 结果 2.1 pCBNoX GFP和pJ GFP-HFBI载体的构建及其共表达载体pCBNoX HC-Pro采用基因体外合成和亚克隆技术分别构建了2个以绿色荧光蛋白GFP为报道基因的植物表达载体(图 1)。pJ GFP-HFBI是GFP的C末端与HFBI标签融合表达的载体;对照pCBNoX GFP为表达gfp基因的植物表达载体。两个表达载体的表达盒均位于农杆菌二元载体左右边界之间,因此可以利用农杆菌渗滤技术接种寄主植物,通过比较它们在植物中表达外源基因的积累变化情况,探索HFBI标签在植物中表达外源基因的效果及特点。此外,RNA沉默普遍存在于真核生物中。为了客观地评价HFBI标签在植物中表达外源基因的潜力,将两载体分别与表达烟草蚀纹病毒(TEV)编码的 RNA沉默抑制子HC-Pro[24]的载体pCBNoX HC-Pro共接种植物,以规避RNA沉默造成的外源基因表达的抑制,回避对HFBI标签技术比较评价时由于RNA沉默带来的干扰作用。
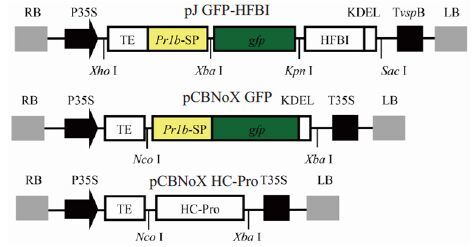
|
图 1 实验中使用的表达载体结构示意图 Figure 1 Schematic representation showing the T-DNA region of the various Genetic constructs used in this study. RB: Right borders of the T-DNA; P35S: 35S promoter of Cauliflower mosaic virus (CaMV); TE: Translational enhancer of Tobacco etch virus (TEV); Pr1b-SP: Pr1b tobacco secretory signal peptide; gfp: GFP coding sequence; KDEL: ER retention signal; T35S: CaMV transcription terminator; HFBI: hydrophobin Gene; TvspB: Soybean vegetative storage protein terminator; HC-Pro: TEV encoded HC-Pro Gene; LB: Left borders of the T-DNA. Boxes are not drawn to scale. |
将 pCBNoX GFP和pJ GFP-HFBI重组农杆菌菌悬液分别与RNA沉默抑制子载体pCBNoX HC-Pro重组菌菌悬液等体积混合接种于适龄本明烟植株同一叶片主叶脉的左右两边,接种位置如图 2A所示。
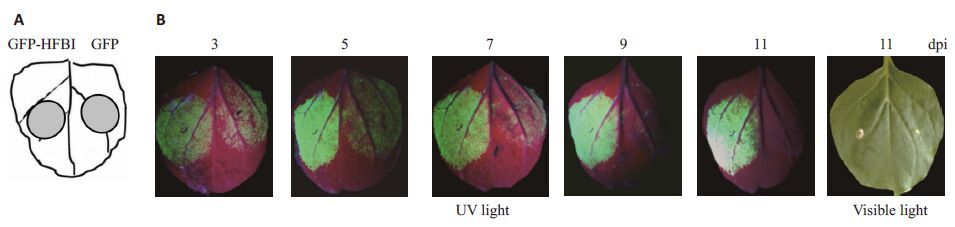
|
图 2 接种叶片GFP表达荧光变化情况 Figure 2 Change of GFP fluorescence intensity in the leaves of N. benthamiana plants after agroinfiltration with GFP (right) and GFP-HFBI (left) constructs. Constructs were infiltrated at different areas on a leaf (A) and photographs were taken under UV or visible light at different days post-inoculation (dpi) (B). |
于接种后第3 ~11天间每隔两天在长波紫外光和可见光下对叶片接种部位进行观察。结果显示,在长波紫光外下,接种载体pCBNoX GFP和pJ GFP- HFBI的叶片,在接种后的观察期中均可在叶片接种部位观察到 GFP荧光信号。载体pCBNoX GFP在接种的本明烟叶片上在第5天表现出的荧光信号最强。随着时间的递增,荧光信号逐渐变弱。在接种后第11天,只能观察到微弱的GFP荧光信号(图 2B)。载体pJ GFP-HFBI在叶片接种部位的GFP荧光信号在接种前期(接种后第3~5 天)表现为明星的增强趋势;接种后期(接种后第7~11 天)的荧光信号则趋于平稳,无明显的下降趋势(图 2B)。在实验观察期内,载体pJ GFP-HFBI叶片接种部位的荧光信号均强于pCBNoX GFP载体(图 2B)。实验结果初步证明,HFBI标签可以有效地提高外源基因在植物中的表达积累水平。在自然光下,至接种后第11 天,接种载体pCBNoX GFP和pJ GFP-HFBI在叶片接种部位均无明显的褪绿、坏死等症状。初步说明,HFBI 标签对植物没有明显的细胞毒性。
2.2.2 接种叶片表皮细胞中GFP表达的荧光观察为了验证植物表型观察结果,取接种后不同时间的叶片接种部位制片,在激光共聚焦显微镜下观察表皮细胞中表达的GFP的荧光变化情况。结果显示,在接种部位均能观察到明显的绿色荧光信号,且pJ GFP-HFBI在接种部位的荧光信号强度和范围要强或大于接种pCBNoX GFP 产生的荧光信号(图 3)。激光共聚焦显微镜观察实验结果与接种叶片表型观察结果(图 2B)一致。细胞水平上的观察结果进一步验证和证实,HFBI标签在外源基因表达效率和产物积累上均优于传统的瞬时表达载体。
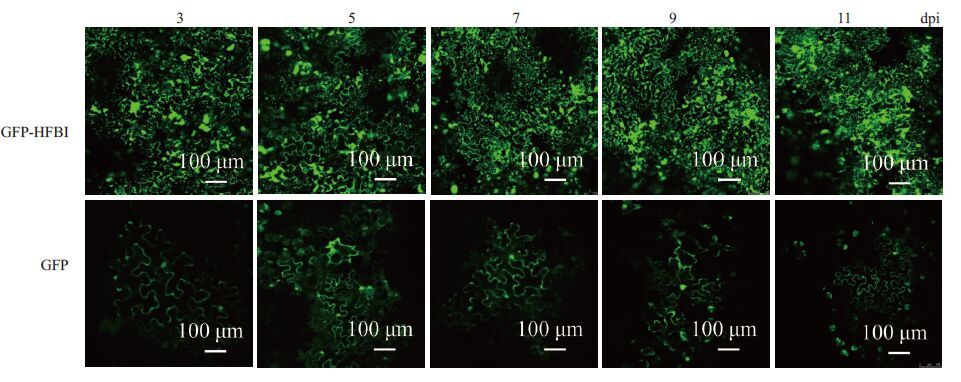
|
图 3 接种叶表皮细胞中GFP表达的荧光观察 Figure 3 Confocal laser scanning microscopy of N. benthamiana epidermal cells expressing GFP (lower channel) and GFP-HFBI (upper channel) at different days post-inoculation (dpi). |
于接种后不同时间采收并提取各处理样品的可溶性总蛋白。以健康烟草叶片和GFP 标准样品为对照,对不同处理表达的GFP 进行 SDS-PAGE和Western blotting分析。
SDS-PAGE结果显示(图 4A),与健康烟草叶片样品相比,pCBNoX GFP 载体处理不同时间的样品在 27 000 处均有一条与GFP标准蛋白大小一致的差异蛋白质条带;载体pJ GFP-HFBI不同时间的样品均在 37 000 处有明显的差异性蛋白条带。GFP 抗体的 Western blotting结果表明(图 4A),与GFP标准样品一样,27 000和37 000的蛋白差异条带均可以与GFP抗体发生免疫反应。结果证明,27 000和37 000的差异性条带确为目的表达产物GFP与GFP-HFBI。两载体目的表达产物相对分子质量大小的差异是由于HFBI自身相对分子质量为10 000造成的。从GFP条带的灰度变化(以考马斯亮蓝染色的Rubisco蛋白大亚基作为上样量标准)可知,pCBNoX GFP载体表达的外源基因产物在植物细胞中呈现先上升再下降的趋势;载体pJ GFP-HFBI的表达产物的积累而表现为相对平稳的趋势。实验结果与叶片表型和细胞水平观测结果的规律基本一致。结果进一步证实,HFBI标签对外源基因在植物中的表达有显著的增效作用。
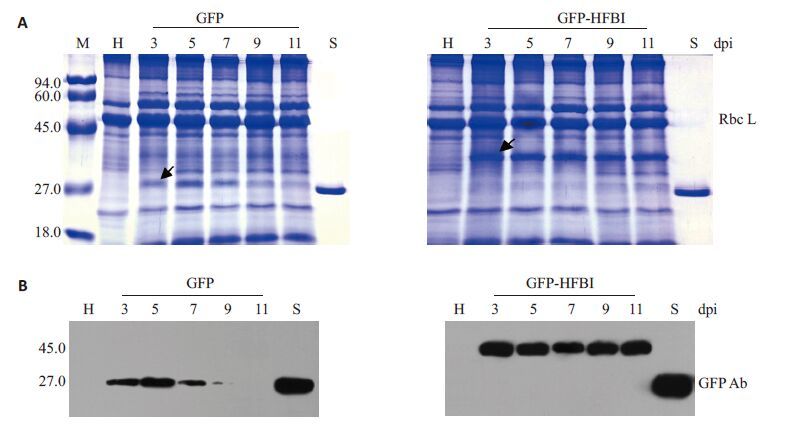
|
图 4 SDS-PAGE和Western blotting检测接种叶片GFP和GFP-HFBI蛋白表达情况 Figure 4 SDS-PAGE (A) and Western blotting (B) analysis showing GFP and GFP-HFBI expression levels in N. benthamiana leaves at different days post-inoculation (dpi). |
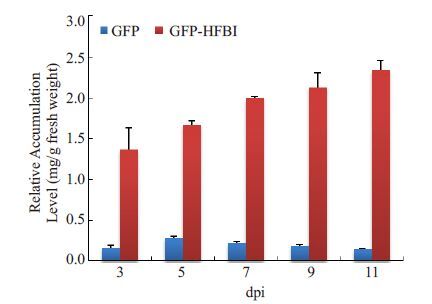
为了进一步明确植物中表达的GFP与GFP-HFBI的时间变化规律,分别收取健康叶片及接种pCBNoX GFP 和pJ GFP-HFBI载体的不同时间段的烟草接种叶片,提取可溶性总蛋白,以健康叶片为背景扣除,对各样品做 ELISA定量分析。ELISA结果显示,表达GFP的样品在接种后第5天表达量达到最高(0.34 mg/g鲜叶),随后呈下降趋势;表达GFP-HFBI的样品在接种后第3天就有较高的表达量(1.42 mg/g鲜叶),此后随着时间的递增,表达量缓慢增加(接种后第11天的表达量为2.31 mg/g 鲜叶)。GFP-HFBI的表达量在各个时间段均显著高于 GFP(图 5)。
|
图 5 GFP和GFP-HFBI在烟草中表达的ELISA分析 Figure 5 ELISA analysis of relative expression levels of GFP and GFP-HFBI at different days post-inoculation (dpi). |
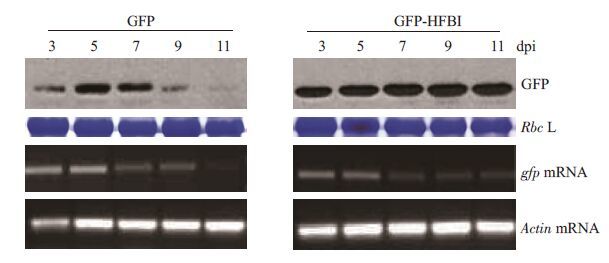
为了进一步探讨HFBI技术提高外源基因GFP 在植物中积累水平的可能原因,在 mRNA和蛋白质水平,对烟草中GFP和GFP-HFBI不同时期表达积累水平同时进行比较分析。从GFP在烟草中不同时期的表达变化情况来看,在蛋白质水平上,GFP在烟草细胞中的表达量在接种后第5天达到最高,随后随时间延长逐渐递减;其mRNA的变化规律与蛋白质水平类似(图 6),这也与生物体内大多数基因的表达变化规律一致。从GFP-HFBI在烟草中不同时期的表达变化情况来看,在蛋白质水平上,从接种后第3 天始,HFBI-GFP在烟草细胞中的表达量随后随时间延长持续保持在一个较高的水平;而其mRNA则在接种后第5天达到最高,随后随时间延长逐渐下降(图 6)。通过以上mRNA和蛋白质水平的比较分析,推测HFBI标签的功能不是通过提高mRNA的表达量或稳定性来实现的,而作用于蛋白质水平。
|
图 6 接种叶片中GFP和GFP-HFBI蛋白以及相应mRNA表达水平分析 Figure 6 Analysis of GFP protein (left) and GFP mRNA (right) accumulation levels in the absence or presence of a HFBI fusion at different days post-inoculation (dpi). Coomassie blue staining of the large subunit of Rubisco (Rbc L) and RT-PCR of Actin mRNA served as loading controls respectively. |
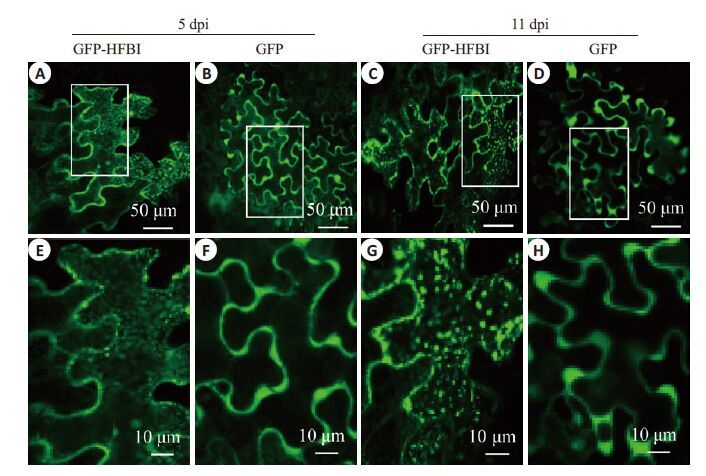
收取接种后第5 天和第11 天的GFP和HFBI-GFP 样品,在激光共聚焦显微镜观察外源基因表达的情况。 结果显示,表达的GFP-HFBI融合蛋白在烟草细胞内形成了致密的绿色颗粒,而表达的GFP的烟草细胞内仅见均匀的绿色荧光信号而没有颗粒状物体(图 7)。结果表明,HFBI融合蛋白可以在植物细胞内形成不溶性的蛋白质颗粒。结合GFP-HFBI融合蛋白在植物细胞内持续积累的时间变化规律,推测形成的蛋白质颗粒在一定程度上隔绝了宿主细胞内源性蛋白酶对表达产物的降解,从而实现外源基因表达产物在细胞内的长期持续积累。
|
图 7 接种GFP和GFP-HFBI载体叶片的亚细胞水平分析 Figure 7 Confocal images showing accumulated GFP-HFBI or GFP in the leaf epidermal cells at 5 and 11 days post-inoculation (dpi). A,B,C,D: Leaf epidermal cells accumulating GFP-HFBI or GFP at 5 and 11 dpi respectively. E,F,G,H: Higher magnification images of the insets in the corresponding figure A,B,C,D. |
利用植物作为生物反应器表达外源基因目前需要解决表达量相对较低[25]和下游纯化技术相对繁杂[18]等两个关键问题。作为多肽融合标签,源于瑞氏木酶的小分子疏水蛋白HFBI具有同时解决上述两个问题的潜力。因此,实验以GFP作为报告基因,对HFBI作为多肽标签在植物表达系中的作用效果、特点和相关机制进行初步的研究,为HFBI在植物生物反应器中的进一步应用奠定基础。
从实验的结果来看,与对照相比(GFP组),HFBI作为多肽融合标签可以有效地提高外源基因在植物烟草中的表达积累水平且对宿主细胞无明显的细胞毒性。 在实验的观察期内,其最高表达量可达到2.31 mg/g鲜叶。表达量与目前大多数植物病毒载体表达系统的表达量相当[26]。由于植物病毒载体表达系统对插入其基因组的外源基因片段的大小有限制,而理论上非病毒的植物瞬时表达体系没有外源基因片段大小的限制,因而在大片段外源基因的表达上HFBI多肽融合标签技术具有一定的潜在优势。从当前的实验来看,HFBI多肽融合标签也不影响与其融合的外源基因的生物学活性(融合的GFP基因仍然具有荧光活性),因此具有一定的应用潜能。
从外源基因表达的时间变化规律来看,外源基因的表达量随着时间的变化持续上升;而对照(传统瞬时植物表达载体pCBNoX GFP)则表现为先上升后下降的典型蛋白质表达规律。同时mRNA的相对定量分析显示,HFBI多肽融合标签mRNA的表达水平随着时间的延长呈下降趋势;对照样品的mRNA的表达水平的变化规律也与之相近。因此,认为HFBI是在蛋白质水平而不是mRNA水平发挥作用来提高外源基因在植物烟草中的表达水平。进一步从细胞水平的观察来看,HFBI融合表达的GFP烟草叶片细胞中可以看到大量致密的绿色荧光蛋白颗粒,而对照组则观察不到此现象。 由于HFBI本身具有疏水和易聚集的特性[18-19],推测融合表达产物易于在细胞内形成不溶性的聚集物,进而在一定程度上隔绝了宿主细胞内源性蛋白酶对表达产物的降解,从而实现外源基因表达产物在细胞内的长期持续积累。其产物积累机制类似于细菌表达系统中形成的包涵体的保护作用,但是又不完全相同。细菌包涵体在体外难以溶解,而HFBI融合蛋白颗粒则在细胞破裂时易于溶解[18-19, 21]。因此,在下游纯化过程中HFBI融合蛋白无需变复性前处理过程,分离产物可直接进行纯化。
此外,植物特有糖基化也是利用植物生物反应器时需要考虑的问题[27-28]。HFBI形成的蛋白质颗粒主要富集在内质网表面[19],理论上其内质网截留效率远远高于 K/HDEL内质网截留,因此可更好得避免高尔基体对表达产物进行的植物特有糖基化。另外,HFBI无细胞毒性和强免疫原性[29],可以直接使用在食品和医学中[30]。 因此,认为HFBI技术在植物生物反应器领域具有巨大的应用潜能。
| [1] | Redkiewicz P, Sirko A, Kamel KA, et al. Plant expression systems for production of hemagglutinin as a vaccine against influenza virus[J]. Acta Biochim Pol, 2014, 61 (3): 551-60. |
| [2] | Virdi V, Depicker A. Role of plant expression systems in antibody production for passive immunization[J]. Int J Dev Biol, 2013, 57 (6/8): 587-93. |
| [3] | Mortimer CL, Dugdale B, Dale JL. Updates in inducible transgene expression using viral vectors: from transient to stable expression[J]. Curr Opin Biotechnol, 2015, 32 (8): 85-92. |
| [4] | Bell MR, Engleka MJ, Malik A, et al. To fuse or not to fuse:what is your purpose[J]. Protein Sci, 2013, 22 (11): 1466-77. DOI: 10.1002/pro.v22.11. |
| [5] | Waugh DS. Making the most of affinity tags[J]. Trends Biotechnol, 2005, 23 (6): 316-20. DOI: 10.1016/j.tibtech.2005.03.012. |
| [6] | Mishra S, Yadav DK, Tuli R. Ubiquitin fusion enhances cholera toxin B subunit expression in transgenic plants and the plantexpressed protein binds GM1 receptors more efficiently[J]. J Biotechnol, 2006, 127 (1): 95-108. DOI: 10.1016/j.jbiotec.2006.06.002. |
| [7] | Dus Santos MJ, Wigdorovitz A, Trono K, et al. A novel methodology to develop a foot and mouth disease virus (FMDV) peptide-based vaccine in transgenic plants[J]. Vaccine, 2002, 20 (7/8): 1141-7. |
| [8] | Kim TG, Ruprecht R, Langridge WH. Synthesis and assembly of a cholera toxin B subunit SHIV 89.6p Tat fusion protein in transgenic potato[J]. Protein Expr Purif, 2004, 35 (2): 313-9. DOI: 10.1016/j.pep.2004.02.007. |
| [9] | Cañizares MC, Nicholson L, Lomonossoff GP. Use of viral vectors for vaccine production in plants[J]. Immunol Cell Biol, 2005, 83 (3): 263-70. DOI: 10.1111/icb.2005.83.issue-3. |
| [10] | Obregon P, Chargelegue D, Drake PM, et al. HIV-1 p24- immunoglobulin fusion molecule: a new strategy for plant-based protein production[J]. Plant Biotechnol J, 2006, 4 (2): 195-207. DOI: 10.1111/pbi.2006.4.issue-2. |
| [11] | Streatfield SJ. Approaches to achieve high-level heterologous protein production in plants[J]. Plant Biotechnol J, 2007, 5 (1): 2-15. DOI: 10.1111/pbi.2007.5.issue-1. |
| [12] | Rubio V, Shen Y, Saijo Y, et al. An alternative tandem affinity purification strategy applied to Arabidopsis protein complex isolation[J]. Plant J, 2005, 41 (5): 767-78. DOI: 10.1111/tpj.2005.41.issue-5. |
| [13] | Lichty JJ, Malecki JL, Agnew HD, et al. Comparison of affinity tags for protein purification[J]. Protein Expr Purif, 2005, 41 (1): 98-105. DOI: 10.1016/j.pep.2005.01.019. |
| [14] | Linder MB. Hydrophobins: proteins that self assemble at interfaces[J]. Curr Opin Colloid Interface Sci, 2009, 14 (5): 356-63. DOI: 10.1016/j.cocis.2009.04.001. |
| [15] | Wösten HA, Scholtmeijer K. Applications of hydrophobins: current state and perspectives[J]. Appl Microbiol Biotechnol, 2015, 99 (4): 1587-97. DOI: 10.1007/s00253-014-6319-x. |
| [16] | Linder M, Selber K, Nakari-Setälä T, et al. The hydrophobins HFBI and HFBII from Trichoderma reesei showing efficient interactions with nonionic surfactants in aqueous two-phase systems[J]. Biomacromolecules, 2001, 2 (2): 511-7. DOI: 10.1021/bm0001493. |
| [17] | Linder MB, Qiao M, Laumen F, et al. Efficient purification of recombinant proteins using hydrophobins as tags in surfactantbased two-phase systems[J]. Biochemistry, 2004, 43 (37): 11873-82. DOI: 10.1021/bi0488202. |
| [18] | Joensuu JJ, Conley AJ, Linder MB, et al. Bioseparation of recombinant proteins from plant extract with hydrophobin fusion technology[J]. Methods Mol Biol, 2012, 824 (7): 527-34. |
| [19] | Joensuu JJ, Conley AJ, Lienemann M, et al. Hydrophobin fusions for high-level transient protein expression and purification in Nicotiana benthamiana[J]. Plant Physiol, 2010, 152 (2): 622-33. DOI: 10.1104/pp.109.149021. |
| [20] | Reuter LJ, Bailey MJ, Joensuu JJ, et al. Scale-up of hydrophobinassisted recombinant protein production in tobacco BY-2 suspension cells[J]. Plant Biotechnol J, 2014, 12 (4): 402-10. DOI: 10.1111/pbi.2014.12.issue-4. |
| [21] | Jacquet N, Navarre C, Desmecht D, et al. Hydrophobin fusion of an influenza virus hemagglutinin allows high transient expression in Nicotiana benthamiana, easy purification and immune response with neutralizing activity[J]. PLoS One, 2014, 9 (12): e115944. DOI: 10.1371/journal.pone.0115944. |
| [22] | Phan HT, Hause B, Hause G, et al. Influence of elastin-like polypeptide and hydrophobin on recombinant hemagglutinin accumulations in transgenic tobacco plants[J]. PLoS One, 2014, 9 (6): e99347. DOI: 10.1371/journal.pone.0099347. |
| [23] | Velásquez AC, Chakravarthy S, Martin GB. Virus-induced gene silencing (VIGS) in Nicotiana benthamiana and tomato[J]. J Vis Exp, 2009 (28): 1-4. |
| [24] | Anandalakshmi R, Gj P, Ge X, et al. A viral suppressor of gene silencing in plants[J]. Proc Natl Acad Sci USA, 1998, 95 (22): 13079-84. DOI: 10.1073/pnas.95.22.13079. |
| [25] | Desai PN, Shrivastava N, Padh H. Production of heterologous proteins in plants: strategies for optimal expression[J]. Biotechnol Adv, 2010, 28 (4): 427-35. DOI: 10.1016/j.biotechadv.2010.01.005. |
| [26] | Gleba Y, Klimyuk V, Marillonnet S. Viral vectors for the expression of proteins in plants[J]. Curr Opin Biotechnol, 2007, 18 (2): 134-41. DOI: 10.1016/j.copbio.2007.03.002. |
| [27] | Daskalova SM, Radder JE, Cichacz ZA, et al. Engineering of N. benthamiana L. plants for production of N-acetylgalactosamineglycosylated proteins-towards development of a plant-based platform for production of protein therapeutics with mucin type O-glycosylation[J]. BMC Biotechnol, 2010, 10 (4): 62. |
| [28] | Yang Z, Drew DP, JØrgensen B, et al. Engineering mammalian mucin-type O-glycosylation in plants[J]. J Biol Chem, 2012, 287 (15): 11911-23. DOI: 10.1074/jbc.M111.312918. |
| [29] | Wösten HA. Hydrophobins: multipurpose proteins[J]. Annu Rev Microbiol, 2001, 55 (9): 625-46. |
| [30] | Scholtmeijer K, Wessels JG, Wösten HA. Fungal hydrophobins in medical and technical applications[J]. Appl Microbiol Biotechnol, 2001, 56 (1/2): 1-8. |
 2015, Vol. 35
2015, Vol. 35

