2. 福建医科大学护理学院,福建 福州 350005
2. Nursing College of Fujian Medical University,Fuzhou 350005,China
Kiss-1基因是多种恶性肿瘤转移抑制基因[1-2],本课题组前期研究[3-4]证实Kiss-1基因亦能抑制结直肠癌的转移能力,但具体机制尚未明确。基因对肿瘤细胞的调控是通过各种信号传导通路的信息传递实现的,NF-κB信号传导通路参与包括结直肠癌在内的多种恶性肿瘤侵袭和转移的调节过程[5-7],而这一过程是否与Kiss-1基因的肿瘤转移抑制功能有关未见文献报道,本研究将对其进行探讨。
1 材料与方法 1.1 实验材料人结直肠癌HCT116细胞由本实验室保存,脂质体LipofectamineTM2000、三质粒慢病毒包装系统:慢病毒表达载体pGC-LV-EGFP、包装质粒pHelper 1.0 和pHelper 2.0,购于Invitrogen 公司,慢病毒载体测序及qRT-PCR引物的设计与合成由上海吉凯基因化学技术有限公司完成。
1.2 实验试剂与耗材胎牛血清、PRMl 1640 培养基、0.25%胰酶购于美国GIBCO公司;浓缩型鼠抗人I-κB多克隆抗体、浓缩型兔抗人MMP-9多克隆抗体、浓缩型鼠抗人GAPDH单克隆抗体购于美国Cell signaling公司;RT-PCR试剂盒购于TaKaRa公司;CCK8(Cell Counting Kit-8)试剂盒购于江苏碧云天生物技术研究公司;Transwell小室购于美国Corning公司;Matrigel基质胶购于美国BD生物技术公司。
1.3 方法 1.3.1 慢病毒载体pGC-LV-Kiss-1-EGFP的构建和病毒包装Kiss-1基因CDS区全长共438 bp,以人类基因组DNA 为模板,设计上下游引物,上游引物:5'TACTGCTTTTCCTCTGTGCCACC3',下游引物:5'TAGCTGCTGGCCTGTGGGTCT3'。扩增产物89 bp。反应条件94 ℃ 5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 2 min,30个循环;72 ℃延伸10 min。PCR产物进行纯化回收后,与慢病毒载体pGC-LV-EGFP分别进行AgeⅠ酶切,酶切片段回收、T4 DNA连接酶连接后转化感受态大肠杆菌。选取单个菌落进行PCR鉴定PCR阳性克隆送至上海吉凯公司进行测序鉴定,测序结果与GeneBank数据库进行Blast 比对以证明慢病毒表达载体pGCLV-Kiss-1-EGFP构建成功。用脂质体LipofectamineTM2000包裹慢病毒三质粒系统(LV-EGFP、pHelper 1.0和pHelper2.0)在无血清Opti-MEM 培养基中5% CO2、37 ℃孵育箱内共转染HCT116细胞,以进行病毒包装。
1.3.2 最佳感染复数(Multiplicity of infection,MOI)的测定最佳感染复数(Multiplicity of infection,MOI)的测定将处于对数生长期的HCT116细胞接种于96孔培养板中,每孔约3~5×103细胞,加入90 μL,每次实验6个孔,分2组进行,每组均有3个不同梯度的MOI。将10 μL的1×106 TU、1×105 TU、1×104 TU 3 个不同梯度的病毒加到每组相应的孔中,细胞数目生长至约1×104个/孔,每组3个孔的MOI值分别为100、10、1。感染72 h后,观察增强型绿色荧光蛋白(EGFP)的表达情况,通过感染效果确认感染条件和感染参数。
1.3.3 细胞感染将HCT116细胞接种于24孔板中,每孔约2~5×103个细胞。感染前将病毒置于37 ℃水浴中迅速冻融,37 ℃新鲜培养基稀释病毒至所需要浓度,摇匀。吸去细胞原有培养基,将稀释好的病毒液加入到细胞培养孔中,设置相应的空白对照组(未转染病毒的空细胞)及空载体阴性对照组(仅含慢病毒载体),37 ℃、5% CO2细胞培养箱中培养,24 h更换新鲜培养基,继续培养至72 h检测病毒感染情况。
1.3.4 转染效率的鉴定 1.3.4.1 荧光显微镜下观察转染后细胞用无血清1640培养基洗涤2~3次,荧光显微镜观察,随机选取20个视野进行阳性细胞计数,以同一视野下荧光显微镜与普通显微镜观察到的细胞数之比计算转染率,即转染率=(发出绿色荧光的细胞数/总细胞数)×100%。
1.3.4.2 转染后Kiss-1基因mRNA水平的测定收集转染后的细胞,用TRIzol试剂提取细胞总RNA,紫外分光光度计检测RNA的浓度及纯度,提取2 μg RNA,反转录酶M-MLV 将RNA 反转录为cDNA。ABI 7500Taqman Real-time PCR 反应仪检测Kiss-1、GAPDHmRNA的扩增情况。反应体系为20 μL,SYBR premixex taq 10.0 μL,上游引物(2.5 μmol/L)0.5 μL,下游引物(2.5 μmol/L)0.5 μL,cDNA1.0 μL,RNase-Free H2O8.0 μL。反应参数:95°C 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环,每个样品均设3个复孔。进行荧光定量PCR反应,最后做溶解曲线,确定反应的特异性。当各样本cDNA稀释倍数为5倍时,靶基因、内参基因达到阈值的循环数均在10~30之间,并以此浓度进行SYBR Green实时定量PCR反应。相对表达量RQ=2-ΔΔCt。计算方法:ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=待测组ΔCt平均值-对照组ΔCt平均值(表 1)。
| 表 1 qRT-PCR法Kiss-1、GAPGH的引物序列 Table 1 Primer sequence of Kiss-1 and GAPGH for qRT-PCR |
收集各组细胞,加入细胞裂解液提取总蛋白,CAB法定量蛋白。每个样品以150 μg总蛋白上样进行SDSPAGE分离蛋白,电泳后转移至PVDF膜上,5%脱脂奶粉溶液封闭1 h,加入适量一抗稀释液(I-κB按1∶800、MMP-9按1∶500、GAPDH按1∶1000),4 ℃孵育过夜,取出PVDF膜,TBST浸洗2~3 次,加入1∶2000 稀释的二抗,37 ℃孵育1 h,灭菌纯化水漂洗后甩干,按说明书进行曝光。
1.3.6 CCK-8法检测转染后各组细胞增殖能力变化取对数生长期的各组细胞,胰酶消化后接种于96孔板中,细胞密度约为6×104/mL,每孔100 μL。每组均设3个复孔,培养箱中培养,每24 h更换新鲜培养基,分别在24、48、72、96 h进行CCK-8检测;吸去上清,加入等体积基础培养液(其中含10 μL/孔CCK-8 检测液),继续培养4 h后,在酶联免疫检测仪波长为450 nm处各孔吸光度值D(450 nm)。
1.3.7 Transwell 小室侵袭实验加入50 μL ECM胶于Transwell小室上室,放入37 ℃培养箱中,孵育4~6 h 使其凝结成胶状;胰酶消化各组细胞,1500 r/min 离心2 min,无血清培养基吹打细胞并重悬制成2.5×105/mL单细胞悬液,取200 μL细胞悬液加入Transwell内室,即每孔约细胞5×104;Transwell 外室中加入600 μL 含10% FBS条件培养基,内外两室液面高度接近一致;37 ℃培养箱中继续培养24~26 h。将小室取出并吸去小室内液体,小心擦去基质胶和未穿膜的细胞,4%多聚甲醛固定15 min,PBS 洗涤,室温风干,结晶紫染色15~20 min后PBS洗涤,风干后置于200倍双目倒置显微镜下观察。
1.3.8 Transwell小室迁移实验实验步骤基本与侵袭实验一致,迁移实验Transwell 上室不需要铺ECM基质胶,细胞数为1×106/mL,即每孔约2×105,下室为含5%FBS的完全培养基。
1.4 统计学分析统计数据采用SPSS19.0 软件分析,计量资料均以均数±标准差表示,组间两两比较时先进行多样本方差齐性检验,若方差齐,运用LSD-t检验;若方差不齐,则运用Dunnett's T3法进行检验。P<0.05为差异有统计学意义。
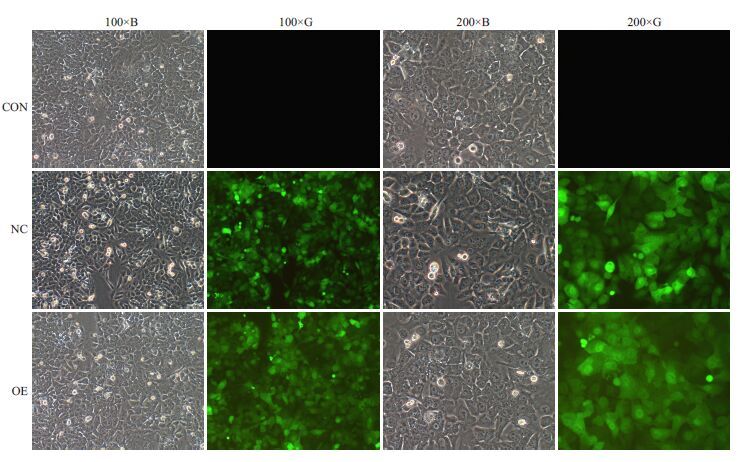
2 结果 2.1 转染结果的鉴定 2.1.1 荧光显微镜下观察转染效率成功转染慢病毒pGC-LV-Kiss-1-EGFP的HCT116人结直肠癌细胞可以表达绿色荧光蛋白,经测得在病毒最佳感染复数MOI=10.00时,即加入病毒量为1×105 TU时转染效率最佳。CON组在荧光显微镜下未见绿色荧光蛋白的表达,OE组与NC组均有EGFP绿色荧光蛋白表达且荧光率均>80%,表明转染成功(图 1,表 2)。
|
图 1 慢病毒(Kiss-1基因)转染后各细胞EGFP蛋白荧光表达率 Figure 1 Expression rate of EGFP in cells transfected with Kiss-1 gene. CON: Blank control; NC: Negtive control; OE: Overexpression. |
| 表 2 各组细胞转染后EGFP蛋白荧光率鉴定 Table 2 Identification of EGFP expression rate in transfected cells |
qRT-PCR结果显示:OE 组Kiss-1 基因mRNA 相对表达水平(122.61±6.14)是CON组(0.49±0.08)的248.21 倍、NC组(0.60±0.03)的204.02 倍,差异均有统计学意义(P<0.05),而CON组与NC组之间无统计学差异。
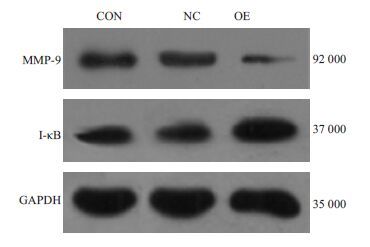
2.2 Western-blot 检测Kiss-1 基因转染前后I-kB、MMP-9 的表达结果显示,转染Kiss-1基因后OE组I-κB 表达水平与CON组及NC组相比显著升高,MMP-9表达水平与CON组及NC组相比显著降低,差异均有统计学意义(P<0.05)。NC组与CON组相比均无差异。MMP-9表达量随I-kB表达升高而降低(图 2、表 3)。
|
图 2 Kiss-1转染后各组细胞目的蛋白I-κB、MMP-9免疫印迹图 Figure 2 Expression of I-κB and MMP-9 in cellstransfected with Kiss-1 gene. |
| 表 3 Kiss-1基因转染后各组细胞I-κB和MMP-9蛋白表达水平的灰度值 Table 3 Gray scale of the protein bands of I-κB and MMP-9 inWestern blotting in different groups |
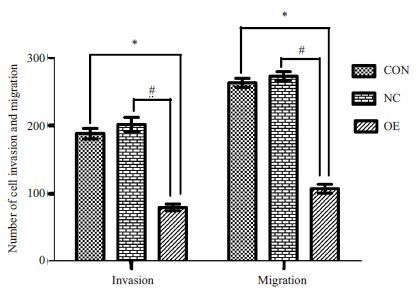
Kiss-1 基因转染HCT116 细胞后,OE 组与CON组、NC组相比细胞增殖能力在24、48、72、96 h均受到明显抑制,差异有统计学意义(P<0.05,表 4)。
| 表 4 侵袭和迁移实验统计图注 Table 4 Statistical graph of invasion and migration assay. *P<0.05 vs CON group. #P<0.05 vs NC group. |
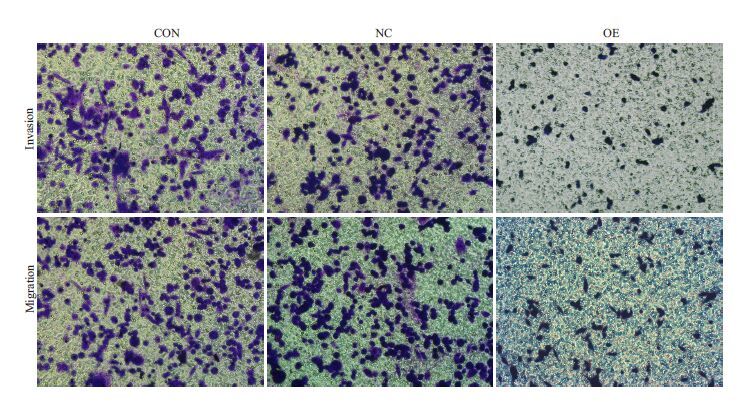
慢病毒转染后,OE组穿膜细胞数与CON组和NC组相比,穿膜细胞数明显减少,差异均具有统计学意义(P<0.05,图 3、4)
|
图 3 Kiss-1基因转染后三株细胞侵袭和迁移能力的变化 Figure 3 Change of invasive and migration ability of the cells after transfection with Kiss-1 gene. |
|
图 4 侵袭和迁移实验统计图注 Figure 4 Statistical graph of invasion and migration assay. *P<0.05 vs CON group. #P<0.05 vs NC group. |
我们前期研究[8-10]发现,结直肠癌血行转移等恶性演进过程与肿瘤转移抑制基因Kiss-1基因表达下调密切相关,而其表达水平上调可抑制结直肠癌细胞的增殖、侵袭和迁移能力。
本研究通过构建pGC-LV-Kiss-1-EGFP 慢病毒载体并转染结直肠癌HCT116 细胞,使其Kiss-1 基因过表达后发现NF-κB 信号传导通路中抑制性蛋白I-κB的表达明显升高,同时其下游效应蛋白MMP-9 表达明显降低。MMP-9 是基质金属蛋白酶家族的重要成员,具有降解细胞外基质和降低细胞粘附性的功能,能够促进肿瘤细胞的侵袭和转移[11]。与此同时,CCK-8 和Transwell 小室实验结果表明Kiss-1 基因转染后HCT116 细胞的增殖能力、侵袭和迁移能力均受到明显的抑制。因此推测结直肠癌细胞中Kiss-1 基因有可能也是通过上调I-κB蛋白的表达抑制NF-κB信号通路的激活,抑制p50 和p65 亚基进入胞核,减少与MMP-9 启动子的结合,下调MMP-9 的表达,进而减少ECM的降解和增加细胞之间的粘附效应,从而抑制结直肠癌细胞的侵袭和迁移能力。恶性肿瘤的转移需要多种信号通路参与和调控,NF-κB通路即是其中之一[5-6],在结直肠癌中参与调控血管内皮生长因子和MMP-9 的表达,促进肿瘤转移[7, 12]。在乳腺癌[13]中,通过干扰NF-κB与MMP-9 的启动子区的结合,MMP-9 在乳腺癌细胞中表达的下调,降低了细胞的侵袭、迁移能力。Huang 等[14]研究显示,NF-κB 途径受到抑制后,高转移性前列腺癌PC23 细胞的侵袭、转移能力亦受到明显抑制。张辉等[15]通过合成Kiss-1 基因特异性siRNA 转染肾癌Caki-1 细胞的研究显示,Kiss-1 基因能够通过NF-κB途径抑制MMP-9的表达,增加细胞的粘附性进而抑制肾癌细胞的侵袭和迁移能力。这些研究表明NF-κB信号传导通路参与了Kiss-1 基因抑制肿瘤转移的过程,与本研究结果相似。
综上所述,本研究初步证实肿瘤转移抑制基因Kiss-1 可以通过NF-κB信号传导通路参与抑制结直肠癌血行转移等恶性演进过程。然而,结直肠肿瘤转移涉及十分复杂的分子生物学机制,Kiss-1 基因抑制结直肠癌转移很可能与其他信号传导有关,还需要进一步的深入研究,这对揭示结直肠癌转移机制、寻找阻断转移的发生是十分有益的。
| [1] | Cho SG, Li D, Stafford LJ, et al. Kiss-1 suppressesTNF alpha- induced breast cancer cell invasion via aninhibaition of Rho A-Mediated NF-κB activation[J]. Cell Biochem, 2009, 107 (6): 1139-49. DOI: 10.1002/jcb.v107:6. |
| [2] | Cebrián V, Fierro M, Orenes-Piñero E, et al. KISS-1 methylationand expression as tumor stratification biomarkers and clinicaloutcome prognosticators for bladder cancer patients[J]. Am JPathol, 2011, 179 (2): 540-6. |
| [3] | 陈绍勤, 林素勇, 戴起宝, 等. 肿瘤转移抑制基因Kiss-1对构建原代人结直肠癌裸鼠肝转移瘤模型的影响[J]. 中华实验外科学, 2012, 29 (2): 209-11. |
| [4] | 陈绍勤, 涂明美, 戴起宝, 等. 结直肠癌细胞Kiss-1基因表达在X线照射后的变化及其与肿瘤细胞增殖与凋亡的关系[J]. 中华胃肠外科杂志, 2012, 15 (5): 508-11. |
| [5] | Zubair A, Frieri M. Role of nuclear factor-kappa B in breast andcolorectal cancer[J]. Curr Allergy Asthma Rep, 2013, 13 (1): 44-9. DOI: 10.1007/s11882-012-0300-5. |
| [6] | Wu Y, Zhou BP. TNF-a/NF-B/snail pathway in cancer cell migrationand invasion[J]. Br J Cancer, 2010, 102 (4): 639-44. DOI: 10.1038/sj.bjc.6605530. |
| [7] | Horst D, Budczies J, Brabletz T, et al. Invasion associated Up-Regulation of nuclear factor kappa B target genes in colorectalcancer[J]. Cancer, 2009, 115 (21): 4946-58. DOI: 10.1002/cncr.v115:21. |
| [8] | Chen SQ, Chen ZH, Lin SY, et al. KISS1 methylation andexpression as predictors of disease progression in colorectal cancerpatients[J]. World J Gastroenterol, 2014, 20 (29): 10071-81. DOI: 10.3748/wjg.v20.i29.10071. |
| [9] | 陈绍勤, 陈昌江, 戴起宝, 等. 小分子干扰RNA沉默人结直肠癌HT-29细胞TCF21基因对Kiss-1基因表达的影响[J]. 中华实验外科杂志, 2013, 30 (10): 2101-3. |
| [10] | 陈绍勤, 陈志华, 林素勇, 等. 5-杂氮-2'-脱氧胞苷对人结直肠癌HCT116细胞Kiss-1基因表达及侵袭迁移的影响[J]. 肿瘤, 2014, 34 (1): 26-32. |
| [11] | Somiari SB, Shriver CD, Heckman C, et al. Plasma concentrationand activity of matrix metalloproteinase 2 and 9 in patients withbreast disease,breast cancer and at risk of developing breast cancer[J]. Cancer Lett, 2006, 233 (1): 98-107. DOI: 10.1016/j.canlet.2005.03.003. |
| [12] | Babykutty S, Priya PS, Nandini RJ, et al. Nimbolide retards tumorcell migration,invasion,and angiogenesis by downregulatingMMP-2/9 expression via inhubiting ERK1/2 and reducing DNAbindingactivity of NF-B in colon cancer cells[J]. Mol Carcinog, 2012, 51 (6): 475-90. DOI: 10.1002/mc.v51.6. |
| [13] | Pentheroudakis G, Kostadima L, Dora L, et al. A twisted kiss: invitro and in vivo evidence of genetic variation and suppressedtranscription of the metastasis suppressor gene KiSS-1 in earlybreast cancer[J]. Neoplasma, 2010, 57 (1): 47-54. DOI: 10.4149/neo_2010_01_047. |
| [14] | Oshiro MM, Watts GS. Mutant P53 and aberranteytosine Methylaticooperate tosilcence gene expression[J]. Oncoqene, 2003, 22 (23): 3624-34. |
| [15] | 张辉, 崔军, 尚超, 等. 肾癌中KISS-1通过NF-B调控MMP-9的表达[J]. 中国医学工程, 2012, 20 (3): 1-2. |
 2015, Vol. 35
2015, Vol. 35

