类风湿关节炎(rheumatoid arthritis,RA)是以持续性炎性滑膜炎、软骨破坏、骨侵蚀、关节完整性改变为主要临床表现的一种自身免疫性疾病[1]。尽管RA的发病机制不明确,但TNF-α在介导RA的组织破坏和炎症进展中起着关键性作用[2]。研究表明,正常的滑膜中肥大细胞只占极少数,而在RA患者的滑膜中,肥大细胞占滑膜总细胞数的5%或更多,主要分布在血管周围、软骨侵蚀处和关节液中,参与RA患者滑膜的急慢性炎症、骨和软骨的破坏[3]。
在RA中,高水平的MMPs活动与软骨和骨的降解相关[4],RA患者的滑膜、血清和滑液中MMP-3、MMP-9 的表达升高[5]。IL-17可以介导RA患者软骨的降解和骨的侵蚀,在RA患者的滑液中IL-17表达也是升高的[6]。研究表明MMP-3、MMP-9和IL-17主要来源于肥大细胞[7-11],但其调节机制并不明确。本研究建立TNF-α诱导骨髓源性肥大细胞的培养体系,通过观察TNF-α对肥大细胞表达MMP-3、MMP-9、IL-17的影响,探讨肥大细胞在RA致病机制中的作用,为寻找RA治疗的新靶点提供一定的实验依据。
1 材料和方法 1.1 主要试剂RPMI 1640培养基、青-链霉素购自GIBCO公司,胎牛血清(FBS)购自Hyclone 公司,SCF、TNF-α购自PEPROTECH 公司,12 孔板购自Corning 公司,内参引物GAPDH由上海GENEray公司合成,其余引物由上海invitrogen 合成,Trizol、反转录试剂盒TaKaRaPrimeScriptTM RT Master Mix 及实时荧光定量试剂盒TaKaRaSYBRRPremix Ex TaqTM 购自大连TaKaRa公司,其余均为国产分析纯。
1.2 实验动物原代培养BMMCs 均来自5周龄C57BL/6 雄性小鼠,购于南方医科大学动物实验中心。
1.3 BMMCs的培养剪断股骨、胫骨两端,置于含RPMI 1640的培养平皿中,用注射器冲洗骨髓腔到白色,后接种于RPMI 1640完全培养基(RPMI 1640含2.5 mmol/L L-谷氨酰胺,10% FBS,1%青-链霉素),再加入重组IL-3,使其终浓度为10 ng/mL,每3 d换1次液,2周后追加SCF,使其终浓度为20 ng/mL,每1周换1次液。
1.4 BMMCs的甲苯胺蓝染色收集培养8 周的BMMCs,1500 r/min 离心4 min,PBS洗涤2 次,细胞涂片,自然风干,1%甲苯胺蓝染色1min,迅速用去离子水漂洗1次,显微镜下观察细胞染色情况。
1.5 BMMCs 的激发BMMCs培养8 周后,以1×106/孔铺板,设3 个复孔。分别加入2、10、50 ng/mL 的TNF-α,对照组加入PBS,作用12、24 h。收集细胞,1500 r/min离心4 min,细胞用于下一步总RNA的提取和实时荧光定量PCR 检测MMP-3、MMP-9、IL-17表达的变化。
1.6 Real-time PCR法检测利用TaKaRa公司生产的Trizol试剂提取BMMCs 总RNA,并溶于无Rnase 水中,紫外分光光度计测定D260/D280 的比值在1.8~2.0 之间。按TaKaRaPrime ScriptTM RT Master Mix 试剂盒说明进行cDNA合成。MMP-3、MMP-9、IL-17引物序列由Invitrogen合成,内参GAPDH引物序列由上海GENEray公司合成,引物序列见表1。待测cDNA加入到20μl反应体系中,按照TaKaRaSYBR®Premix Ex TaqTM 试剂盒说明在LightCycler ®480 型荧光定量PCR扩增仪进行定量检测。PCR反应条件:95 ℃ 30 s变性,95 ℃ 5 s,60 ℃ 30 s 循环40 次,95 ℃ 5 s,60 ℃ 60 s 融解,50 ℃ 30 s 降温。融解曲线分析表明PCR反应产物为单独的双链DNA。每一个样品目的基因扩增的循环数(threshold cycle,Ct)都依据GAPDH 做校正,得出ΔCt(Ct 样品目的基因-Ct样品的GAPDH)。目标基因表达差异以经过处理的样本相对于未经处理的样本的倍数表示,即检测基因的差异=2-ΔΔCt(ΔΔCt=ΔCt处理样品-ΔCt未处理样品)。
| 表 1 MMP-3、MMP-9、IL-17及GAPDH引物序列 Table 1 Primer sequence of MMP-3, MMP-9, IL-17, GAPDH, and β-actin |
所有数据采用均数±标准差表示,用SPSS 13.0软件处理,两个样本均数间比较采用t检验,多个样本间均数比较采用单因素方差分析,均数间两两比较,方差齐性时用LSD法,方差不齐是用Dunnett's 法分析,以P< 0.05时认为差异有统计学意义。
2 结果 2.1 原代培养8周BMMCs 形态学观察以及BMMCs甲苯胺蓝染色光镜下的BMMCs,培养24 h出现贴壁细胞,为不规则形,视野中可见大小不一的悬浮细胞,随着换液次数增多,贴壁细胞越来越少,悬浮细胞变为大小形态均一的细胞。甲苯胺蓝染色液呈蓝色,由于肥大细胞碱性颗粒的异染性,其所显示的颗粒颜色与染料颜色存在差异,肥大细胞颗粒被染成紫红色,而各种细胞核若被着色则呈现蓝色[12]。实验中发现甲苯胺蓝染色后,可见细胞胞浆中的颗粒被染成紫红色(图1)。
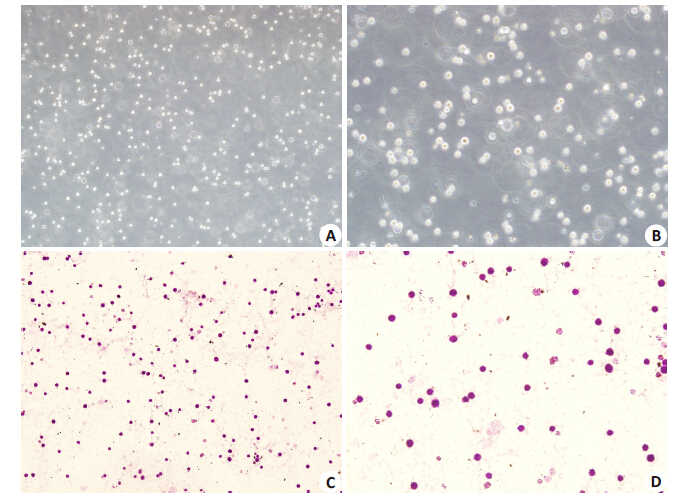
|
图 1 倒置显微镜下观察培养8周的BMMCs以及BMMCs的甲苯胺蓝染色 Figure 1 Observation of BMMCs under inverted microscope (A, B) and with toluidine blue staining (C, D). A, C: original magnification: ×100; B, D: original magnification: × 200. |
结果显示,随着TNF-α诱导浓度的增加,MMP-3、 MMP-9 和IL-17 基因mRNA的表达均显著增高,差异均具有统计学意义(P<0.05,图2)。
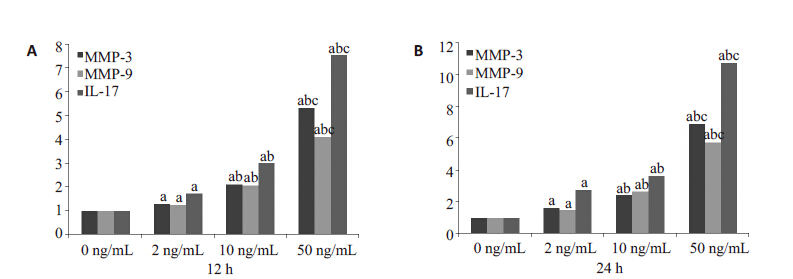
|
图 2 real-time PCR 检测BMMCs经不同浓度TNF-α诱导后MMP-3、MMP-9、IL-17mRNA的表达 Figure 2 Expression of MMP-3, MMP-9 and IL-17 mRNA detected by real-time PCR in BMMCs induced with TNF-α for 12 h (A)and 24 h (B). a: P<0.05 vs control; b: P<0.05 vs TNF-α 2 ng/mL; c: P<0.05 vs TNF-α 10 ng/mL. |
结果显示,随着TNF-α诱导时间的增加,MMP-9和IL-17基因的mRNA表达均呈显著增高,差异均具有统计学意义(P<0.05)。随着TNF-α诱导时间的增加,在2ng/mL和10ng/mL组,MMP-3 基因的mRNA表达显著增高,差异具有统计学意义(P<0.05);在50 ng/mL 组,MMP-3基因的mRNA表达没有显著变化,差异没有统计学意义(P>0.05,图3)。
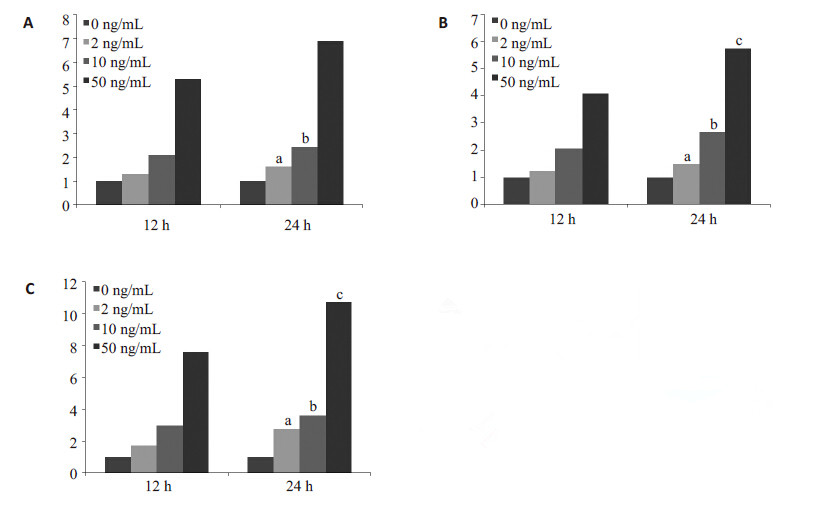
|
图 3 real-time PCR 检测BMMCs经TNF-α诱导, 不 同时间后MMP-3、MMP-9、IL-17mRNA的表达 Figure 3 Expression of MMP-3 (A), MMP-9 (B) and IL-17 (C) mRNA in BMMCs induced with TNF-α for 12 and 24 h. a: P<0.05 vs 12 h TNF-α 2 ng/mL; b: P< vs 12 h TNF-α 10 ng/mL; c: P<0.05 vs 12 h TNF-α 50 ng/mL. |
TNF-α是RA发病机制中关键的细胞因子[13],而本实验研究结果显示,TNF-α可以上调BMMCs 表达MMP-3、MMP-9 和IL-17。BMMCs 经2 ng/mL 组TNF-α诱导后,MMP-3、MMP-9和IL-17 mRNA的表达与对照组相比均显著升高,并且随着TNF-α浓度的升高,mRNA的表达逐渐升高,在50 ng/mL组达到最高; BMMCs经TNF-α诱导24 h后,MMP-3、MMP-9和IL-17 mRNA的表达与经TNF-α诱导12 h后的相比均显著升高。
RA的一个重要的临床病理特征是关节软骨的破坏,其细胞学基础是软骨细胞外基质的降解,MMPs是降解细胞外基质(ECM)的主要组成部分[14]。MMP-3主要由软骨细胞和滑膜成纤维细胞产生,在RA患者的血清中高表达,是介导软骨破坏和骨吸收的关键介质。活化后的MMP-3 可以激活pro-MMP-9,而MMP-9 通过释放血管内皮生长因子(VEGF),募集中性粒细胞、单核细胞、T细胞和破骨细胞,介导RA的血管生成和疾病进展[15]。在参与RA发病机制的细胞因子中,IL-17的研究近来受到重视。IL-17通过促进其它促炎因子如IL-6、 IL-1、TNF、MMPs的表达,进一步介导RA患者软骨的降解和骨的侵蚀[16-17]。
我们的研究结果表明,TNF-α可以促进BMMCs表达MMP-3、MMP-9。肥大细胞是免疫系统中的多功能细胞,近来的研究显示肥大细胞参与了RA的慢性炎症和基质的降解[1]。RA患者关节液中一些趋化因子可以募集肥大细胞[3],肥大细胞活化后分泌的糜蛋白酶和类胰蛋白酶可以激活MMPs[18],如MMP-3[19-20]和MMP-9[7],而肥大细胞活化后分泌的TNF-α也可以上调MMP-3[15] 和MMP-9[21]的表达。Kanbe等[8]研究发现MMP-9主要来源于肥大细胞,Baram等[21]推测,无活性的MMP-9与组胺、类胰蛋白酶一起分布在肥大细胞的特异性分泌颗粒中。Kotani等[5]研究显示RA患者经过抗TNF-α治疗后,血清中MMP-3和MMP-9的水平明显下降。
我们的研究结果证实,TNF-α可以促进BMMCs表达IL-17。Hueber等[10]研究发现,RA患者的肥大细胞是表达IL-17的主要细胞,而体外培养的肥大细胞也可以表达IL-17。Suurmond等[6]研究发现,RA患者滑液中的IL-17阳性细胞主要来自肥大细胞,而不是T细胞或是巨噬细胞。ACPA阳性RA患者的滑液中IL-17水平升高,由于RA患者滑液中IL-17的水平与肥大细胞的数量密切相关,而且ACPA阳性RA患者滑膜中脱颗粒的肥大细胞数量增加,由此推测ACPA阳性RA患者肥大细胞活性的增强导致了ACPA 阳性RA 患者滑液中IL-17 水平的上升。在动物关节炎模型中,疾病早期IL-17的效果依赖于TNF-α,而疾病后期主要由IL-17驱动[22]。Zheng等[2]研究表明RA中TNF-α通过单核细胞产生的IL-6和IL-1β来促进Th17细胞的分化,在Th17 细胞的分化中起着关键性作用。抗TNF-α治疗后,RA 患者滑液中的IL-17急剧减少。
本实验研究证实用TNF-α诱导BMMCs后,其表达MMP-3、MMP-9、IL-17的量均上调,且呈浓度依赖性和时间依赖性。由此可以推测,抑制肥大细胞的活性,可以减少MMP-3、MMP-9、IL-17的表达,从而减少软骨降解和骨破坏,发挥治疗RA的作用,为RA的治疗提供一个新的靶点。但目前TNF-α 促进肥大细胞表达MMP-3、MMP-9、IL-17的机制尚未完全阐明,有研究表明TNF-α通过激活NF-κB通路而具有一个广谱的促炎能力,而树突状细胞和巨噬细胞通过IL-6 和JAK/ STAT-3信号通路促进Th17细胞的分化[2],下一步可以从细胞通路和动物实验角度进一步研究其分子机制。
| [1] | Kobayashi Y, Okunishi H. Mast cells as a target of rheumatoid arthritis treatment[J]. Jpn J Pharmacol,2002, 90 (1) : 7-11. DOI: 10.1254/jjp.90.7. |
| [2] | Zheng Y, Sun L, Jiang T, et al. TNFα promotes Th17 cell differentiation through IL-6 and IL-1β produced by monocytes in rheumatoid arthritis[J]. J Immunol Res,2014 : 385352. |
| [3] | Maruotti N, Crivellato E, Cantatore FP, et al. Mast cells in rheumatoid arthritis[J]. Clin Rheumatol,2007, 26 (1) : 1-4. DOI: 10.1007/s10067-006-0305-3. |
| [4] | Martel-Pelletier J, Mccollum R, Fujimoto N, et al. Excess of metalloproteases over tissue inhibitor of metalloprotease May contribute to cartilage degradation in osteoarthritis and rheumatoid arthritis[J]. Lab Invest,1994, 70 (6) : 807-15. |
| [5] | Kotani T, Takeuchi T, Takai S, et al. Serum levels of matrix metalloproteinase (MMP) 9, a risk factor for acute coronary syndrome, are reduced independently of serum MMP-3 by anti-TNF-α antibody (infliximab) therapy in patients with rheumatoid arthritis[J]. J Pharmacol Sci,2012, 120 (1) : 50-3. DOI: 10.1254/jphs.12129SC. |
| [6] | Suurmond J, Dorjée AL, Boon MR, et al. Mast cells are the main interleukin 17-positive cells in anticitrullinated protein antibodypositive and -negative rheumatoid arthritis and osteoarthritis synovium[J]. Arthritis Res Ther,2011, 13 (5) : R150. DOI: 10.1186/ar3466. |
| [7] | Fang KC, Raymond WW, Lazarus SC, et al. Dog mastocytoma cells secrete a 92-kD gelatinase activated extracellularly by mast cell chymase[J]. J Clin Invest,1996, 97 (7) : 1589-96. DOI: 10.1172/JCI118583. |
| [8] | Kanbe N, Tanaka A, Kanbe M, et al. Human mast cells produce matrix metalloproteinase 9[J]. Eur J Immunol,1999, 29 (8) : 2645-9. DOI: 10.1002/(ISSN)1521-4141. |
| [9] | Tanaka A, Arai K, Kitamura Y, et al. Matrix metalloproteinase-9 production, a newly identified function of mast cell progenitors, is downregulated by c-kit receptor activation[J]. Blood,1999, 94 (7) : 2390-5. |
| [10] | Hueber AJ, Asquith DL, Miller AM, et al. Mast cells Express IL-17A in rheumatoid arthritis synovium[J]. J Immunol,2010, 184 (7) : 3336-40. DOI: 10.4049/jimmunol.0903566. |
| [11] | Brownell E, Fiorentino L, Jolly G, et al. Immunolocalization of stromelysin-related protein in murine mast cell granules[J]. Int Arch Allergy Immunol,1995, 107 (1/3) : 333-5. |
| [12] | 吴敏, 胡天寒, 周鸿铭, 等. 甲苯胺蓝快速显示肥大细胞的制作方法探讨[J]. 四川解剖学杂志,2013, 21 (1) : 11-2. |
| [13] | Lee DM, Weinblatt ME. Rheumatoid arthritis[J]. Lancet,2001, 358 (9285) : 903-11. DOI: 10.1016/S0140-6736(01)06075-5. |
| [14] | Sternlicht MD, Werb Z. How matrix metalloproteinases regulate cell behavior[J]. Annu Rev Cell Dev Biol,2001, 17 : 463-516. DOI: 10.1146/annurev.cellbio.17.1.463. |
| [15] | Ally MM, Hodkinson B, Meyer PW, et al. Serum matrix metalloproteinase-3 in comparison with acute phase proteins as a marker of disease activity and radiographic damage in early rheumatoid arthritis[J]. Mediators Inflamm,2013 : 183653. |
| [16] | Korn T, Bettelli E, Oukka M, et al. IL-17 and Th17 cells[J]. Annu Rev Immunol,2009, 27 : 485-517. DOI: 10.1146/annurev.immunol.021908.132710. |
| [17] | Miossec P, Korn T, Kuchroo VK. Interleukin-17 and type 17 helper T cells[J]. N Engl J Med,2009, 361 (9) : 888-98. DOI: 10.1056/NEJMra0707449. |
| [18] | Tetlow LC, Woolley DE. Mast cells, cytokines, and metalloproteinases at the rheumatoid lesion: dual immunolocalisation studies[J]. Ann Rheum Dis,1995, 54 (11) : 896-903. DOI: 10.1136/ard.54.11.896. |
| [19] | Suzuki K, Lees M, Newlands GF, et al. Activation of precursors for matrix metalloproteinases 1 (interstitial collagenase) and 3 (stromelysin) by rat mast-cell proteinases I and II[J]. Biochem J,1995, 305 (Pt 1) : 301-6. |
| [20] | Bonassar LJ, Frank EH, Murray JC, et al. Changes in cartilage composition and physical properties due to stromelysin degradation[J]. Arthritis Rheum,1995, 38 (2) : 173-83. DOI: 10.1002/(ISSN)1529-0131. |
| [21] | Baram D, Vaday GG, Salamon P, et al. Human mast cells release metalloproteinase-9 on contact with activated T cells: juxtacrine regulation by TNF-alpha[J]. J Immunol,2001, 167 (7) : 4008-16. DOI: 10.4049/jimmunol.167.7.4008. |
| [22] | Moran EM, Mullan R, Mccormick J, et al. Human rheumatoid arthritis tissue production of IL-17A drives matrix and cartilage degradation: synergy with tumour necrosis factor-alpha, Oncostatin M and response to biologic therapies[J]. Arthritis Res Ther,2009, 11 (4) : R113. DOI: 10.1186/ar2772. |
 2015, Vol. 35
2015, Vol. 35

