卵巢癌是严重威胁女性健康的恶性肿瘤之一,其起病隐匿,发展迅速,死亡率居妇科肿瘤首位[1]。近年来,尽管随着肿瘤细胞减灭术的不断改进以及以铂类为基础联合化疗的广泛应用,卵巢癌患者的5年生存率仍低于30%[2]。化疗耐药的产生是导致卵巢癌患者预后不良的重要原因[3]。因此,探索卵巢癌耐药相关因素及机制,寻找有效逆转耐药的治疗靶点对卵巢癌的治疗具有重要意义。已有研究表明微小RNA-100(microRNA-100,miR-100)与卵巢癌的临床分期、转移、化疗后复发及预后密切相关[5]。另有文献报道miR-100 与化疗耐药相关,其可通过靶向调节药物敏感性相关基因的表达从而影响肿瘤对化疗的敏感性及预后[5-6]。目前,miR-100是否与卵巢癌顺铂耐药相关尚无文献报道。本实验旨在研究miR-100 在卵巢癌顺铂耐药细胞中的表达,探讨miR-100与卵巢癌细胞顺铂耐药的关系。
1 材料与方法 1.1 材料来源人卵巢浆液性乳头状囊腺癌细胞株(SKOV3)由南方医科大学肿瘤研究所惠赠,人卵巢癌浆液性腺癌顺铂耐药细胞株(SKOV3/DDP)由青岛大学医学院附属医院中心实验室惠赠。脂质体lipofectamin2000 为Invitrogen 公司产品。CCK8 试剂为日本同仁公司产品。成熟miR-100 模拟物(mimics)及阴性对照片段(NC)、阻遏物(inhibitor)及阴性对照片段(inhibitor NC)、miR-100茎环引物及内参U6引物均购自上海吉玛制药技术有限公司。Trizol购自日本TaKaRa公司。
FastQuant RT Kit(With gDNase)、SuperReal PreMix Plus(SYBR Green)购自天根生化科技有限公司。
1.2 细胞培养SKOV3 及SKOV3/DDP 在含10%胎牛血清的RPMI 1640培养液中,5% CO2、37 ℃饱和湿度培养箱内培养,贴壁生长。
1.3 CCK8法检测SKOV3/DDP细胞的顺铂耐药系数取对数生长期的SKOV3 及SKOV3/DDP 细胞分别接种于96孔板,3×103个细胞/孔,次日,加入终浓度分别为2、4、8、16、32、64 μg/mL的顺铂,每种细胞设无药物组为对照组,每个浓度设5个复孔,每块板设3个空白孔。常规培养48 h后每孔加10 μL CCK8,继续孵育3 h,在酶标仪上选择450 nm波长测定各孔吸光度(A)并计算平均值。实验重复3次。计算各组细胞生长抑制率,顺铂的半数抑制浓度(IC50)。耐药指数(RI)=IC50(SKOV3/DDP)/IC50(SKOV3)。
1.4 细胞转染取对数生长的SKOV3/DDP细胞,以3.5×105个/孔接种于6 孔板培养,次日细胞贴壁,细胞密度至60%~ 70%,取miR-100类似物(mimics)、抑制物(inhibitor)及两者阴性对照片段NC、inhibitor NC各100 pmoL分别与脂质体lipofectamine 2000 5 μL混合,按lipofectamine 2000试剂盒操作说明书转染至SKOV3/DDP。实验分为6 组:SKOV3 组,SKOV3/DDP 组,miR-100 mimics 组,NC组,miR-100 inhibitor组,inhibitor NC组。
1.5 实时定量PCR技术检测各组细胞中miR-100的表达量(1)提取总RNA:使用Trizol试剂提取细胞中的总RNA;(2)反转录反应:miR-100的逆转录引物为茎环结构引物,以U6基因作为内参,反应条件:42 ℃ 15 min,95 ℃ 3 min。(3)实时荧光定量PCR反应:取反转录产物分别进行miR-100、U6的PCR反应,并设3个副孔,反应条件:95 ℃ 10 s,60 ℃ 30 s,进行40个循环。miR-100 引物序列:上游引物为5'ATCATTAAACCCGTAGAT CCGAA3',下游引物为5'AATGGTTGTTCTCCACAC TCTCTC3';内参U6 序列:上游引物为5'ATTGGAAC GATACAGAGAAGATT3',下游引物为5'GGAACG CTTCACGAATTTG3'。(4)定量计算:记录样本的循环反应阈值(Ct)并予以校正,以2-△ △ Ct 表示实验组miR-100表达量相对于对照组表达量(表达量定为1)的变化倍数,其中△△Ct=(Ct miR-100-Ct U6)实验组- (Ct miR-100-Ct U6)对照组。实验重复3次。
1.6 CCK8法检测转染后SKOV3/DDP细胞的顺铂半数抑制浓度的变化SKOV3/DDP细胞转染24 h 后,分别接种于96 孔板,3×103个细胞/孔,次日,加入终浓度分别为2、4、8、16、 32、64 μg/mL的顺铂,每组细胞设无药物组为对照组,每个浓度设5个复孔。孵育48 h后每孔加10 μL CCK8,继续培养3 h,在酶标仪上选择450 nm波长测定各孔吸光度(A)并计算平均值。实验重复3次。计算各组细胞生长抑制率,顺铂的半数抑制浓度(IC50)。
1.7 统计学方法采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差表示,两组间比较采用成组t检验,多组间两两比较采用单因素方差分析(One-way ANOVA),P< 0.05认为差异有有统计学意义。
2 结果 2.1 SKOV3/DDP细胞的顺铂耐药指数SKOV3/DDP 细胞的IC50 为8.29 μg/mL,SKOV3 细胞的IC50为3.72 μg/mL,SKOV3/DDP细胞的耐药指数(RI)为2.23。
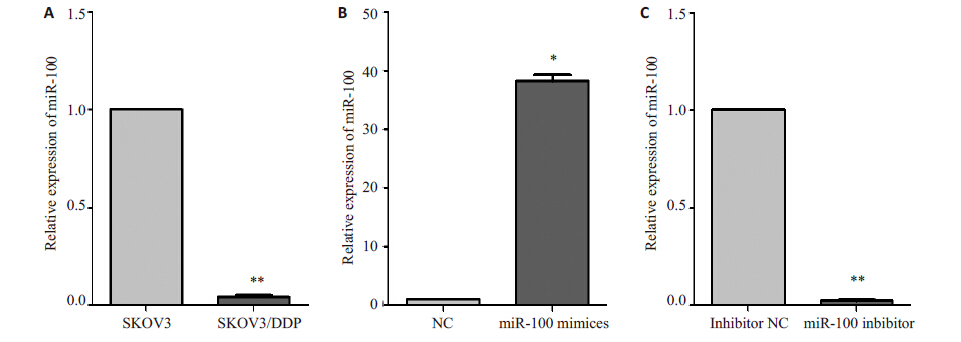
2.2 各组卵巢癌细胞中miR-100的表达miR-100 在SKOV3/DDP 细胞中呈低表达,与SKOV3细胞相比表达水平下降25倍,差异有统计学意义(P<0.001,图1A)。转染miR-100 mimices 后SKOV3/ DDP 细胞中miR-100 的表达量与NC组相比上升38.29 倍,差异有统计学意义(P<0.01,图1B);转染miR-100 inhibitor 后SKOV3/DDP 细胞中miR-100 的表达量较inhibitor NC 组下降97.7%,差异有统计学意义(P< 0.001,图1C)。
|
图 1 各组卵巢癌细胞中miR-100的表达差异 Figure 1 Relative expression of miR-100 in each group. A: SKOV3/DDP gruop compraed with SKOV3 group; B: miR-100 mimices group compraed with NC group; C: miR-100 inhibitor group compraed with inhibitor NC group. *P<0.01, **P<0.001. |
SKOV3/DDP 细胞的存活率随顺铂浓度的增加而降低。转染miR-100 mimices 后SKOV3/DDP 细胞对顺铂的敏感性增加,其IC50明显低于NC组,差异有统计学意义(P<0.001)。转染miR-100 inhibitor后SKOV3/ DDP 细胞顺铂IC50明显高于inhibitor NC组,差异有统计学意义(P<0.001,表1)。
| 表 1 转染后各组细胞顺铂IC50变化 Table 1 IC50 of cisplatin in each group after transfection (Mean±SD) |
近年研究表明,微小miRNA的异常表达与肿瘤的发生、发展、转移及预后等密切相关,提示miRNA在肿瘤的发生、发展过程中起到调控的枢纽作用[7]。且目前已证实miRNA具有调节肿瘤化疗敏感性的作用[8-10]。
miR-100 是较早发现的肿瘤相关的miRNA,研究发现其在鼻咽癌、非小细胞肺癌、膀胱癌、肝细胞癌、宫颈癌等恶性肿瘤中呈低表达,miR-100在这些肿瘤中发挥着抑癌作用,抑制肿瘤的发生发展[11-15]。miR-100与卵巢癌的关系也引起了国内外学者的关注。Nam等[16] 采用miRNA表达谱芯片技术,发现在卵巢癌组织中miR-100、miR-16、miR-99等多种miRNA的表达异常。
袁等[17]研究发现卵巢癌组织和细胞中miR-100的表达水平较正常组显著下调,且miR-100能显著抑制卵巢癌细胞株的细胞增殖及迁移,促进细胞凋亡。本课题组前期研究分析98例上皮性卵巢癌患者的miR-100的表达及其与临床病理因素的关系,发现上皮性卵巢癌组织miR-100表达水平明显低于临近正常组织,miR-100与卵巢癌的临床分期、转移、化疗后复发及预后呈负相关[4]。以上结果说明miR-100在卵巢癌的发生发展过程中可能发挥着抑癌作用,抑制卵巢癌的发生发展,且可能与卵巢癌的不良预后有关。
miR-100作为肿瘤抑制因子,能够通过转录后负向调节哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和Polo样激酶1(polo-like kinase 1, PLK1)的表达而调控肿瘤细胞的生长、转移及对化疗的敏感性。Feng 等[18]研究发现在肺腺细胞癌中,下调miR-100可以激活其靶蛋因PLK1,从而促进肺腺细胞癌对紫杉醇耐药性的形成。Zhu等[19]报道在软骨肉瘤细胞系中miR-100通过靶向mTOR-3'-UTR并抑制其表达,从而增加软骨肉瘤细胞系对顺铂的敏感性。也有文献报道miR-100与卵巢癌耐药的关系,表明miR-100可增加卵巢透明细胞癌细胞系对依维莫司的敏感性[20]。但上皮性卵巢癌与顺铂耐药的关系目前尚不清楚。本研究以上皮性卵巢癌亲本细胞SKOV3 及其耐药细胞SKOV3/DDP作为研究对象,采用实时荧光定量PCR检测miR-100在两株细胞中的表达差异。结果显示与卵巢癌亲本细胞SKOV3相比,miR-100在卵巢癌顺铂耐药细胞SKOV3/DDP中呈低表达,这提示miR-100可能与上皮性卵巢癌顺铂耐药相关。为进一步研究miR-100 与卵巢癌顺铂耐药的关系,我们上下调SKOV3/DDP中的miR-100 表达后再行顺铂IC50 检测。结果显示,SKOV3/DDP中miR-100与其对顺铂IC50呈负相关,这提示miR-100 可调节上皮性卵巢癌细胞对顺铂的敏感性,进一步证实miR-100 与上皮性卵巢癌顺铂耐药相关。
本实验初步探索了miR-100与卵巢癌顺铂耐药的关系,研究发现miR-100 可增加卵巢癌对顺铂的敏感性,并可能逆转卵巢癌顺铂耐药。这为耐药性卵巢癌的防治、逆转耐药现象以及提高化疗效果提供新思路和新靶点。但是,对于miR-100逆转卵巢癌顺铂耐药的机制及体内实验还有待进一步研究。
| [1] | Kuhlmann J D, Rasch J, Wimberger P, et al. microRNA and the pathogenesis of ovarian cancer--a new horizon for molecular diagnostics and treatment[J]. Clin Chem Lab Med,2012, 50 (4) : 601-15. |
| [2] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin,2014, 64 (1) : 9-29. DOI: 10.3322/caac.21208. |
| [3] | Wenham R M, Lapolla J, Lin H Y, et al. A phase II trial of docetaxel and bevacizumab in recurrent ovarian cancer within 12 months of prior platinum-based chemotherapy[J]. Gynecol Oncol,2013, 130 (1) : 19-24. DOI: 10.1016/j.ygyno.2013.04.049. |
| [4] | Peng DX, Luo M, Qiu LW, et al. Prognostic implications of microRNA-100 and its functional roles in human epithelial ovarian cancer[J]. Oncol Rep,2012, 27 (4) : 1238-44. |
| [5] | Xiao F, Bai Y, Chen Z, et al. Downregulation of HOXA1 gene affects small cell lung cancer cell survival and chemoresistance under the regulation of miR-100[J]. Eur J Cancer,2014, 50 (8) : 1541-54. DOI: 10.1016/j.ejca.2014.01.024. |
| [6] | Li Z, Li X, Yu C, et al. MicroRNA-100 regulates pancreatic cancer cells growth and sensitivity to chemotherapy through targeting FGFR3[J]. Tumour Biol,2014, 35 (12) : 11751-9. DOI: 10.1007/s13277-014-2271-8. |
| [7] | Yang W, Lee D Y, Ben-David Y. The roles of microRNAs in tumorigenesis and angiogenesis[J]. Int J Physiol Pathophysiol Pharmacol,2011, 3 (2) : 140-55. |
| [8] | Chan J K, Blansit K, Kiet T, et al. The inhibition of miR-21 promotes apoptosis and chemosensitivity in ovarian cancer[J]. Gynecol Oncol,2014, 132 (3) : 739-44. DOI: 10.1016/j.ygyno.2014.01.034. |
| [9] | Wang Y Q, Guo R D, Guo R M, et al. MicroRNA-182 promotes cell growth, invasion, and chemoresistance by targeting programmed cell death 4 (PDCD4) in human ovarian carcinomas[J]. J Cell Biochem,2013, 114 (7) : 1464-73. DOI: 10.1002/jcb.24488. |
| [10] | 金爱红, 周霞平, 周凤珍. 抑制miR-23a表达增强卵巢癌顺铂敏感性的分子机制[J]. 南方医科大学学报,2015 (1) : 125-8. |
| [11] | Shi W, Alajez N M, Bastianutto C, et al. Significance of Plk1 regulation by miR-100 in human nasopharyngeal cancer[J]. Int J Cancer,2010, 126 (9) : 2036-48. |
| [12] | Liu J, Lu KH, Liu ZL, et al. MicroRNA-100 is a potential molecular marker of non-small cell lung cancer and functions as a tumor suppressor by targeting polo-like kinase 1[J]. BMC Cancer,2012, 12 : 519. DOI: 10.1186/1471-2407-12-519. |
| [13] | Wang S, Xue S, Dai Y, et al. Reduced expression of microRNA-100 confers unfavorable prognosis in patients with bladder cancer[J]. Diagn Pathol,2012, 7 : 159. DOI: 10.1186/1746-1596-7-159. |
| [14] | Chen P, Zhao X, Ma L. Downregulation of microRNA-100 correlates with tumor progression and poor prognosis in hepatocellular carcinoma[J]. Mol Cell Biochem,2013, 383 (1-2) : 49-58. DOI: 10.1007/s11010-013-1753-0. |
| [15] | Li B H, Zhou J S, Ye F, et al. Reduced miR-100 expression in cervical cancer and precursors and its carcinogenic effect through targeting PLK1 protein[J]. Eur J Cancer,2011, 47 (14) : 2166-74. DOI: 10.1016/j.ejca.2011.04.037. |
| [16] | Nam E J, Yoon H, Kim S W, et al. MicroRNA expression profiles in serous ovarian carcinoma[J]. Clin Cancer Res,2008, 14 (9) : 2690-5. DOI: 10.1158/1078-0432.CCR-07-1731. |
| [17] | 袁林, 靖璟, 刘永彪. MiR -100在卵巢癌中的表达及调控作用[J]. 现代肿瘤医学,2015 (5) : 594-7. |
| [18] | Feng B, Wang R, Chen L B. MiR-100 resensitizes docetaxelresistant human lung adenocarcinoma cells (SPC-A1) to docetaxel by targeting Plk1[J]. Cancer Lett,2012, 317 (2) : 184-191. DOI: 10.1016/j.canlet.2011.11.024. |
| [19] | Zhu Z, Wang C P, Zhang Y F, et al. MicroRNA-100 resensitizes resistant chondrosarcoma cells to cisplatin through direct targeting of mTOR[J]. Asian Pac J Cancer Prev,2014, 15 (2) : 917-23. DOI: 10.7314/APJCP.2014.15.2.917. |
| [20] | Nagaraja A K, Creighton C J, Yu Z, et al. A link between mir-100 and FRAP1/mTOR in clear cell ovarian cancer[J]. Mol Endocrinol,2010, 24 (2) : 447-63. DOI: 10.1210/me.2009-0295. |
 2015, Vol. 35
2015, Vol. 35

