2. 暨南大学附属第一医院临床医学检验中心, 广东 广州 510630
2. Center for Clinical Laboratory, First Affiliated, Southern Medical University, Guangzhou 510515, China
由HIV感染引发的艾滋病(AIDS)导致每年数百万人死亡。高效抗逆转录病毒疗法(HAART)应用于早期感染的患者,可有效抑制HIV感染,控制病毒血症,通过持续服药可有效延长感染者寿命[1]。然而患者一旦停止服药,HIV便再次活化并产生甚至更为严重的病毒血症[2]。研究发现HIV 的潜伏感染是HAART根治HIV最大的障碍[3]。潜藏于机体静息期免疫细胞(如记忆性T细胞,纯真CD4+ T细胞,神经胶质细胞,星形胶质细胞等)中的HIV因无法被机体免疫细胞识别并清除,成为HIV 难以治愈的根本原因[4]。“激活再杀灭(shock and kill)”策略提出的理念在于尝试采用小分子化合物与HAART联合使用从而达到彻底清除HIV的目的[5]。采用激活剂激活隐藏的HIV,从而使得机体的免疫细胞可特异性识别活化的细胞并清除,同时采用HAART治疗,可杀灭释放出来的HIV 颗粒防止其再次感染和复制。
目前,多种“激活再杀灭”联合用药模式正在临床试验当中[6]。寻找高效激活潜伏HIV小分子化合物成为当前亟待解决的问题,近年来研究发现植物来源的萜类化合物prostratin具有较强激活潜伏HIV作用[7]。中药材狼毒大戟具有治疗淋巴结结核,骨结核,皮肤结核,牛皮癣,神经性皮炎,慢性支气管炎,阴道滴虫等多种功效,在我国黑龙江、辽宁、内蒙古、河北等地均可生长,分布广泛,其提取物中的萜类化合物在抗肿瘤领域和潜伏HIV激活领域获得广泛关注[8-9]。本文通过改进的丙酮一步法高效提取了狼毒大戟萜类化合物,通过MS、 HPLC分析鉴定该类化合物为prostratin及其类似物或衍生物,通过激活潜伏HIV细胞(J-Lat 10.6)实验,证明了该类化合物具有显著的潜伏HIV激活活性,并揭示其激活的分子机制。
1 材料与方法 1.1 材料 1.1.1 植物,细胞与试剂狼毒大戟植物购自辽宁葫芦岛,潜伏HIV细胞系J-Lat 10.6由复旦大学病原微生物研究所馈赠。澳洲胎牛血清及RMPI 1640培养基均购自美国Gibco,核蛋白抽提试剂盒购自美国Thermo Fisher Pierce,蛋白酶抑制剂混合物及磷酸酶抑制剂混合物购于美国Merk calbiochem。ECL发光液,p65 兔mAb,p24,Lamin A/C鼠mAb以及羊抗兔和羊抗鼠二抗均购自美国CST,prostratin 标准品购自美国SIGMA-Aldrich。提取用丙酮为分析纯,高效液相色谱仪流动相用甲醇为色谱纯。
1.1.2 仪器药材粉碎机,超声仪,冷冻干燥机(Thermo SNL216V),高效液相色谱仪(岛津LC-10AT),质谱仪(WATERS 2695),台式低温离心机(Eppendorf 5810R)细胞培养箱(Thermo Forma Series II),荧光显微镜(Nikon Elipse Ti),流式细胞仪(BD FACS Canto II),电泳仪(Bio-Rad)。
1.2 方法 1.2.1 狼毒大戟前处理及活性成分提取采购的新鲜狼毒大戟根部,用刀切成块状,浇液氮迅速冷冻,并立刻置于药材粉碎机粉碎成末状。将狼毒大戟粉末置于冷冻干燥机,使之充分去除水分,3 d后取出,称重。将预干燥狼毒大戟干粉1 g溶于25 mL丙酮,混匀,100 HZ超声10 min,55 ℃水浴1 h。真空过滤,除去滤渣,获得丙酮溶解部分。真空旋转蒸发1.5 h左右,使丙酮挥发,浓缩至底部为黄褐色油状物为止,加入200 μL DMSO溶解,保存于-20 ℃待检测。
1.2.2 狼毒大戟提取物检测与分离提取物经0.22 μm滤膜过滤后,上质谱分析,同时prostratin 标准品用DMSO溶解作为对照。质谱鉴定提取物中的目标化合物后,采用HPLC分析,过C18柱,以甲醇/水为流动相,按照25%甲醇2 min,35%甲醇6 min,80%甲醇10 min 的程序梯度洗脱,记录保留时间和峰高并收集目标单峰,同时以prostratin 标准品作对照制作标准曲线,计算提取物中的活性化合物浓度。
1.2.3 潜伏HIV激活活性检测J-Lat 10.6细胞用添加10%胎牛血清和1% 双抗的RPMI 1640培养基来进行培养,置于5% CO2培养箱中,每隔3 d传代1次。取对数生长期J-Lat 10.6细胞,800 r/min离心5 min收集细胞,调整浓度为5×105个细胞/mL,0.5 mL培养液/孔均匀接种于48孔板中,以50 μg/mL EFE刺激细胞,未加药物组作为阴性对照,以10 ng/mL TNF-α做阳性对照。24 h后,置于荧光显微镜(放大倍数10×10)下,蓝光激发,并拍摄图片。随后,转移细胞培养液于流式管中,800 r/min离心5 min收集细胞,去除上清后,用500 μL PBS洗1次,将细胞重悬于300 μL PBS中,上流式细胞仪检测,计算GFP阳性比例。抑制实验分别以50 μg/mL EFE合用2.5、5、10 μmol/L的BAY 11-7082,同法操作。
1.2.4 激活NF-κB通路验证J-Lat 10.6调整细胞浓度为2×106个细胞/mL,2 mL/孔接种于6 孔板中,分别加50 μg/mL EFE 刺激0.5、1 、2 h 或添加相应浓度BAY 11-7082并以未加药组作为阴性对照。4 ℃,500 g离心5min收集细胞于EP管中,在试剂盒细胞裂解液CER及NER中分别添加蛋白酶抑制剂混合物和磷酸酶抑制剂混合物,按照试剂盒操作步骤依次去除胞质并抽提核蛋白。或种板后分别在3、6、12、24 h加50 μg/mL EFE 与添加相应浓度BAY 11-7082后提取总蛋白。蛋白定量后,加入上样缓冲液,将样品置于100 ℃加热5 min使蛋白变性。随后每孔上样20 μL(1 μg/μL)蛋白,经10% 聚丙烯酰胺凝胶电泳100 min 分离,再将蛋白转印于PVDF 膜上。5%脱脂奶粉室温封闭膜1 h 后,p65,β-actin兔抗人单克隆抗体及p24、Lamin A/C鼠抗人单克隆抗体1:1000稀释于5% 脱脂奶粉中,置于4 ℃摇床孵育过夜。第2天将膜取出,用PBS-T(含0.1% Tween 20)清洗3遍后与羊抗兔及羊抗鼠二抗室温共孵1 h,清洗5遍后用ECL发光液发光并显影。
1.2.5 数据分析流式数据分析均采用FlowJo 7.6分析软件来进行处理,GFP百分率采用prism 5 作图软件作图,误差线均用均数±标准差来表示。荧光图片及WB 图片运用adobe photoshop CS5处理。WB条带灰度值采用ImageJ2X软件来分析。
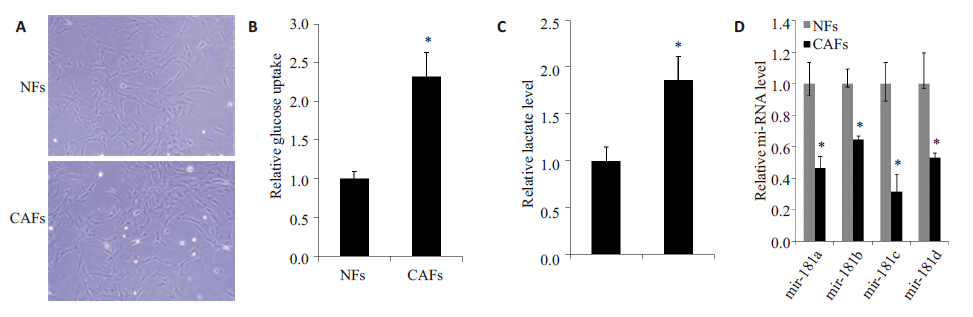
2 结果 2.1 狼毒大戟提取物中活性组分质谱鉴定和高效液相色谱分析根据化合物prostratin结构(图1)分析,采用步法从狼毒大戟粉末中提取得到的样品浓缩后溶于DMSO,通过质谱检测,以标准品prostratin 作为对照,鉴定出粗提物中含有prostratin及prostratin类似物。采用ESI(+)-MS,检测到M+23(Na)离子峰,质谱结果(图2)如下。
|
图 1 Prostratin的化学结构(相对分子质 量390.47) Figure 1 Cchemical structure of prostratin, C22H30O6 , M.W. 390.47. |
|
图 2 Prostratin标准品及丙酮提取物的质谱图 Figure 2 Mass spectrogram of prostratin standard control (A) and acetone extract of Euphorbia fischeriana (B). |
丙酮提取物过C18 反相柱高效液相色谱仪,用甲醇作流动相来进行梯度洗脱,以prostratin 标准品作对照,记录保留时间及峰面积。以0、0.025、0.5、0.1、 0.2 mmol/L prostratin标准品做标准曲线(R2=0.99)。通过标准曲线计算,得到丙酮提取物中活性组分prostratin 浓度约为0.53 mmol/L。
2.2 狼毒大戟提取物对潜伏HIV的有效激活J-Lat 10.6是一株HIV潜伏细胞系,多用于激活化合物的筛选,插入HIV基因组中的GFP基因随HIV基因组整合于细胞中并处于潜伏状态,药物作用后GFP的表达水平即代表HIV的激活水平。用50 μg/mL EFE刺激24 h后,在荧光显微镜下观察并拍照,结果如图(图3)所示。对应流式检测结果如图4。结果显示在药物作用下,GFP水平明显上调,说明EFE 能显著激活潜伏HIV。
|
图 3 EFE处理后对J-Lat 10.6细胞GFP的影响左为阴性对照,右为药物处理组 Figure 3 Fluorescent images of GFP cells. The left is negative control; the right is J-Lat 10.6 cells treated with EFE. |
|
图 4 EFE对潜伏HIV的激活效果 Figure 4 Activity of EFE in reactivating latent HIV. A, B: Flow cytometry analysis of GFP subset; C: Statistics of GFP %. ***P< 0.01 vs control Group. |
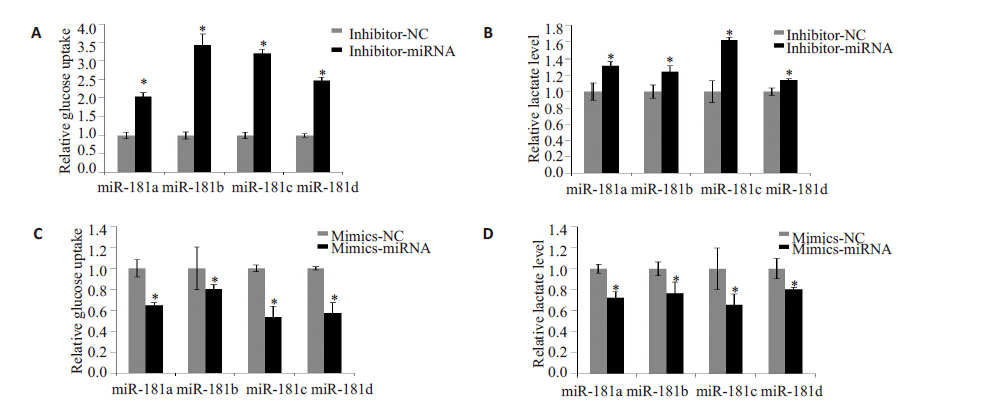
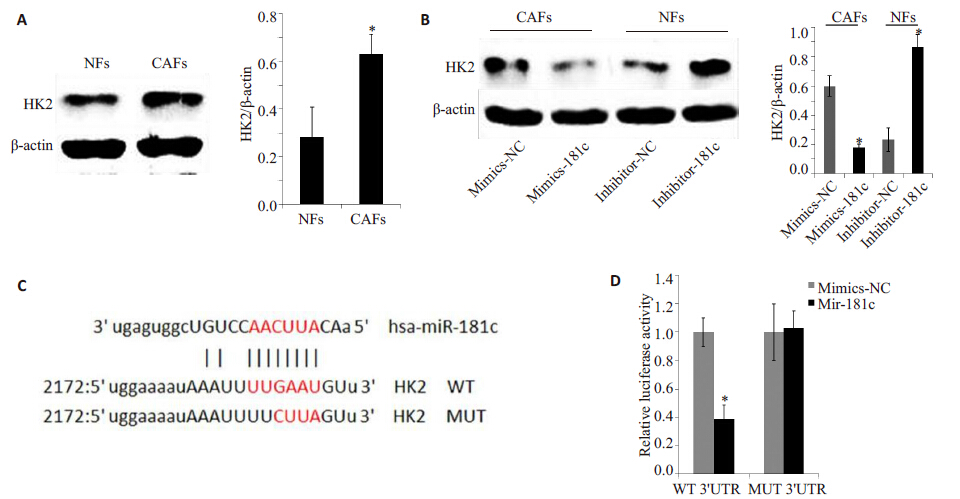
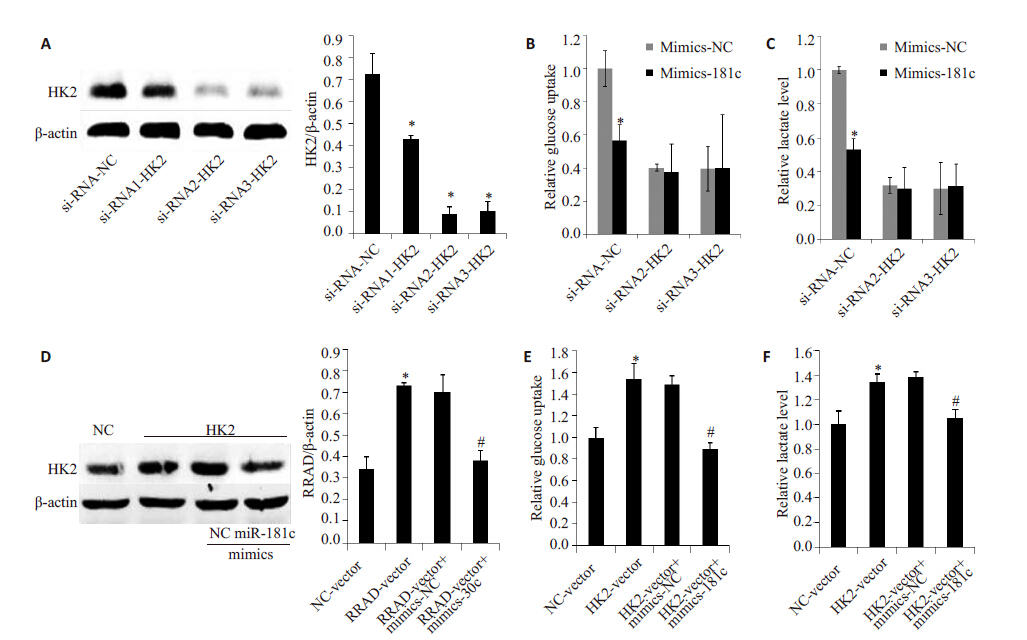
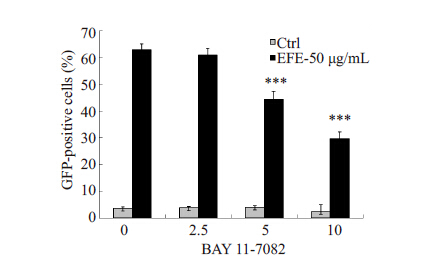
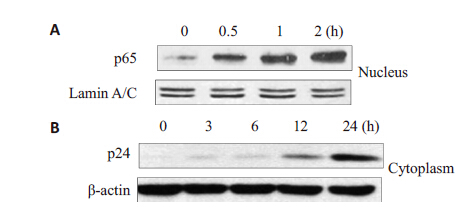
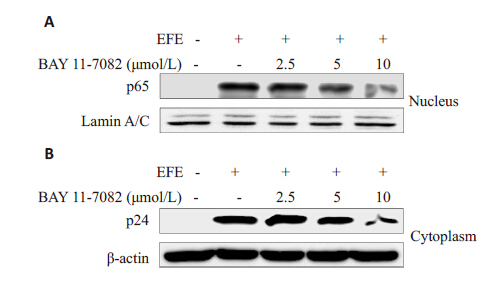
EFE刺激潜伏细胞的同时,采用2.5、5、10 μmol/L BAY 11-7082处理细胞24 h后,检测GFP阳性率,抑制结果如图5所示。结果显示BAY 11-7082呈浓度依赖方式抑制EFE激活潜伏HIV的作用,间接证明EFE激活潜伏HIV受到NF-κB通路调控。药物处理不同时间点提取核蛋白或总蛋白,用WB检测,蛋白印迹图片(图6)显示随着时间变化,p65 核内水平显著上调,且HIV 蛋白p24随着药物作用时间明显增加。为进一步确定EFE通过NF-κB 通路激活潜伏HIV,采用NF-κB 通路特异性抑制剂BAY 11-7082与EFE共同作用后(图7),发现其能够抑制EFE诱导的p65入核,同时抑制了p24 的生成。
|
图 5 BAY 11-7082对EFE激活潜伏HIV在24 h产生 的抑制作用 Figure 5 Inhibitory effect of BAY 11-7082 on EFE shown by GFP% reduction. ***P<0.01 vs control Group. |
|
图 6 EFE对HIV蛋白和NF-κB通路的影响 Figure 6 Effect of EFE on p24 and NF-κB pathway. A: Nucleus protein level of p65 increased over time; B: HIV protein p24 increased apparently in 24 h. |
|
图 7 BAY 11-7082对EFE激活的抑制作用 Figure 7 Effect of BAY 11-7082 on HIV reactivation capacity of EFE. A: Nuclear accumulation of p65 was inhibited by BAY 11-7082; B: The expression of p24 mediated by EFE was inhibited by BAY 11-7082. |
研究结果表明,药用植物狼毒大戟根部含有大量prostratin,采用丙酮一步法可高效提取,研究中采用MS 鉴定并通过HPLC测得含量。实验结果证明prostratin 能有效激活潜伏HIV,进一步探讨其激活潜伏HIV机制,发现其可通过激活NF-κB,诱导p65入核与DNA结合从而发挥转录激活作用。
狼毒大戟作为传统中药材,其适应病症与功效早有记载,因其毒性多作外用。在深入研究其活性组分的进程中[9],通过分离提取得到了多种萜类化合物:prostratin,phorbol,PMA(Phorbol 12-myristate 13-acetate),Phorbol 12,13,20-triacetate等。其中prostratin作为酪氨酸激酶抑制剂在抗肿瘤方面发挥重要疗效,近年来,又发现其有强烈的激活潜伏HIV的作用,具有良好的清除潜伏HIV实现HIV功能性治愈的前景[10]。随着各研究领域对prostratin 的关注增多,研究人员也不再局限于从植物中提取,以phorbol为原料的半合成方法以及生物合成方法取得了突破性进展[11-12]。然而,因其合成产率低以及合成难度大,依然不能改变prostratin价格昂贵的现状。本文中采用改进的丙酮一步法,可获得约40 μg/1 g 干重的高产率,在提取方法上与传统方法按化合物极性分步提取的方法相比较,具有快速,简便的优势,避免了多次分步提取导致的活性组分损失,同时也节约了大量时间和精力,充分体现了丙酮一步法的优势,不失为prostratin提取分离的优良方法[13]。
目前,关于HIV潜伏的机制并不十分明晰,总结已发现激活剂的激活途径,可主要分为以下四类:以prostratin 为代表的PKC通路激活剂;以vorinostat为代表的HDAC抑制剂;以JQ1为代表的P-TEFb激活剂;以及以IL-7为代表的免疫功能调节剂[14]。而后续深入研究发现PKC通路下游入核转录效应因子NF-κB在四类激活剂的激活效应中均发挥作用,成为HIV基因转录的关键因子[15]。经典NF-κB通路在介导炎症,免疫反应,肿瘤生长和抑制方面得到了深入研究,其在药物诱导作用下通过多种通路活化并入核与DNA相结合,发挥启动转录特异基因的作用[16]。文中采用提取的EFE作用于潜伏HIV细胞系J-Lat 10.6,发现其激活机制为促进p65入核从而发挥转录激活效应,充分论证了NF-κB通路在潜伏HIV激活过程中的关键作用。而在最新的研究中发现,非经典NF-κB通路在HIV的转录激活过程中同样发挥了非常关键的作用[17-18]。
总之,传统中药材狼毒大戟根部提取组分具有良好的激活潜伏HIV活性,其药用价值和提取分离方法值得进行深入探究。NF-κB通路在炎症肿瘤等多种疾病的发生和发展中发挥了至关重要的作用,在潜伏HIV转录激活的过程中的作用仍然值得进一步探索。本文研究为解决prostratin的来源问题提供一定的可行性,并为激活潜伏HIV机制以及HIV的清除提供了理论基础。
| [1] | Shan L, Siliciano RF. From reactivation of latent HIV-1 to elimination of the latent reservoir: the presence of multiple barriers to viral eradication[J]. Bioessays,2013, 35 (6) : 544-52. DOI: 10.1002/bies.201200170. |
| [2] | Le T, Farrar J, Shikuma C. Rebound of plasma viremia following cessation of antiretroviral therapy despite profoundly low levels of HIV reservoir: implications for eradication[J]. AIDS,2011, 25 (6) : 871-2. DOI: 10.1097/QAD.0b013e32834490b1. |
| [3] | Tyagi M, Bukrinsky M. Human immunodeficiency virus (HIV) latency: the major hurdle in HIV eradication[J]. Mol Med,2012, 18 (1) : 1096-108. |
| [4] | Katlama C, Deeks SG, Autran B, et al. Barriers to a cure for HIV: new ways to target and eradicate HIV-1 reservoirs[J]. Lancet (London, England),2013, 381 (9883) : 2109-17. DOI: 10.1016/S0140-6736(13)60104-X. |
| [5] | Archin NM, Margolis DM. Emerging strategies to deplete the HIV reservoir[J]. Curr Opin Infect Dis,2014, 27 (1) : 29-35. DOI: 10.1097/QCO.0000000000000026. |
| [6] | Rasmussen TA, Tolstrup M, Winckelmann A, et al. Eliminating the latent HIV reservoir by reactivation strategies: advancing to clinical trials[J]. Hum Vaccin Immunother,2013, 9 (4) : 790-9. DOI: 10.4161/hv.23202. |
| [7] | Williams SA, Chen LF, Kwon H, et al. Prostratin antagonizes HIV latency by activating NF-kappaB[J]. J Biol Chem,2004, 279 (40) : 42008-17. DOI: 10.1074/jbc.M402124200. |
| [8] | Tang Y, Jiang W, Wu Q, et al. Comparative characteristic of the inflammatory diterpenes in the Roots of Euphorbia fischeriana with different preparation method using HPLC-ELSD[J]. Fitoterapia,2012, 83 (3) : 427-33. DOI: 10.1016/j.fitote.2011.10.020. |
| [9] | 王金兰, 王玉起, 李涛, 等. 新鲜狼毒大戟根化学成分研究[J]. 中药材,2010, 33 (9) : 1406-9. |
| [10] | Cox PA, Johnson HE, Tavana G. Giving samoan healers credit for prostratin[J]. Science,2008, 320 (5883) : 1589. DOI: 10.1126/science.320.5883.1589. |
| [11] | Barrero RA, Chapman B, Yang Y, et al. De novo assembly of Euphorbia fischeriana root transcriptome identifies prostratin pathway related genes[J]. BMC Genomics,2011, 12 (5) : 600. |
| [12] | Dechristopher BA, Loy BA, Marsden MD, et al. Designed, synthetically accessible bryostatin analogues potently induce activation of latent HIV reservoirs in vitro[J]. Nat Chem,2012, 4 (9) : 705-10. DOI: 10.1038/nchem.1395. |
| [13] | Tang Q, Su ZH, Han ZT, et al. LC-MS method for detecting prostratin in plant extracts and identification of a high-yielding population of Euphorbia fischeriana[J]. Phytochem Lett,2012, 5 (1) : 214-8. DOI: 10.1016/j.phytol.2011.12.011. |
| [14] | Van Der Sluis RM. Jeeninga R E, berkhout B.establishment and molecular mechanisms of HIV-1 latency in T cells[J]. Curr Opin Virol,2013, 3 (6) : 700-6. DOI: 10.1016/j.coviro.2013.07.006. |
| [15] | Chan JK, Greene WC. NF-κB/Rel: agonist and antagonist roles in HIV-1 latency[J]. Curr Opin HIV AIDS,2011, 6 (1) : 12-8. DOI: 10.1097/COH.0b013e32834124fd. |
| [16] | Setia S, Sanyal SN. Nuclear factor kappa B: a pro-inflammatory, transcription factor-mediated signalling pathway in lung carcinogenesis and its inhibition by nonsteroidal anti-inflammatory drugs[J]. J Environ Pathol Toxicol Oncol,2012, 31 (1) : 27-37. DOI: 10.1615/JEnvironPatholToxicolOncol.v31.i1. |
| [17] | Liu R, Tan J, Lin Y, et al. HIV-1 Vpr activates both canonical and noncanonical NF-κB pathway by enhancing the phosphorylation of IKKα/β[J]. Virology,2013, 439 (1) : 47-56. DOI: 10.1016/j.virol.2013.01.020. |
| [18] | Manches O, Fernandez MV, Plumas J, et al. Activation of the noncanonical NF-κB pathway by HIV controls a dendritic cell immunoregulatory phenotype[J]. Proc Natl Acad Sci USA,2012, 109 (35) : 14122-7. DOI: 10.1073/pnas.1204032109. |
 2015, Vol. 35
2015, Vol. 35

