急性肺损伤(ALI)由于多种病因导致毛细血管- 肺泡上皮屏障损害,大量富含蛋白的水肿液聚集在肺泡腔内,从而使正常的气体交换障碍。急性呼吸窘迫综合症(ARDS),是ALI进行性发展的严重阶段,病死率高达40%[1]。有效地清除肺泡腔内聚集过多的水肿液是判断ALI/ARDS预后的重要因素[2]。新近研究发现精氨酸抗利尿激素(AVP)能减轻ALI/ARDS肺部炎症反应,同时在肺水肿液重吸收中扮演着重要角色[3-6],但对肺水含量的影响及作用机制尚不清楚。
目前研究认为肺泡上皮钠通道(ENaC)和Na+,K+-ATPase是肺泡腔内钠水转运的重要环节,能有效地清除聚集的水肿液,对维持气体交换和改善氧合至关重要,其中以α-ENaC和α1-Na+,K+-ATPase为关键通道蛋白[7]。本研究通过大鼠ALI模型,观察精氨酸抗利尿激素对肺水肿液清除的影响并探讨其可能机制。
1 材料和方法 1.1 动物和主要试剂健康成年的雄性SD大鼠48 只(SPF 级),体质量300±25 g,由重庆医科大学动物实验中心提供,许可证号:SCXK(渝)2007-0001。精氨酸抗利尿激素(AVP)购自American Regent 公司。脂多糖(LPS,E.coli,0111: B4)、戊巴比妥、Evans-blue购自Sigma公司。蛋白检测试剂购自南京凯基。α1- 钠/钾ATP 酶(α1-Na+ ,K+- ATPase)单克隆抗体购自Millipore公司。α-ENaC及β- 肌动蛋白(β-actin)单克隆抗体购自Santa Cruz公司。
1.2 模型建立和分组给药给予大鼠腹腔注射戊巴比妥50 mg·kg-1麻醉后,至于解剖台上,逐层解剖分离,暴露右侧颈静脉,留置静脉插管。LPS以5 mg·kg-1剂量通过颈静脉插管注入[8]。48只SD大鼠随机分为对照组:通过微量泵经颈静脉泵入等量生理盐水;模型组:建立ALI模型,建模1 h后泵入等量生理盐水;AVP组:ALI模型建立1 h后持续泵入AVP 0.57 mU·kg-1·min-1。每组16只。每组大鼠在建立模型12 h后通过颈椎脱臼,断开脊髓处死,并收集标本。
1.3 肺组织病理学检查大鼠处死后,取左肺上叶组织,置于10%甲醛溶液中固定后,石蜡包埋组织,苏木素-伊红(HE)染色,观察病理学改变。
1.4 肺水含量测定取左肺下叶组织,称湿重后置于80 ℃烤箱中烘烤72 h,然后再称干重,计算肺湿/干重比,评估肺水含量。
1.5 肺泡上皮通透性测定结扎右侧主支气管,游离右肺组织,在室温下用接注射器的灌洗器通过左侧支气管向左肺组织注入0.9% 生理盐水5 mL,反复抽吸3 次后吸出,重复3 次,置于4℃离心机上14 000 r/min离心30 min,取上清液保存。从静脉导管收集血标本,置于4 ℃离心机上1500 r/min 离心20 min。依据蛋白检测试剂盒说明书测定支气管肺泡灌洗液(BALF))和血浆中蛋白含量,计算BALF/血浆蛋白比值,评估肺泡上皮通透性[9]。
1.6 肺泡液体清除率(AFC)参照文献[10]的方法进行AFC测定。游离右肺组织并行气管插管,然后注入100%氮气,将含0.15 mg·mL-1 Evans-blue标记的5%白蛋白等渗生理盐水(5 mL·kg-1)经导管灌入大鼠左肺组织,机械通气1 h后测定肺泡内液体Evans-blue 标记的白蛋白浓度,根据公式:AFC= [(Vi-Vf)/Vi]×100%,Vf=(Vi×Pi)/Pf。Vi:起始注入肺泡内液体量,Vf:最后肺泡内液体量,Pi:起始注入的Evans-blue标记的白蛋白浓度,Pf:最后Evans-blue标记的白蛋白浓度。
1.7 免疫组织化学取左肺下叶组织,石蜡包块,切片后先后依次置于二甲苯,不同浓度的乙醇及3% H2O2,室温下孵育10 min; 蒸馏水冲洗后,PBS浸泡6 min;牛血清室温封闭30 min; 4℃与稀释的一抗(α1-Na+,K+-ATPase,α-ENaC)孵育过夜;PBS 冲洗3 次后,与生物素标记的二抗37 ℃孵育30 min;然后再与辣根酶标记抗生物素蛋白复合物反应30 min;DBA显色,苏木素复染,中性树胶封片。在高倍镜下随机选取5个视野观察,褐色颗粒为阳性结果,计算每个视野中阳性细胞数。
1.8 免疫蛋白印迹(Western blot)提取的组织蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至硝酸纤维素膜上。脱脂奶粉封闭1 h后,分别与α-ENaC(1:300)、 α1-Na+,K+-ATPase(1:500)、β-actin(1:2000)反应,4 ℃ 孵育过夜。TBST洗膜3次后,再与辣根过氧化物酶标记的IgG反应,室温孵育2 h,ECL显色。BIO-RAD成像系统扫描,Quantity One软件分析条带吸光度值,以目的条带与β-actin比值作为结果进行比较。
1.9 统计学分析所有数据以均数+标准差表示,运用SPSS13.0统计软件进行单因素方差分析或者student's-t检验,P<0.05 为差异具有显著性。
2 结果 2.1 肺组织病理变化对照组为正常肺组织,未见明显的肺泡及间质水肿和炎性细胞浸润。与对照组比较,模型组肺泡及间质水肿,炎性细胞浸润,肺泡结构破坏、出血,透明膜形成。与模型组比较,AVP组肺泡及间质水肿显著减轻,出血及肺泡结构破坏减轻,炎性细胞浸润减少,未见透明膜形成(图1)。
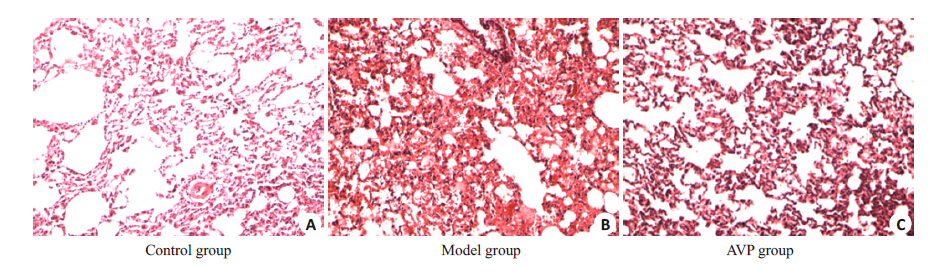
|
图 1 各组大鼠肺组织病理学 Figure 1 Histological changes of the lung in each group(HE,original magnification: ×10). |
与对照组比较,模型组肺水含量和肺泡上皮通透性显著增加(P<0.05);AVP治疗后肺水含量和肺泡上皮通透性显著降低(P<0.05,表1)。
2.3 肺泡液体清除率与对照组比较,模型组AFC显著降低52.9%(P< 0.05);AVP治疗后,AFC显著增加187%(P<0.05,表1)。
| 表 1 肺水含量和肺泡上皮通透性 Table 1 Lung water content and alveolar permeability in each group (Mean±SD,n=8) |
与对照组比较,模型组α-ENaC 和α1-Na+ ,K+- 显著降低(P<0.05);AVP治疗后,α-ENaC 和α1-Na+,K+-ATPase 的表达显著增加(P<0.05,图2,表2)。
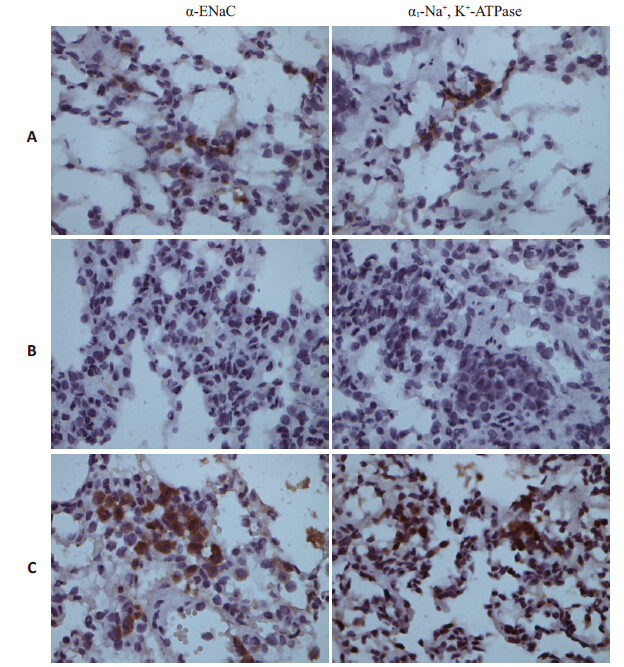
|
图 2 免疫组织化学法检测各组肺组织α-ENaC和α1-Na+,K+-ATPase的表达 Figure 2 Immunocytochemical detection of the expressions of α-ENaC and α1-Na+ , K+-ATPase in the lungs in each group. A: Control group; B: Model group; C: AVP group. |
| 表 2 肺组织α-ENaC和α1- Na+,K+-ATPase的表达 Table 2 The expressions of α-ENaC and α1-Na+, K+-ATPase (Mean±SD, n=8) |
与对照组比较,模型组α-ENaC 和α1-Na+,K+- ATPase的表达显著降低(P<0.05);AVP治疗后,α-ENaC 和α1-Na+,K+-ATPase 的表达显著增加(P<0.05,图3,表2)。
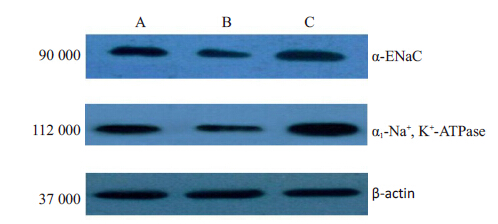
|
图 3 Western blot 法检测肺组织α-ENaC和α1-Na+ , K+-ATPase的表达 Figure 3 Expressions of α-ENaC and α1-Na+, K+-ATPase in the lungs of the rats detected by Western blotting. |
ALI/ARDS因肺泡腔内过多的水肿液聚集,含水量为正常的3~4倍,从而导致气体交换障碍,引起顽固性低氧血症。研究发现有效地清除肺泡腔内过多的水肿液,对维持气体交换和改善患者氧合至关重要,可明显降低ARDS患者的病死率[11]。AVP作为一种较为特殊的血管活性激素,其特点是舒张肺血管和收缩全身血管。在脓毒血症导致的急性肺损伤患者中AVP 水平异常降低,并且给予外源性AVP治疗后能恢复血管活性,减轻肺组织炎症[4-5]。新近研究发现AVP通过促进上皮钠通道转运的途径减轻了慢性心衰导致的肺水肿,发挥了关键作用[12]。因此,本研究试图通过建立大鼠ALI 模型,探讨AVP对肺水肿液清除的作用机制。
LPS通过激活巨噬细胞产生炎性介质,在肺毛细血管处聚集了大量中性粒细胞,损伤肺泡-毛细血管屏障,导致肺泡及间质水肿,模拟了ALI/ARDS 的表现[13]。本研究中,通过LPS 建立ALI 的动物模型发现,肺泡及间质水肿,炎性细胞浸润,肺泡结构破坏、出血,透明膜形成,同时肺水含量和肺泡上皮通透性显著增加。经过AVP治疗后,肺水含量和肺泡上皮通透性显著降低,肺损伤程度也明显减轻。
ENaC 存在于肺泡上皮细胞顶膜,是完成肺泡腔内钠离子跨膜转运的限速步骤和提供AFC的源动力,同时与位于细胞底膜的Na+,K+-ATPase 共同完成钠水转运过程,在AFC中发挥十分重要的主导作用;其中,α-ENaC和α1-Na+,K+- ATPase是发挥肺水肿液清除的关键通道蛋白[7, 14-15]。本研究中,ALI模型组α-ENaC和α1- Na+,K+-ATPase表达显著降低,AFC明显减少,肺水肿程度加重。同时经AVP治疗后,与模型组比较,AFC明显增加,肺水肿减轻,肺损伤程度也明显减轻,这与Ji 等[3]研究结果一致。但本实验通过进一步探讨AVP 对α-ENaC 和α1- Na+,K+-ATPase的作用发现,与模型组比较,AVP治疗后使AFC增加,促进钠水转运,从而减轻肺水肿的机制是通过上调α-ENaC和α1-Na+,K+-ATPase 的表达实现的,从而有益于肺泡腔的气体交换,改善氧合,提示了AVP在ALI中促进肺水肿液清除的可能机制,这在国内外同类研究中报道甚少。
综上所述,AVP可以有效促进ALI时肺泡腔内过多的水肿液清除,从而减轻肺水含量,其作用途径可能是上调α-ENaC和α1-Na+,K+-ATPase通道蛋白实现的,为临床治疗提供了理论依据。
| [1] | Villar J, Sulemanji D, Kacmarek RM. The acute respiratory distress syndrome: incidence and mortality, has it changed?[J]. Curr Opin Crit Care,2014, 20 (1) : 3-9. DOI: 10.1097/MCC.0000000000000057. |
| [2] | Hollenhorst MI, Richter K, Fronius M. Ion transport by pulmonary epithelia[J]. J Biomed Biotechnol,2011 : 174306. |
| [3] | Ji M, Li R, Li GM, et al. Effects of combined levosimendan and vasopressin on pulmonary function in porcine septic shock[J]. Inflammation,2012, 35 (3) : 871-80. DOI: 10.1007/s10753-011-9388-3. |
| [4] | Boyd JH, Holmes CL, Wang Y, et al. Vasopressin decreases sepsisinduced pulmonary inflammation through the V2R[J]. Resuscitation,2008, 79 (2) : 325-31. DOI: 10.1016/j.resuscitation.2008.07.006. |
| [5] | Westphal M, Rehberg S, Maybauer MO, et al. Cardiopulmonary effects of low-dose arginine vasopressin in ovine acute lung injury[J]. Crit Care Med,2011, 39 (2) : 357-63. DOI: 10.1097/CCM.0b013e3181feb802. |
| [6] | Perks AM, Cassin S. The effects of arginine vasopressin and epinephrine on lung liquid production in fetal goats[J]. Can J Physiol Pharmacol,1989, 67 (5) : 491-8. DOI: 10.1139/y89-078. |
| [7] | Soukup B, Benjamin A, Orogo-Wenn M, et al. Physiological effect of protein kinase C on ENaC-mediated lung liquid regulation in the adult rat lung[J]. Am J Physiol Lung Cell Mol Physiol,2012, 302 (1) : L133-9. DOI: 10.1152/ajplung.00031.2011. |
| [8] | Rojas M, Woods CR, Mora AL, et al. Endotoxin-induced lung injury in mice: structural, functional, and biochemical responses[J]. Am J Physiol Lung Cell Mol Physiol,2005, 288 (2) : L333-41. |
| [9] | Magnotti LJ, Upperman JS, Xu DZ, et al. Gut-derived mesenteric lymph but not portal blood increases endothelial cell permeability and promotes lung injury after hemorrhagic shock[J]. Ann Surg,1998, 228 (4) : 518-27. DOI: 10.1097/00000658-199810000-00008. |
| [10] | Deng W, Li CY, Tong J, et al. Regulation of ENaC-mediated alveolar fluid clearance by insulin via PI3K/Akt pathway in LPSinduced acute lung injury[J]. Respir Res,2012, 13 (1) : 29. DOI: 10.1186/1465-9921-13-29. |
| [11] | Herold S, Gabrielli NM, Vadász I. Novel concepts of acute lung injury and alveolar-capillary barrier dysfunction[J]. Am J Physiol Lung Cell Mol Physiol,2013, 305 (10) : L665-81. DOI: 10.1152/ajplung.00232.2013. |
| [12] | Guetta J, Klorin G, Tal R, et al. Vasopressin-2 receptor antagonist attenuates the ability of the lungs to clear edema in an experimental model[J]. Am J Respir Cell Mol Biol,2012, 47 (5) : 583-8. DOI: 10.1165/rcmb.2012-0117OC. |
| [13] | Fialkow L, Wang Y, Downey GP. Reactive Oxygen and Nitrogen species as signaling molecules regulating neutrophil function[J]. Free Radic Biol Med,2007, 42 (2) : 153-64. DOI: 10.1016/j.freeradbiomed.2006.09.030. |
| [14] | 赵燕, 何婧, 管弦, 等. 黄芪注射液对急性肺损伤小鼠钠通道表达的影响[J]. 南方医科大学学报,2012, 32 (11) : 1603-5. |
| [15] | Lazrak A, Chen L, Jurkuvenaite A, et al. Regulation of alveolar epithelial Na+ channels by ERK1/2 in chlorine-breathing mice[J]. Am J Respir Cell Mol Biol,2012, 46 (3) : 342-54. DOI: 10.1165/rcmb.2011-0309OC. |
 2015, Vol. 35
2015, Vol. 35

