心肌纤维化(myocardial fibrosis,MF)是指病理状态下心肌成纤维细胞过度增殖,细胞外基质(主要是胶原纤维)过量沉积,导致心室重构、心室顺应性下降,最终影响心脏的收缩舒张功能,也是慢性心力衰竭的重要原因[1]。心肌纤维化发生机制复杂,涉及多种细胞因子、肾素-血管紧张素-醛固酮系统(RAAS)、氧化应激和炎症反应等,是目前国内外学者研究的热点。有资料证实[2-3],氧化应激和转化生长因子-β1(transforming growth factor-β1,TGF-β1)与心肌纤维化的形成密切相关。依达拉奉(Eda)是一种新型自由基清除剂,能有效清除自由基、减轻氧化应激、并可能通过抑制某些细胞炎症因子对心脏起保护作用[4],自2001年以来广泛用于急性缺血性脑中风[5]。然而,关于依达拉奉治疗心肌纤维化及其机制的研究国内鲜有报道。因此,本研究采用依达拉奉干预异丙肾上腺素(ISO)诱导的大鼠心肌纤维化,探讨依达拉奉抗心肌纤维化的作用及其可能机制,为依达拉奉临床应用奠定理论基础。
1 资料与方法 1.1 药品、试剂依达拉奉(Eda)(南京先声东元制药有限公司),异丙肾上腺素(ISO)(湖北康宝泰精细化工有限公司);超氧化物岐化酶(SOD)、丙二醛(MDA)、羟脯氨酸(Hyp)试剂盒(南京建成生物工程研究所);大鼠Ⅰ型胶原蛋白(CollagenⅠ)、Ⅲ型胶原蛋白(CollagenⅢ)ELISA 试剂盒(上海西唐生物科技有限公司);单克隆抗体TGF-β1、β-actin 一抗(cell signaling technical,USA),Masson 染色试剂盒、羊抗兔二抗(中杉金桥);细胞裂解液、BCA蛋白定量试剂盒(碧云天生物技术研究所)。
1.2 动物分组、造模及给药50 只SD雄性大鼠,8 周龄,体质量约250~300 g,由中山大学实验动物中心提供(合格证号:44008500006902)。按照随机数字表法随机分5组(每组10只):对照组,异丙肾上腺素(ISO)模型组,依达拉奉(Eda)(低、中、高浓度)组。参考Rona等[6]的造模方法,模型组和依达拉奉组均首次皮下注射异丙肾上腺素20.0 mg/kg,第2天注射异丙肾上腺素10.0 mg/kg,第3 天5.0 mg/kg,第4 天起3.0 mg/kg,连续1 周,共10 d;对照组皮下注射等量生理盐水。依达拉奉低、中、高剂量组即在异丙肾上腺素基础上分别予依达拉奉3、5、10 mg/(kg·d),从第2天开始经大鼠尾静脉给药,每日2次,连续14 d,造模和给药间隔时间4 h以上。动物实验方法符合南方医科大学动物福利和伦理管理委员会要求。
1.3 检测心肌组织氧化指标和纤维化指标末次给药后,禁食24 h,全身麻醉取出心脏,剔除心房、大血管、心外膜脂肪组织及瓣膜,生理盐水清洗,滤纸吸干,电子天平称取心室质量(VW)、左室质量(LVW),左心室重量指数(LVMI)=LVW/VW。取左室近心尖1/2处心肌下部组织,研磨成组织匀浆,检测组织的SOD、MDA、NO 和Hyp;ELISA 方法检测组织的 collagenⅠ、collagen Ⅲ。
1.4 Masson染色观察心肌纤维化程度取左室近心尖1/2处心肌上部组织,福尔马林固定后,石蜡包埋、切片,进行Masson染色以CISA-1000计算机图像软件分析,随机读取6个视野,计算胶原容积分数(CVF)。
1.5 检测大鼠心肌TGF-β1表达(1)Western blot 测定TGF-β1取左室近心尖1/2 处心肌下部组织,提取蛋白,BCA比色法蛋白定量,蛋白样品煮沸7 min,上样后置于电泳缓冲液中电泳,分离目的蛋白,90 V 电转膜120 min,5% BSA 封闭1 h 后,TGF-β1和β-actin(内参)一抗4 ℃孵育过夜,TBST洗膜后,用HRP标记的羊抗兔二抗室温孵育1 h,TBST洗膜,ECL显色,曝光扫描,软件分析光密度分析。
(2)免疫荧光石蜡包埋切片,经二甲苯、梯度酒精脱蜡,PBS浸泡,3% H2O2室温孵育10 min,PBS 冲洗,柠檬酸抗原修复后,PBS冲洗,5% BSA室温封闭30 min。TGF-β1一抗4 ℃孵育过夜;PBS冲洗,抗兔二抗室温避光孵育60 min,PBS冲洗;DAPI和荧光抗淬灭剂混合封片,镜下随机取6个视野,计算表达面积。
1.6 统计学方法采用SPSS18.0 统计软件分析。实验数据以均数±标准差表示,多组均数间比较采用单因素方差分析,组间多重比较采用LSD-t检验。相关性分析采用Pearson或Spearman法。P<0.05为差异有统计学意义。
2 结果 2.1 依达拉奉对心肌纤维化的影响 2.1.1 各组心肌组织Masson染色模型组心肌坏死灶内纤维增生明显,正常心肌组织呈红色,发生纤维化的心肌纤维和血管周围呈蓝色。模型组纤维化显著,依达拉奉低、中、高浓度组纤维化较模型组明显减少(图 1)。
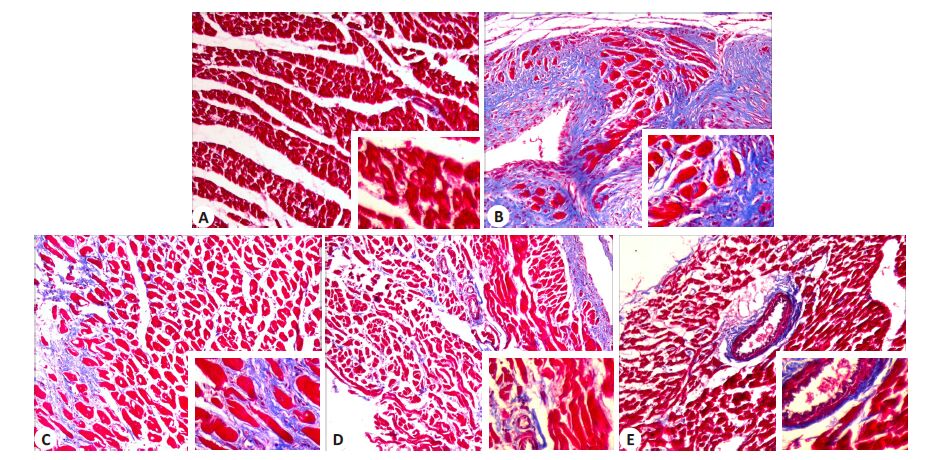
|
图 1 各组心肌组织Masson染色 Figure 1 Masson staining of the myocardial tissue in the 5 groups (Original magnification: ×100; original magnification: ×400 for inserts). A: Control; B: Model group; C-E: Low-,moderate-,and high-dose edaravone groups,respectively |
ISO 模型组CVF(17.83 ± 1.49)%和 LVMI(2.64±0.11)mg/g均显著高于对照组CVF(2.52±0.34)%和LVMI(1.80±0.06)mg/g(P=0.000),依达拉奉低、中、高浓度组CVF和LVMI则显著低于模型组(P<0.05),并随着治疗浓度的增加,CVF和LVMI呈下降趋势(P<0.05,图 2)。
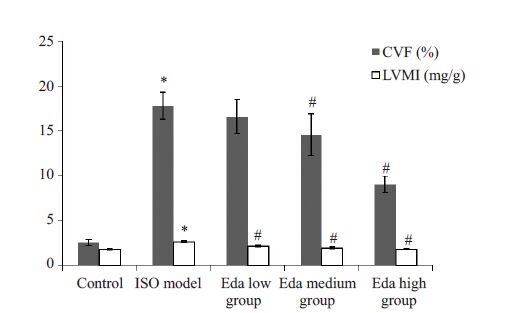
|
图 2 各组心肌CVF和LVMI比较 Figure 2 Comparison of myocardial CVF and LVMIamong the 5 groups. *P<0.05 vs control; #P<0.05 vs model group. |
模型组ColⅠ、ColⅢ和Hyp均显著高于对照组(P=0.000),依达拉奉低、中、高浓度组ColⅠ、ColⅢ和Hyp则显著低于模型组,并随着治疗浓度的增加,ColⅠ、ColⅢ和Hyp呈下降趋势(P<0.05,图 3)。
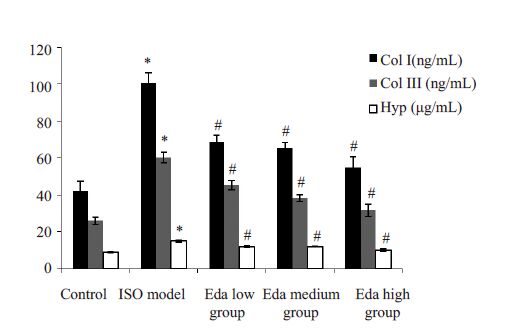
|
图 3 各组心肌组织collagenⅠ、collagenⅢ和Hyp含量比较 Figure 3 Myocardial contents of collagen I,collagen Ⅲ and hydroxyproline in the 5 groups. *P<0.05 vs control; #P<0.05 vs model group. |
模型组MDA显著高于对照组(P=0.000),SOD和 NO水平则显著低于对照组(P=0.000),依达拉奉低、中、高浓度组MDA明显低于模型组,并随着治疗浓度的增加,MDA呈下降趋势;依达拉奉低、中、高浓度组SOD和NO明显高于模型组,并随着浓度的增加,SOD和NO均呈上升趋势(P<0.05,图 4)。
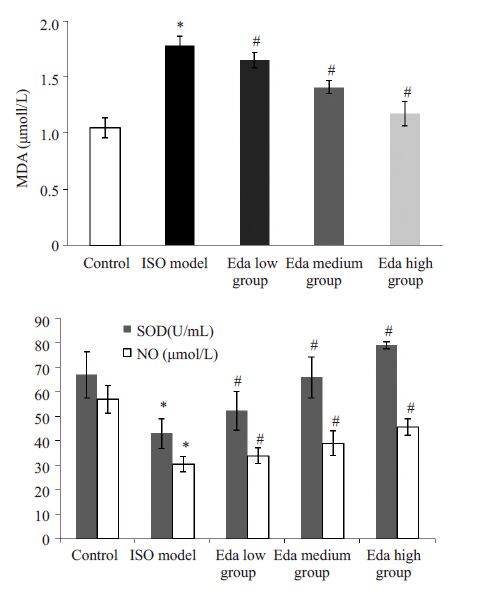
|
图 4 各组MDA、SOD、NO含量比较 Figure 4 Myocardial contents of MDA,SOD and NO in the5 groups. *P<0.05 vs control; #P<0.05 vs model group. |
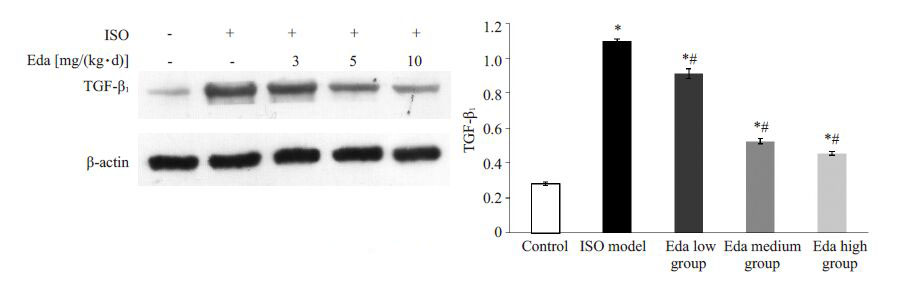
模型组TGF-β1显著高于对照组(P=0.000),依达拉奉低、中、高浓度组TGF-β1明显低于模型组,并随着治疗浓度的增加,TGF-β1呈下降趋势(P<0.05,图 5)。
|
图 5 各组心肌组织TGF-β1的表达 Figure 5 Myocardial expression of TGF-β1 in the 5 groups. *P<0.05 vs control; #P<0.05 vs model group. |
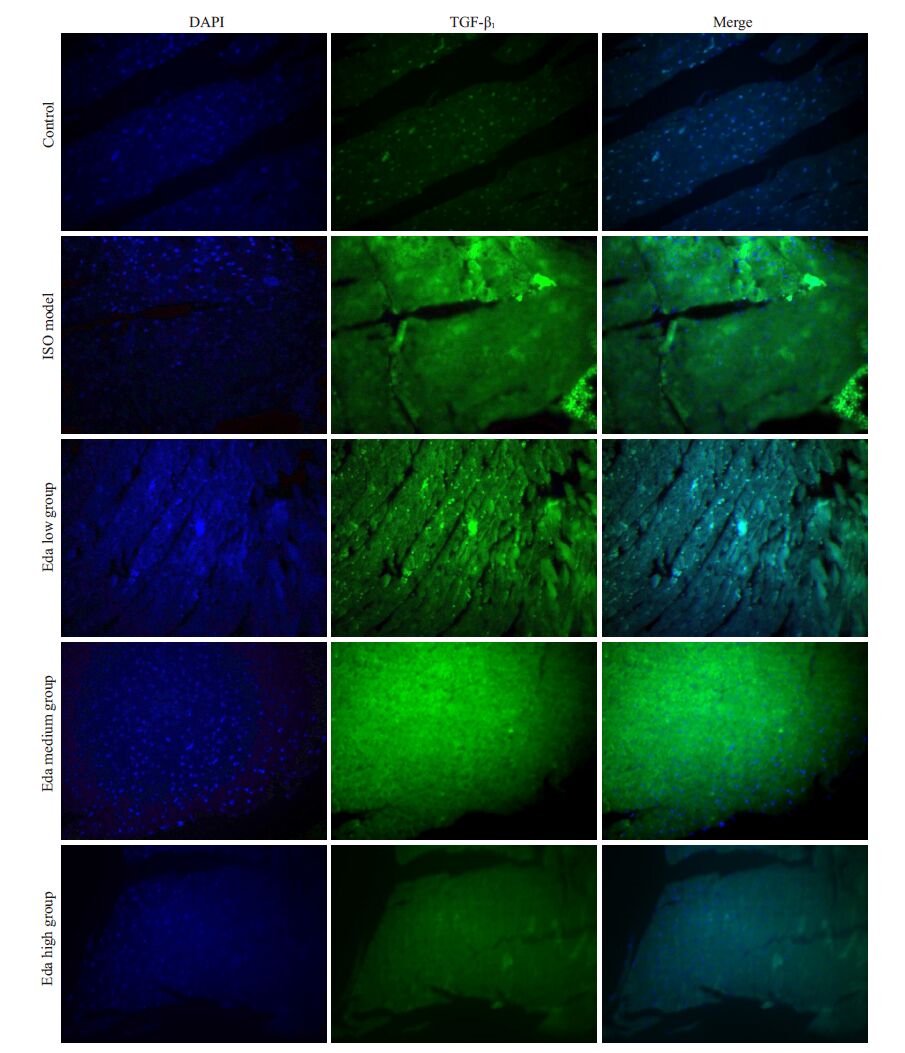
如图 6,模型组TGF-β1荧光强度显著高于对照组,依达拉奉低、中、高浓度组 TGF-β1荧光强度明显低于模型组(图 6)。
|
图 6 TGF-β1免疫荧光表达 Figure 6 TGF-β1 immunofluorescent staining of the myocardial tissue in the 5 groups (Original magnification: ×400) . |
经Pearson 相关分析得出,MDA与LVMI、CVF、 ColⅠ、ColⅢ、Hyp呈正相关;SOD与LVMI、CVF、ColⅠ、 ColⅢ、Hyp呈负相关;NO与LVMI、CVF、ColⅠ、ColⅢ、 Hyp亦呈负相关(表 1)。
| 表 1 氧化应激指标与LVMI、CVF、ColⅠ、ColⅢ、Hyp的关系 Table 1 Correlation of the indexes of oxidative stress with LVMI,CVF,Col I,Col Ⅲ,Hyp |
经Spearman 相关分析得出,TGF-β1 与LVMI、 CVF、ColⅠ、ColⅢ、Hyp、MDA呈正相关;TGF-β1与 SOD、NO呈负相关(表 2)。
| 表 2 TGF-β1与LVMI、CVF、ColⅠ、ColⅢ、Hyp、SOD、MDA、 NO的关系 Table 2 Correlation of TGF-β1 with LVMI,CVF,and myocardial contents of Col I,Col Ⅲ,Hyp,SOD,MDA,and NO |
心肌纤维化形成机制复杂,与氧化应激、炎症反应、多种炎性细胞因子(如TNF-α、TGF-β1、CTGF等)关系密切。依达拉奉是一种自由基清除剂,有抗氧化作用。近期研究发现,依达拉奉能通过对抗氧化应激而抑制肺纤维化和肺损伤[7-8]。近年,学者们不断对依达拉奉治疗心脏疾病的作用进行探讨。黄涌等[9]发现依达拉奉可保护H9c2 心肌细胞对抗异丙肾上腺素诱导的损伤作用;依达拉奉具有调节氧化应激和内质网应激介导的心肌细胞凋亡和纤维化作用[10]。但依达拉奉对心肌纤维化的治疗作用目前研究较少,本研究以异丙肾上腺素成功构建大鼠心肌纤维化模型,并同时予不同浓度的依达拉奉进行干预,病理评分发现,异丙肾上腺素组心肌坏死灶内纤维增生明显,而依达拉奉干预后纤维增生明显减少,并随着依达拉奉浓度的增高,心肌纤维化缓解效果更好,表明依达拉奉能延缓心肌纤维化的发生和发展。
氧化应激,即活性氧的生成过多和(或)细胞内抗氧化防御系统受损,从而对组织细胞产生多种毒性作用[11]。大量证据表明[2-3, 12],活性氧可通过多种信号通路导致心肌细胞坏死、凋亡,并通过灭活NO导致血管内皮功能紊乱,进而加速心肌纤维化的形成和发展。 MDA、SOD、NO水平可反映体内清除氧自由基的能力和氧化应激、抗氧化水平[13]。部分报道证明[6, 9],异丙肾上腺素能促使机体活性氧增加,氧化应激水平升高。本研究发现,经异丙肾上腺素成功诱导的大鼠心肌纤维化,提示氧化应激水平升高能促使心肌纤维化的发生;同时,模型组的MDA较对照组显著升高,而SOD和 NO 明显降低;经氧化应激指标与心肌纤维化评价指标(ColⅠ、ColⅢ、Hyp)相关性分析得出,MDA与ColⅠ、 ColⅢ、Hyp呈正相关,而SOD和NO与ColⅠ、ColⅢ、 Hyp呈负相关,此提示在心肌纤维化形成过程中氧化应激水平也呈上升趋势,这与李贵芝等[14]的研究结果类似。国内外研究显示[9-10],对干预细胞和组织的氧化应激上,依达拉奉有抗氧化作用。本文以依达拉奉干预心肌纤维化大鼠后SOD和NO明显高于模型组而MDA明显低于模型组,表明依达拉奉减轻了氧自由基对心肌组织的损伤,降低了氧化应激水平。
TGF-β1能调节细胞外基质(ECM)代谢,与ECM沉积关系最密切,被公认为器官纤维化的治疗靶点[15]。 TGF-β/Smads信号通路在心肌梗死、心力衰竭、心肌纤维化等疾病中发挥重要作用[16]。TGF-β1的增加是异丙肾上腺素、血管紧张素、内皮素等所致的心肌纤维化的共同通路[17]。本文亦证实了异丙肾上腺素诱导的心肌纤维化模型中TGF-β1表达显著升高,而且TGF-β1与心肌纤维化相关指标ColⅠ、ColⅢ、Hyp呈正相关,提示随着心肌纤维化的形成和进展,TGF-β1可能呈上升趋势,而TGF-β1的升高也促进心肌纤维化的进程。此外,TGF-β1与氧化应激的启动密切相关[18]。本文相关性分析得出,TGF-β1与MDA呈正相关,与SOD、NO呈负相关,提示TGF-β1可能随着氧化应激水平的升高而增加,进而加速了心肌纤维化。而依达拉奉干预后TGF-β1明显减少,提示依达拉奉也能减少TGF-β1的水平,其机制可能为依达拉奉通过减轻氧化应激而抑制TGF-β1表达,进而延缓心肌纤维化的发生和发展。
| [1] | Udelson JE, Konstam MA. Ventricular remodeling fundamental to the progression (and regression) of heart failure[J]. J Am Coll Cardiol,2011, 57 (13) : 1477-9. DOI: 10.1016/j.jacc.2011.01.009. |
| [2] | Purnomo Y, Piccart Y, Coenen T, et al. Oxidative stress and transforming growth factor-β1-induced cardiac fibrosis[J]. Cardiovasc Hematol Disord Drug Targets,2013, 13 (2) : 165-72. DOI: 10.2174/1871529X11313020010. |
| [3] | 田晋帆, 葛长江, 吕树铮, 等. 心肌纤维化发病机制及其防治研究进展[J]. 中国医药,2014, 9 (11) : 1712-5. |
| [4] | 邝桐博, 皋聪, 季晖. 自由基清除剂依达拉奉的药理作用研究进展[J]. 安徽医药,2014, 18 (5) : 804-8. |
| [5] | Aksar AT, Yuksel N, Gok M, et al. Neuroprotective effect of edaravone in experimental glaucoma model in rats: a immuno- fluorescence and biochemical analysis[J]. Int J Ophthalmol,2015, 8 (2) : 239-44. |
| [6] | Rona G, Chappel CI, Balazs T, et al. An infarct-like myocardial lesion and other toxic manifestations produced by isoproterenol in the ra[J]. AMA Arch Pathol,1959, 67 (4) : 443-55. |
| [7] | Itoh H, Kishore AH, Lindqvist A, et al. Transforming growth factor β1 (TGFβ1) and progesterone regulate matrix metalloproteinases (MMP) in human endometrial stromal cells[J]. J Clin Endocrinol Metab,2012, 97 (6) : E888-97. DOI: 10.1210/jc.2011-3073. |
| [8] | 卢明军, 郭建荣, 吕娜, 等. 依达拉奉联合血必净对家兔肠梗阻术后肺组织的保护[J]. 宁夏医科大学学报,2015, 37 (1) : 14-6. |
| [9] | 黄涌, 王秀玉, 傅璐, 等. ERK1/2介导依达拉奉保护H9c2心肌细胞对抗异丙肾上腺素诱导的损伤作用[J]. 南方医科大学学报,2010, 30 (12) : 2663-6. |
| [10] | Arumugam S, Thandavarayan RA, Veeraveedu PT, et al. Beneficial effects of edaravone, a novel antioxidant, in rats with dilated card iomyopathy[J]. J Cell Mol Med,2012, 16 (9) : 2176-85. DOI: 10.1111/jcmm.2012.16.issue-9. |
| [11] | Murray TV, Ahmad A, Brewer AC. Reactive Oxygen at the heart of metabolism[J]. Trends Cardiovasc Med,2014, 24 (3) : 113-20. DOI: 10.1016/j.tcm.2013.09.003. |
| [12] | Madamanchi NR, Runge MS. Redox signaling in cardiovascular health and disease[J]. Free Radic Biol Med,2013, 61 (61) : 473-501. |
| [13] | Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects[J]. Rev Endocr Metab Disord,2010, 11 (1) : 31-9. DOI: 10.1007/s11154-010-9131-7. |
| [14] | 李贵芝, 周红, 房彩霞, 等. 法舒地尔抑制氧化应激反应减轻2型糖尿病大鼠心肌纤维化[J]. 基础医学与临床,2014, 34 (2) : 216-221. |
| [15] | Aupperle H, Baldauf K, Maerz I. An immunohistochemical study of feline myocardial fibrosis[J]. J Comp Pathol,2011, 145 (2/3) : 158-73. |
| [16] | Sui X, Wei H, Wan g D. Novel mechanism of cardiac protection by valsartan: synergetic roles of TGF-β1 and HIF-1α in Ang II-mediated fibrosis after myocardial infarction[J]. J Cell Mol Med,2015, 19 (8) : 1773-82. DOI: 10.1111/jcmm.2015.19.issue-8. |
| [17] | Sun HX, Yang SJ. Research of enalapril on rat myocardial fibrosis and its mechanism[J]. Chin Pharmacol Bull,2009, 25 (8) : 1060-4. |
| [18] | Chen YR, Zweier JL. Cardiac mitochondria and reactive oxygen species generation[J]. Circ Res,2014, 114 (3) : 524-37. DOI: 10.1161/CIRCRESAHA.114.300559. |
 2015, Vol. 35
2015, Vol. 35

