结直肠癌(CRC)是男性第3、女性第2常见的恶性肿瘤,每年全球新增约140万CRC患者,死亡约69万[1]。 CRC在中国的发病率越来越高、越来越年轻,CRC患者术后死亡率也越来越高,复发和转移是主要原因。因此寻找能早期预测CRC患者浸润、转移和预后的指标就越来越迫切。含WW结构域的氧化还原酶(WWOX)基因位于人类常染色体16q23.1-24.1,该基因跨越脆性位点FRA16D[2],在多种肿瘤中表达异常,主要表现为表达缺失和甲基化[3]。有研究表明,异常表达的WWOX丧失了对肿瘤细胞增殖和凋亡的抑制作用,从而促进了肿瘤的浸润和进展[4]。肿瘤干细胞(CSCs)是肿瘤患者内存在的一小撮具有自我更新能力及分裂的不对称性能力的细胞群。CD133是CSCs中最常用的标记,其在癌旁正常对照组织中也常有表达[5]。CD133 被认为是 CSCs标记物,一开始是从造血干细胞表面被发现的,后来研究发现,在其他多种实体瘤中也有CD133表达的异常增高[5-8]。目前关于WWOX与CD133蛋白在CRC中相互之间的关系研究很少,本研究通过免疫组织化学 ElivisionTM plus 法检测174 例CRC患者肿瘤组织中 WWOX和CD133蛋白的表达,分析它们之间可能存在的联系,并探讨它们在CRC浸润、转移以及患者预后评估中的可能作用。
1 材料与方法 1.1 一般资料收集蚌埠医学院第一附属医院临床病理科2007年1月~2009年12月存档石蜡包埋CRC组织标本174例(术前均未行放、化疗及其它抗肿瘤治疗)和正常结直肠黏膜组织80例,所有的患者均有完善的临床病理资料及随访资料,入选患者随访至患者死亡或截止至2015年1月,随访时间为8~96个月。详细临床病理资料见表 1。
| 表 1 174例CRC中WWOX和CD133的表达及其与临床病理因素之间的关系 Table 1 Correlation of WWOX and CD133 with clinicopathological characteristics in 174 patients with CRC |
80例正常对照组,随机取自上述174例CRC中切缘正常结直肠黏膜组织(远离CRC肿块>5.0 cm)。所有病理学资料均经2名病理医师复习及证实。
1.2 试剂多克隆抗体兔抗人WWOX及单克隆抗体鼠抗人 CD133均购自美国Abcam;ElivisionTM plus试剂盒均购自中国福州迈新生物技术有限公司(产品编号 KIT-9901)。
1.3 实验方法所有CRC 组织标本均经4%甲醛固定、石蜡包埋,4 μm厚连续石蜡常规切片脱蜡水化,行免疫组织化学,具体染色步骤均按照试剂盒说明书进行,同时选用已知阳性片作阳性对照,并用PBS液替代一抗作为空白对照。
1.4 结果判定WWOX主要是以细胞浆内出现黄色或棕黄色颗粒为阳性;CD133主要是以细胞膜或细胞浆出现黄色或棕黄色颗粒为阳性。所有标记表达结果均采取二次计分法,即根据着色强度和着色范围综合计分,具体办法参见相关文献[8]。最后若强度和范围积分≥3分为阳性,<3分为阴性。最终由两位病理医生采用独立双盲法,取平均值来判定免疫组化结果。
1.5 统计分析采用SPSS20.0 统计软件对数据进行统计分析。 WWOX和CD133蛋白表达的阳性组和阴性组生存分析采用Kaplan-Meier法,组间比较采用log-rank检验,上述指标在CRC组织中的表达与正常结直肠黏膜组织、各临床病理参数之间及它们相互之间的关系采用χ2、 Spearman等级相关检验;P<0.05为差异有统计学意义。
2 结果 2.1 CRC组织中WWOX蛋白的表达及其临床病理因素的关系WWOX蛋白在正常结直肠黏膜组织中的阳性率为87.5%(70/80),在CRC组织中的阳性率为41.4%(72/174),差异在两组之间有统计学意义(P<0.05,图 1)。 WWOX蛋白的阳性表达率与CRC患者的年龄、性别、肿瘤大小及位置等之间的差异均无统计学意义(P>0.05,表 1)。进一步分析发现,随着CRC组织的分化越差、浸润越深,WWOX蛋白的阳性率越低,其之间的差异均有统计学意义;淋巴结转移组的患者,其WWOX蛋白的阳性率明显低于淋巴结无转移组;Duke分期越高,其WWOX蛋白的阳性率显著低于Duke分期低的组,组间差异均有统计学意义(P<0.05,表 1)。
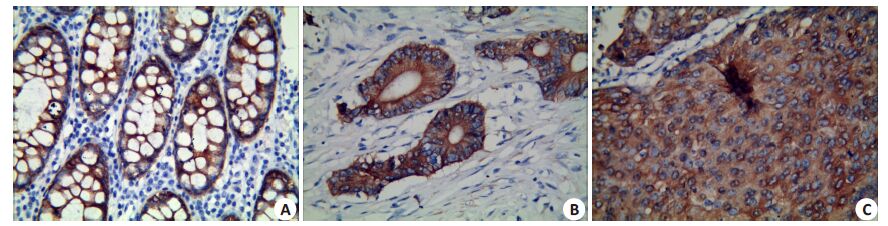
|
图 1 WWOX在不同结直肠组织中的表达 Figure 1 Expression of WWOX in different colorectal tissues (Elivivion staining,original magnification: × 400) . A: Normal colorectal mucosa tissues; B: Well differentiated CRC; C: Poorly differentiated CRC. |
CD133蛋白在正常结直肠黏膜组织中的阳性率为5.0%(4/80),在CRC组织中为53.4%(93/174),表达差异在两组之间有统计学意义(P<0.001,图 2)。随后的统计发现,随着CRC组织的分化程度越差、浸润深度越深、临床Duke分期越高,CD133蛋白的阳性率就越高,差异有统计学意义(P<0.05);淋巴结转移组中,其 CD133的阳性率显著高于无淋巴结转移组(表 1)。另外,CD133蛋白的阳性率与CRC患者性别、年龄、肿瘤大小及位置等之间的差异均无统计学意义。
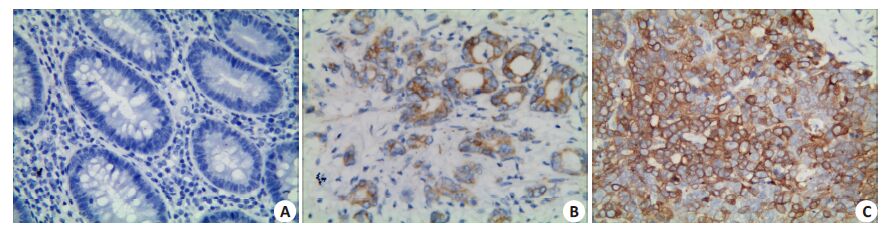
|
图 2 CD133在不同结直肠组织中的表达 Figure 2 Expression of CD133 in different colorectal tissues (Elivivion staining,original magnification: × 400) . A: Negative expression of CD133 in normal colorectal mucosa tissues; B: Positive expression of CD133 in well differentiated CRC; C: Positive expression of CD133 in poorly differentiated CRC. |
Spearman 相关分析显示,在CRC组织中WWOX的表达与CD133 的表达呈负相关关系(r=-0.456,P<0.001,表 1)。
2.4 COX多因素回归分析将CRC患者的年龄(分为≥60岁组与<60岁组);性别(分为男性组与女性组);肿瘤的长径(分为<5.0 cm组和≥5.0 cm组);肿瘤的位置(分为结肠组和直肠组)、分化程度(分为高分化组、中分化组和低分化组);淋巴结转移(分为有转移组和无转移组);Duke 分期(分为 Duke B期组和Duke C期组);浸润深度(分为肌层组及肌层外组);WWOX表达组(分为阳性组与阴性组); CD133表达组(分为阳性组与阴性组)等因素带入COX多因素模型进行分析显示:WWOX和CD133的阳性表达以及Duke分期是影响CRC患者生存的独立预后因素(表 2)。
| 表 2 174例CRC患者的多因素分析 Table 2 Multivariate survival analysis of patients with CRC |
本组病例平均5 年生存率为43.1%(75/174)。 Kaplan-Meier 生存分析显示WWOX蛋白表达阳性组与阴性组的中位生存时间分别为67.4±18.9月和40.6±21.1月,log-rank分析总的生存时间在两组之间差异有统计学意义(P<0.001,图 3A);CD133蛋白阳性组与阴性组的中位生存时间分别为41.2±22.3月和63.7±20.4月,log-rank分析显示总的生存时间在两组之间差异有统计学意义(P<0.001,图 3B)。
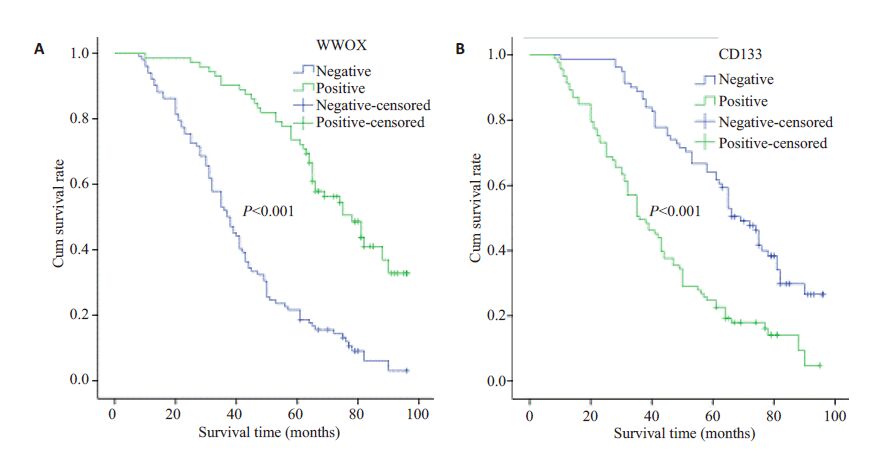
|
图 3 WWOX和CD133阳性表达组与阴性表达组CRC患者生存曲线 Figure 3 Survival curves of CRC patients with positive or negative expressions of WWOX (A) and CD133 (B). |
WWOX基因编码414个氨基酸构成的蛋白质,其相对分子质量为46 600。该蛋白的N末端包含一个蛋白-蛋白相互作用的WW区域,C末端包含一个短链脱氢酶区域。WWOX在正常组织中广泛表达,其可以通过其它蛋白的作用而发挥着调节细胞生长、分化及凋亡等过程[9-10]。WWOX在多种肿瘤组织中出现表达异常,例如卵巢癌、乳腺癌、膀胱癌、肝癌以及食管癌等[4, 11-14],其在这些肿瘤组织主要表现为表达缺失或甲基化等的异常,从而被认为是一个抑癌基因,但其具体机制目前还不清楚,可能与其参与多种信号转导途径有关[15-17]:可以与TNF 凋亡途径中的TRADD和TRAF2 作用,增强TNF 介导的细胞毒性,也可以通过下调凋亡抑制因子Bc1-2 和Bc1-xl 及上调P73 的表达而增强TNF 的细胞毒性功能;可以与IκBα/P53 凋亡途径中的P53 作用,上调促凋亡因子p53的表达,从而增强TNF 介导的细胞毒作用,并可和P53形成共价复合物协同促使细胞凋亡;可以与细胞应激途径中的JNK1 作用。近期有文献报道,WWOX 可能参与肿瘤的转移过程。Gourley等[18]通过试验证实WWOX 能够抑制卵巢癌细胞中的整合素的表达,从而抑制了纤连蛋白的黏附及迁移作用,同时减弱了癌细胞侵袭能力。另外,Lan等[19]研究表明,通过上调WWOX 的表达可能激活ERK1/2 蛋白磷酸化,从而降解MMP-9 ,使其表达下降,从而抑制细胞转移过程。本研究通过免疫组化方法检测WWOX蛋白在CRC组织及其癌旁正常结直肠黏膜组织中的表达,发现WWOX蛋白在CRC组织中的阳性率显著低于其在正常对照组中的表达,差异有统计学意义。进一步的统计分析发现,WWOX蛋白的表达与CRC患者肿瘤的浸润深度、分化程度、淋巴结转移与否及Duke分期均有关,即WWOX表达缺失的肿瘤细胞分化程度差、易于发生浸润及转移。Kaplan-Meier 生存分析表明,WWOX蛋白阳性表达的患者术后总的生存时间明显高于其阴性组患者。上述研究结果表明,WWOX表达缺失的患者预后差,易于发生浸润及转移,这与其他学者报道的结果一致[12]。
肿瘤干细胞(CSCs)又称之为肿瘤起源细胞(TICs)通常被认为是肿瘤发生、发展、浸润、转移以及复发的根源。标记CSCs 的标记物有CD44、CD24、CD117、 CD133、ALDH2、ABCB1 等,其中CD133 是最常用的 CSCs标记物。目前,已有研究[5-8]证明,在大多数的脑肿瘤、肝癌、肺癌、食管癌、胃癌等组织中,均可以检测到有 CD133的表达。CSCs具有天然的抵抗放、化疗特性,因此,一般的化疗药物对CSCs阳性的CRC患者疗效通常不佳[20]。因此,开发抗CSCs的药物是将来CRC患者潜在的治疗靶点。在本研究中,我们发现CD133蛋白在 CRC组中的阳性率显著高于其在对照组中的阳性率,差异有统计学意义;并且随着CRC肿瘤组织的分化越差、浸润越深、Duke分期越高,CD133蛋白的阳性率越高,差异均有统计学意义;CD133的阳性率随着淋巴结的转移而明显增高;生存分析也表明,CD133蛋白的表达与患者的预后相关,其阳性组患者术后总的生存时间明显低于其表达阴性组患者。上述结果表明,CD133阳性表达的CRC患者其肿瘤组织分化差、浸润深、Duke分期高、易于发生淋巴结转移以及预后差,这与文献报道一致[6-8, 21]。
Spearman 相关分析显示,WWOX与CD133 的表达呈负相关关系,说明WWOX与CD133之间可能存在某种联系。CSCs的异常激活导致CRC肿瘤的发生及增长,而WWOX的表达缺失则导致其诱导细胞凋亡功能的丧失,导致其进一步异常增生。CSCs周围的微环境中是由大量的微血管和微淋巴管等[6-8]组成,因此可以导致CRC肿瘤的浸润和转移[6-8, 21]。WWOX 蛋白下调与VEGF有关。WWOX的表达缺失,可能使VEGF 高表达,从而促进肿瘤血管生成,导致肿瘤生长及转移。 WWOX与CD133两者都与血管的生成有关,可能通过 VEGF信号通路发生联系,具体作用机制尚有待于进一步研究。COX多因素分析显示CRC患者的Duke分期及WWOX和CD133蛋白的阳性表达是影响CRC患者术后生存时间的独立预后因素。
综上所述,WWOX和CD133 的异常表达参与了 CRC的发生、发展、侵袭及转移等过程。因此,可以通过联合检查CRC患者WWOX和CD133 蛋白的表达,作为预测CRC患者浸润、转移及预后的指标之一。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global Cancer statistics, 2012[J]. CA Cancer J Clin,2015, 65 (2) : 87-108. DOI: 10.3322/caac.21262. |
| [2] | Stewart DJ, Nunez MI, Jelinek J, et al. Impact of decitabine on immunohistochemistry expression of the putative tumor suppressor genes FHIT, WWOX, FUS1 and PTEN in clinical tumor samples[J]. Clin Epigenetics,2014, 6 (1) : 13. DOI: 10.1186/1868-7083-6-13. |
| [3] | Yang J, Zhao L, Tian W, et al. Correlation of WWOX, RUNX2 and VEGFA protein expression in human osteosarcoma[J]. BMC Med Genomics,2013, 6 (12) : 56. |
| [4] | Hu BS, Tan JW, Zhu GH, et al. WWOX induces apoptosis and inhibits proliferation of human hepatoma cell line SMMC-7721[J]. World J Gastroenterol,2012, 18 (23) : 3020-6. DOI: 10.3748/wjg.v18.i23.3020. |
| [5] | 林照亮, 黄雪连, 戴少敏, 等. Htert、CD133 和 c-myc 在胃癌中的表达[J]. 胃肠病学和肝病学杂志,2014, 23 (7) : 749-51. |
| [6] | Rocco A, Liguori E, Pirozzi G, et al. CD133 and CD44 cell surface markers do not identify Cancer stem cells in primary human gastric tumor[J]. J Cell Physiol,2012, 227 (6) : 2686-93. DOI: 10.1002/jcp.23013. |
| [7] | 陆国玉, 吴晓飞, 周蕾, 等. CD133和CD44在胃腺癌中的表达及其与 E-cadherin的关系[J]. 南方医科大学学报,2013, 33 (11) : 1632-7. |
| [8] | Wu S, Yu L, Wang D, et al. Aberrant expression of CD133 in non-small cell lung Cancer and its relationship to vasculogenic mimicry[J]. BMC Cancer,2012, 12 (4) : 535. |
| [9] | Cui Z, Lin D, Cheng F, et al. The role of the WWOX gene in leukemia and its mechanisms of action[J]. Oncol Rep,2013, 29 (6) : 2154-62. |
| [10] | Dayan S, O'keefe LV, Choo A, et al. Common chromosomal fragile site FRA16D tumor suppressor WWOX gene expression and metabolic reprograming in cells[J]. Genes Chromosomes Cancer,2013, 52 (9) : 823-31. DOI: 10.1002/gcc.22078. |
| [11] | Ge F, Chen W, Yang R, et al. WWOX suppresses KLF5 expression and breast Cancer cell growth[J]. Chin J Cancer Res,2014, 26 (5) : 511-6. |
| [12] | Yan H, Sun J. Methylation status of WWOX gene promoter CpG islands in epithelial ovarian Cancer and its clinical significance[J]. Biomedical reports,2013, 1 (3) : 375-8. |
| [13] | Yang W, Cui S, Ma J, et al. Cigarette smoking extract causes hypermethylation and inactivation of WWOX gene in T-24 human bladder Cancer cell[J]. Neoplasma,2012, 59 (2) : 216-23. DOI: 10.4149/neo_2012_028. |
| [14] | Guo W, Wang G, Dong Y, et al. Decreased expression of WWOX in the development of esophageal squam ous cell carcinoma[J]. Mol Carcinog,2013, 52 (4) : 265-74. DOI: 10.1002/mc.v52.4. |
| [15] | Chang NS, Doherty J, Ensign A, et al. WOX1 is essential for tumor necrosis factor-, UV light-, staurosporine-, and p53-mediated cell death, and its tyrosine 33-phosphorylated form binds and stabilizes serine 46-phosphorylated p53[J]. J Biol Chem,2005, 280 (52) : 43100-8. DOI: 10.1074/jbc.M505590200. |
| [16] | 任德发, 胡福荣, 邵力伟, 等. WWOX、Bcl-2在非小细胞肺癌中的表达及意义[J]. 武汉大学学报: 医学版,2014, 35 (6) : 914-6. |
| [17] | Yang WF, Sun ZX, Kong CZ, et al. The expression of wwox protein in the transtitional cell carcinoma of bladder and its clinical signifciance[J]. 山东医药,2008, 48 (41) : 31-2. |
| [18] | Gourley C, Paige AJ, Taylor KJ, et al. WWOX gene expression abolishes ovarian Cancer tumorigenicity in vivo and decreases attachment to fibronectin via integrin alpha3[J]. Cancer Res,2009, 69 (11) : 4835-42. DOI: 10.1158/0008-5472.CAN-08-2974. |
| [19] | Lan YY, Wu SY, Lai HC, et al. WW domain-containing oxido- reductase is involv ed in upregulation of matrix metalloproteinase 9 by Epstein-Barr virus latent membrane protein 2A[J]. Biochem Biophys Res Commun,2013, 436 (4) : 672-6. DOI: 10.1016/j.bbrc.2013.06.014. |
| [20] | Nishikawa S, Konno M, Hamabe A, et al. Aldehyde dehydrogenase high gastric Cancer stem cells are resistant to chemotherapy[J]. Int J Oncol,2013, 42 (4) : 1437-42. |
| [21] | Chen SC, Song XM, Chen ZH, et al. Correlation analysis of CD133/ CD44 expression in colorectal cancer tissues and 5-year survival rate in colorectal cancer patients[J]. 中国病理生理杂志,2011, 27 (5) : 883-9. |
 2015, Vol. 35
2015, Vol. 35

