蛋白质酪氨酸残基的磷酸化水平为一动态可逆过程。蛋白酪氨酸激酶(PTK)与蛋白酪氨酸磷酸酶(PTP)两大家族构成一个调控网络,精细地调节着酪氨酸残基的磷酸化程度。CD45是白细胞表面共同抗原,表达在除红细胞和血小板之外的所有血液细胞上,在免疫细胞如T细胞、B细胞、自然杀伤细胞和巨噬细胞表面均有表达。该分子为单链跨膜糖蛋白,是PTP家族成员,能特异地水解蛋白质底物上的酪氨酸磷酸酯键以脱去磷酸,与PTK 相互配合,调节蛋白质的功能,在免疫细胞的发育和活化中起着重要作用[1]。CD45由4~6个外显子(常见的有A、B、C等)交替剪接而成,使其至少有9个变构体即亚型,如CD45RA、CD45RB、CD45RC、 CD45RO等。单个细胞可同时表达CD45的多个亚型,虽然这些亚型的胞外段结构不同,但胞浆段具有共同的酪氨酸磷酸酶活性结构域。研究表明,CD45在免疫细胞的信号转导调控中发挥了重要作用[2]。早在10余年前,我国就开始了对制备放射性元素标记的CD45抗体的研究,为靶向治疗白血病奠定了基础[3]。近年来,越来越多的研究集中在CD45对白血病、淋巴瘤和非造血系统肿瘤的鉴别、诊断和治疗[4-7]。本研究克隆了人 CD45 基因PTPRC 的cDNA,构建重组真核表达载体 PcDNA3.1-3xflag-CD45,转染Hela 细胞并成功表达,建立了研究CD45功能的细胞模型,为进一步探索CD45的功能奠定了基础。
1 材料与方法 1.1 质粒菌株和Hela细胞Hela 细胞、感受态细菌Top10、pMD-18T 载体和 PcDNA3.1-3xflag质粒均为本实验室保存。
1.2 主要试剂高保真DNA多聚酶购于诺唯赞生物科技有限公司;限制性内切酶HindⅢ和XhoⅠ以及T4连接酶购于 Takara公司;质粒抽提试剂盒购于美基生物公司;转染试剂PEI购于Sigama公司;DMEM培养基购于Life公司;胎牛血清购于百旺生物公司;PE-CD45抗体为美天旎公司产品;抗标签蛋白单抗购于CST公司;HRP-抗鼠抗体购于杭州联科生物公司;碱性磷酸酶试剂盒购于南京建成生物工程研究所。
1.3 培养Hela细胞Hela 细胞常规培养于含10%胎牛血清的DMEM高糖完全培养基中,置于37 ℃、5% CO2培养箱中培养,隔天用0.25%胰酶消化传代培养。
1.4 克隆PTPRC cDNA根据PTPRC基因序列设计1对基因扩增引物:上游引物5'-CCAAGCTTATGACCATGTATTTGTGGCTT AAAC-3',下游引物5'-CCCTCGAGCTATGAA CCTT GATTTAAAGCTGGA-3'。上游引物中含有HindⅢ酶切位点,下游引物中含有XhoⅠ酶切位点,引物由Life公司合成。取健康人外周血,用淋巴细胞分离液分离单个核细胞,提取总RNA,逆转录cDNA 后,用高保真DNA多聚酶扩增目的基因。PCR反应体系为50 μL,反应条件:95 ℃预变性1 min,95 ℃变性20 s,53 ℃退火20 s,72 ℃延伸2.5 min,35 个循环;最后72 ℃延伸5.5 min。回收PCR产物,连接到pMD-18T载体,获得 CD45 cDNA克隆pMD-18T-CD45。
1.5 构建重组表达质粒PcDNA3.1-3xflag-CD45采用PCR 技术,从质粒pMD-18T-CD45 扩增 CD45基因片段,分离PCR扩增产物,将其与真核表达质粒PcDNA3.1-3xflag分别用限制性内切酶HindⅢ和 XhoⅠ于37 ℃双酶切过夜,琼脂糖凝胶电泳回收,取酶切好的PCR产物片段和质粒DNA片段,用T4连接酶于16 ℃连接8 h,将连接产物转化感受态Top10菌中,涂在含有100 μg/mL氨苄青霉素的LB固体培养基上,37 ℃培养过夜,次日挑取单克隆菌落,并在含有氨苄青霉素的LB 液体培养基摇菌扩增14~16 h。提取质粒 PcDNA3.1-3xflag-CD45,送华大基因公司测序。
1.6 重组表达质粒PcDNA3.1-3xflag-CD45 转染Hela细胞取Hela细胞,加入6孔板内,于37 ℃、5% CO2培养箱培养,次日待细胞贴壁融合生长达孔底面积的70%~80%时,进行细胞转染。DMEM稀释2 μg 质粒,加入2 μL 转染试剂PEI(2 mg/mL)混匀,放置15 min后,将其缓慢滴入已吸除培养液的6 孔板内,置于37 ℃、5% CO2培养箱培养48 h,鉴定CD45的表达及活性。
1.7 检测Hela细胞CD45表达用流式细胞术(flow cytometry,FCM)检测CD45表达。细胞转染48 h后,以0.25%胰蛋白酶消化6孔板内细胞,以预冷的含1%新生牛血清PBS洗细胞3次,加入PE-CD45抗体,4 ℃反应30 min,用预冷的含1%新生牛血清PBS洗3次,上流式细胞仪分析CD45表达情况。
以免疫印迹(Western blot,WB)技术分析CD45表达。细胞转染24、48 和72 h 后,提取蛋白,行SDSPAGE分离,之后将凝胶上蛋白转移到PVDF膜上,用含5% BSA的TBST室温封闭2 h;加入用TBST 1∶1000稀释的抗标签抗体,4 ℃摇床震摇过夜;TBST洗膜3次后,加入HRP-抗鼠抗体,常温下反应1 h;TBST洗膜5次后,ECL曝光。
1.8 分析CD45酶活性细胞转染后48 h,在细胞孔中加入含有蛋白酶抑制剂的裂解液,裂解30~40 min,用微量移液器吸出后测蛋白质浓度,严格遵循碱性磷酸酶活性测定试剂盒说明书操作,测定碱性磷酸酶活性,并按说明书公式计算每克蛋白的酶活性。
1.9 统计学方法应用统计学分析软件SPSS16.0(SPSS,Inc. Chicago,IL,USA)进行数据学分析,本研究采用Student's t检验,P<0.05认为具有统计学意义。应用软件Graphpad prism 5、FCS expression 3、Snap gene进行图像处理。
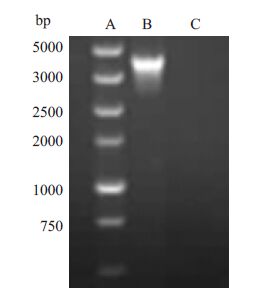
2 结果 2.1 CD45基因PTPRC cDNA的分离和克隆提取健康人外周血单个核细胞总RNA、逆转录 cDNA后,PCR扩增目的基因片段,经1%琼脂糖凝胶电泳,可见相对分子质量约3900 bp特异条带(图 1),与目的条带CD45大小一致。将其连接到pMD-18T载体,获得CD45 cDNA克隆pMD-18T-CD45。
|
图 1 RT-PCR 扩增人外周血单个核细胞中CD45 cDNA片段 Figure 1 CD45 cDNA fragment amplified from human peripheral mononuclear cells by RT-PCR. A: DNA maker; B: RT-PCR product; C: Blank control. |
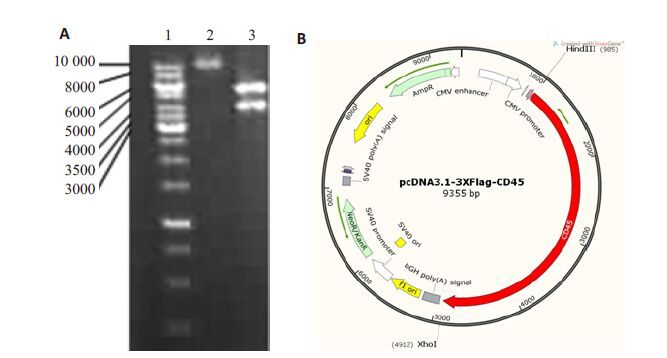
将从质粒pMD-18T-CD45扩增出来的PCR产物和空载体PcDNA3.1-3xflag双酶切、连接构建成重组表达载体。该载体约10 000 bp(图 2A带2),以HindⅢ和 XhoⅠ进行双酶切鉴定,可见重组质粒在约6000 bp和4000 bp有特异性条带(图 2A带3)。重组表达载体送华大基因测序,测序结果经Blast软件比对,与NCBI公布的序列一致(ID:5788),表明重组真核表达载体 PcDNA3.1-3xflag-CD45构建成功(图 2B)。
|
图 2 CD45真核表达载体的鉴定 Figure 2 Identification of recombinant expression vector PcDNA3.1-3xflag-CD45. A: Identification of the recombinant expression vector PcDNA3.1-3xflag-CD45 by double restriction enzyme digestion (1: DNA maker; 2: Recombinant plasmid PcDNA3.1-3xflag-CD45; 3: Recombinant plasmid after double restriction enzyme digestion ); B: Recombinant plasmid profile. |
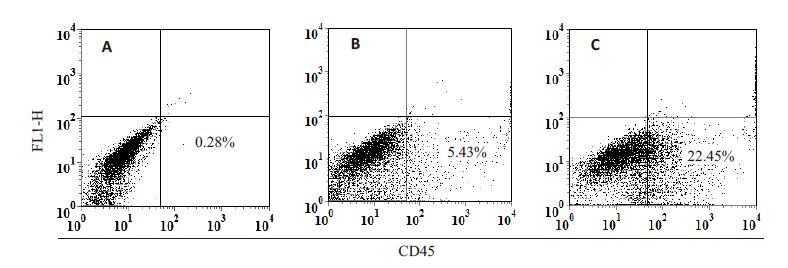
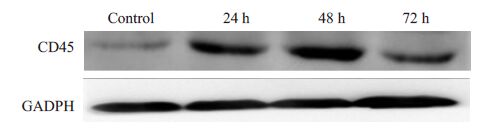
转染重组表达载体PcDNA3.1-3xflag-CD45 以及空载体PcDNA3.1-3xflag到Hela细胞48 h后,以PE-抗 CD45抗体染色,FCM分析可见转染重组质粒的细胞比转染空载体者CD45表达明显增高(图 3)。转染24、48、72 h 后进行WB鉴定,在150 000(CD45)以及36 000(内对照GADPH)处可见特异条带,转染重组质粒的 Hela 细胞的CD45 条带明显深于转染空质粒者,表达在48 h 达高峰,但72 h 时仍有表达(图 4)。表明 PcDNA3.1-3xflag-CD45 能有效地转染Hela 细胞并表达CD45蛋白。
|
图 3 流式细胞术检测转染质粒后CD45的表达 Figure 3 Analysis of CD45 expression in Hela cells transfected with plasmids by flow cytometry. A: Hela cells; B: Hela cells transfected with PcDNA3.1-3xflag; C: Hela cells transfected with PcDNA3.1-3xflag-CD45. |
|
图 4 免疫印迹检测转染质粒后Hela细胞CD45表达情况 Figure 4 Analysis of CD45 expression in Hela cells transfected with PcDNA3.1-3xflag or PcDNA3.1-3xflag-CD45 by Western blotting. |
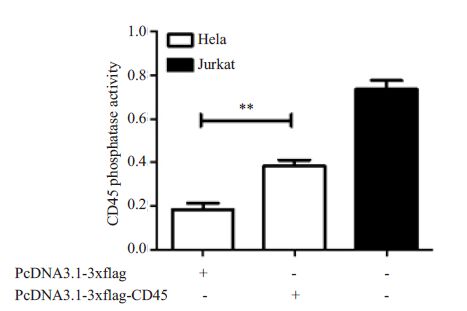
提取转染重组表达载体PcDNA3.1-3xflag-CD45或空载体PcDNA3.1-3xflag 48 h 后的Hela 细胞以及作为阳性对照的天然高表达CD45 的人T 细胞株 Jurkat 细胞的蛋白质,分析其磷酸酶活性,发现转染 PcDNA3.1-3xflag-CD45 的Hela 细胞的磷酸酶活性明显高于转染PcDNA3.1-3xflag 的细胞(P<0.05,图 5),表明Hela 细胞中表达的重组CD45 蛋白具有生物学活性。
|
图 5 Hela细胞表达重组CD45的磷酸酶活性 Figure 5 Phosphatase activity of recombinant CD45 protein expressed in Hela cells. **P<0.05. |
CD45 结构分为为胞浆区、跨膜区和膜外区3 部分。膜外区包括多态性区域、富含半胱氨酸区域以及保守区域。研究证实,CD45胞外段糖基化种类及程度可调节T细胞的分化、激活、调控和存活[8-10]。文献报道[11],未成熟抗原提呈细胞通过其表面C型凝集素MGL与T细胞表面CD45 相互作用,负向调控T 细胞的功能; CD45胞浆区结构域具有酪氨酸磷酸酶活性,调控着底物蛋白质的磷酸化,从而调节细胞增殖、分化等。在白细胞中,某些Src 酪氨酸激酶家族为CD45 的底物,例如,T细胞内Lck和部分Fyn[12],B细胞内Lyn[13],巨噬细胞中的Hck和Lyn[14],以及树突状细胞中的Lyn、Hck和 Fyn[15]等,其在TCR、BCR、NK细胞以及TLR的信号转导以及白细胞的粘附和迁移中发挥重要作用[1]。因此,在某种意义上,CD45调控着所有白细胞的激活[16]。近年来,不仅CD45的调控作用受到关注,其与疾病的关系越来越受到重视,CD45不同亚型的表达与自身免疫病及感染性疾病相关,表明CD45作为重要的免疫调节分子对疾病发生发展有着重要影响[17-19]。同时,CD45抗体靶向造血细胞的免疫治疗受到了越来越多的关注[6, 20]。
本研究中,我们将CD45基因从健康人单个核细胞中克隆出来,并将其与表达载体PcDNA3.1-3xflag 相连,构建成功重组表达载体PcDNA3.1-3xflag-CD45,转染到Hela细胞中,并能够正确翻译表达。为进一步考察其是否具有生物学活性,我们利用碱性磷酸酶能够分解磷酸苯二钠产生游离酚和磷酸,比色法检测酶活性的原理,发现Hela细胞表达的重组CD45蛋白具有一定的生物学活性。本实验成功地构建了CD45重组表达载体并在Hela细胞中有效表达,建立了有效的进一步研究CD45功能的细胞模型,为进一步揭示CD45的功能及其介导的细胞信号通路奠定了重要的物质基础。
随着对CD45 分子基因结构和功能的深入认识,CD45在淋巴细胞发育、活化中的作用及其机制等问题的阐明,CD45 必将在疾病的诊断、治疗和预后等方面发挥更大的作用。
| [1] | Saunders AE, Johnson P. Modulation of immune cell signalling by the leukocyte common tyrosine phosphatase, CD45[J]. Cell Signal,2010, 22 (3) : 339-48. DOI: 10.1016/j.cellsig.2009.10.003. |
| [2] | Irie-Sasaki J, Sasaki T, Penninger JM. CD45 regulated signaling pathway[J]. Curr Top Med Chem,2003, 3 (7) : 783-96. DOI: 10.2174/1568026033452339. |
| [3] | 扶云碧, 李贵平, 孟凡义. 90Y标记单克隆抗体CD45的研究[J]. 南方医科大学学报,2006, 26 (8) : 1230-2. |
| [4] | He RJ, Yu ZH, Zhang RY, et al. Protein tyrosine phosphatases as potential therapeutic targets[J]. Acta Pharmacol Sin,2014, 35 (10) : 1227-46. DOI: 10.1038/aps.2014.80. |
| [5] | 李贵平, 郑文莉, 黄宝丹, 等. CD45 单抗介导的188Re-亲和素二步法预定位靶向淋巴瘤的实验研究[J]. 南方医科大学学报,2015, 35 (8) : 1-5. |
| [6] | Mawad R, Gooley TA, Rajendran JG, et al. Radiolabeled Anti- CD45 antibody with Reduced-Intensity conditioning and allogeneic transplantation for younger patients with advanced acute myeloid leukemia or myelodysplastic syndrome[J]. Biol Blood Marrow Transplant,2014, 20 (9) : 1363-8. DOI: 10.1016/j.bbmt.2014.05.014. |
| [7] | Liu T, Cousins A, Chien CC, et al. Immunospecific targeting of CD45 expressing lymphoid cells: towards improved detection agents of the sentinel lymph node[J]. Cancer Lett,2013, 328 (2) : 271-7. DOI: 10.1016/j.canlet.2012.09.024. |
| [8] | Clark MC, Baum LG. T cells modulate glycans on CD43 and CD45 during development and activation, signal regulation, and survival[J]. Ann N Y Acad Sci,2012, 1253 (1) : 58-67. DOI: 10.1111/j.1749-6632.2011.06304.x. |
| [9] | Earl LA, Baum LG. CD45 glycosylation controls T-cell Life and death[J]. Immunol Cell Biol,2008, 86 (7) : 608-15. DOI: 10.1038/icb.2008.46. |
| [10] | Xue J, Gao X, Fu C, et al. Regulation of galectin-3-induced apoptosis of Jurkat cells by both O-glycans and N-glycans on CD45[J]. FEBS Lett,2013, 587 (24) : 3986-94. DOI: 10.1016/j.febslet.2013.10.034. |
| [11] | Van Vliet SJ, Gringhuis SI, Geijtenbeek TB, et al. Regulation of effector T cells by antigen-presenting cells via interaction of the C- type lectin MGL with CD45[J]. Nat Immunol,2006, 7 (11) : 1200-8. DOI: 10.1038/ni1390. |
| [12] | Hurley TR, Hyman R, Sefton BM. Differential effects of expression of the CD45 tyrosine protein phosphatase on the tyrosine phospho- rylation of the lck, fyn, and c-src tyrosine protein kinases[J]. Mol Cell Biol,1993, 13 (3) : 1651-6. DOI: 10.1128/MCB.13.3.1651. |
| [13] | Shrivastava P, Katagiri T, Ogimoto M, et al. Dynamic regulation of Src-family kinases by CD45 in B cells[J]. Blood,2004, 103 (4) : 1425-32. |
| [14] | Roach T, Slater S, Koval M, et al. CD45 regulates Src family member kinase activity associated with macrophage integrin- mediated adhesion[J]. Curr Biol,1997, 7 (6) : 408-17. DOI: 10.1016/S0960-9822(06)00188-6. |
| [15] | Johnson P, Cross JL. Tyrosine phosphorylation in immune cells: direct and indirect effects on toll-like receptor-induced proinfl- ammatory cytokine production[J]. Crit Rev Immunol,2009, 29 (4) : 347-67. DOI: 10.1615/CritRevImmunol.v29.i4. |
| [16] | Buckley RH. The multiple causes of human SCID[J]. J Clin Invest,2004, 114 (10) : 1409-11. DOI: 10.1172/JCI200423571. |
| [17] | Tchilian EZ, Beverley PC. Altered CD45 expression and disease[J]. Trends Immunol,2006, 27 (3) : 146-53. DOI: 10.1016/j.it.2006.01.001. |
| [18] | Chew A, Salama P, Robbshaw A, et al. SPARC, FOXP3, CD8 and CD45 correlation with disease recurrence and long-term disease-free survival in colorectal cance[J]. PLoS One,2011, 6 (7) : e22047. DOI: 10.1371/journal.pone.0022047. |
| [19] | Colonne CK, Yao JH, Pilgrim C, et al. Surface CD45 expression levels distinguish normal erythroblasts from stress erythroblasts during haemolytic anaemia and pregnancy-induced anaemia[J]. Exp Hematol,2015, 43 (9, Supplement) : S58. |
| [20] | Burtner CR, Chandrasekaran D, Santos EB, et al. (211)Astatine- Conjugated monoclonal CD45 Antibody-Based nonmyeloablative conditioning for stem cell gene therapy[J]. Hum Gene Ther,2015, 26 (6) : 399-406. DOI: 10.1089/hum.2015.021. |
 2015, Vol. 35
2015, Vol. 35

