厚朴酚与和厚朴酚为联苯型新木脂素类化合物,是中药厚朴(Magnolia officinalis)和日本厚朴(M. obovata)的有效成分[1-2]。现代药理学研究表明,厚朴酚与和厚朴酚具有抗肿瘤、抗菌、抗炎、抗氧化等多种生物活性,且具有低毒性的优点,是极具有开发前途的天然产物[3]。虽然厚朴酚与和厚朴酚具有多靶点、低毒性等优势,但因其口服或注射给药后的生物利用度低的缺点,极大地限制了它们在临床上的应用[4]。良好的水溶性有助于药物的药效发挥,并可改善药物在体内的吸收、分布、代谢、排泄等药代动力学性质[5]。糖基化是提高化合物水溶性的最常用的方法之一,糖基化修饰不仅可丰富化合物的结构多样性,提高其水溶性,而且这些糖分子在功能上参与目的细胞的识别影响生物活性[6]。比如,7β-xylosyl-10-deacetyl paclitaxel及其衍生物保留抗肿瘤活性的同时,显著地提高了其水溶性以及对肿瘤细胞的特异选择性[7]。最近,Yang等[8]利用真菌Cunninghamella echinulata AS3.3400 与Rhizopus japonicus ZW-4,通过生物转化的方法制备了13 个新的厚朴酚与和厚朴酚糖基化衍生物,并且显著地增加了糖基化产物的水溶性。因此,对进行糖基化修饰的厚朴酚与和厚朴酚的水溶性、药效、构效关系、药代动力学及毒副作用的研究十分必要。
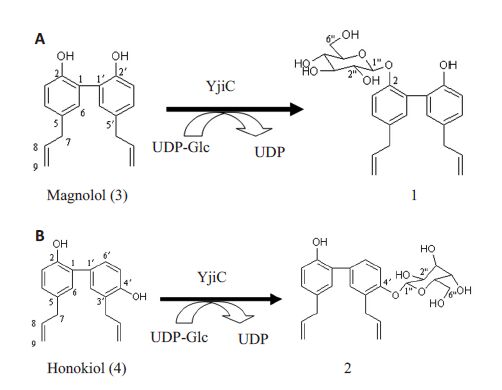
糖基转移酶(glycosyltransferase,GT)是糖基化的天然产物生合成途径上重要的一种酶,通常参与最后一步的结构修饰,其主要功能是催化供体上的糖转移至非糖体。酶法糖基化具有反应条件温和,操作简便,效率高等优点,是提高化合物(药物)水溶性的非常有效的手段。本文首次利用来源于Bacillus licheniformis DSM-13的糖基转移酶(YjiC),对厚朴酚与和厚朴酚进行酶法糖基化修饰,为今后的研究提供±据。其糖基化反应如图 1。
|
图 1 厚朴酚与和厚朴酚的体外糖基化反应 Figure 1 In vitro glycosylation of magnolol and honokiol. (A): Enzymatic synthesis of magnolol glucoside by YjiC; (B): Enzymatic synthesis of honokiol glucoside by YjiC. 1: Authentic magnolol-2-O-β-D-glucopyranoside; 2: Authentic honokiol-4'-O-β-D-glucopyranoside; 3: Standard magnolol used for the glycosylation; 4: Standard honokiol used for the glycosylation. |
厚朴酚与和厚朴酚分子式均为 C18H18O2,其相对分子质量均为266,由本课题组从广玉兰(M. grandifolia)中提取分离得到,纯度均高于95%,并经1H、13C NMR和ESI-MS波谱数据分析并与文献[9]比较确认。阿霉素(adriamycin,ADM)购自美仑生物。厚朴酚、和厚朴酚、阿霉素均溶于DMSO中,配制成10 mmol/L母液,-20 ℃保存。pET302-YjiC质粒由韩国Sun Moon University 的Sohng Jae Kyung 教授赠送。UDPGlucose( UDP-Glc)购自Sigma-Aldrich。乙腈(色谱纯)购于Thermo Fisher。
1.1.2 细胞及细胞培养人乳腺癌细胞株MDAMB-231、人肝癌细胞株(SMMC7721和HepG2)、人结肠癌细胞株SW480 均购于中科院上海细胞库。实验中所用4 种肿瘤细胞复苏后,于DMEM 培养液或 RPMI培养液(含10%胎牛血清,3.7 g/L 碳酸氢钠,1×105 IU/L 青霉素,100 mg/L 链霉素),置37 ℃、饱和湿度、5% CO2 培养箱中培养,0.25%胰酶消化后传代培养。
1.2 方法 1.2.1 糖基转移酶的表达与纯化利用热冲击法将 pET302-YjiC质粒转化至大肠杆菌BL21(DE3)菌中,通过优化培养条件确定糖基转移酶(YjiC)高表达条件。当大肠杆菌300 mL生长至D600nm值0.6,在4 ℃孵育10 min后加入0.5 mmol/L isopropyl-β-D-thiogalactopyranoside( IPTG),并置于在28 ℃恒温摇床培养12 h。培养结束后,3000 r/min离心10 min收集细胞,将细胞悬浮于20 mL 缓冲液(包含蛋白酶抑制剂),利用超声波捣碎细胞20 min后,置12 000 r/min离心50 min。取上清液,并利用Ni2+ NTA树脂纯化出水溶性的高纯度 his-tag糖基转移酶融合蛋白[10]。
1.2.2 体外糖基化酶反应在体外糖基化酶反应过程中,通过对反应时间、UDP-Glc、缓冲液的pH值等条件进行优化,最终选择的酶法糖基化反应条件为:40 mL反应缓冲液(100 mmol/L Tri-HCl,pH 为8.0)包括1 mmol/L MgCl2、50 μg/LYjiC蛋白、3 mmol/L UDP-Glc、3 mmol/L底物(厚朴酚或和厚朴酚)、8 mL甲醇,在28 ℃反应3 h。待反应结束后,于100 ℃沸水中煮沸10 min停止反应。加入同等体积的乙酸乙酯萃取2次,并将乙酸乙酯提取物进行分析与精制。
1.2.3 糖基化产物的分析、精制、鉴定糖基化反应产物经高效液相色谱仪(P580泵,PDA-100检测器,ASI-100自动进样器)(美国Dionex公司)进行分析,其色谱条件为YMC J’shpere ODS-H80(4.5 mm×150 mm)色谱柱、流动相(溶剂A,乙腈;溶剂B,水)、梯度洗脱(0~20 min,20%~100%溶剂A;20~30 min,100%溶剂A)、流速(1 mL/min)、检测波长为254 nm。酶法糖基化反应液经高效液相串联质谱(LC-MS)LTQ-XL 离子阱法以及电喷雾离子源的负离子模式确认糖基化产物峰的分子量,其色谱条件为Dionex 3000 HPLC系统(美国Thermo Electron公司),HSS T3 色谱柱(2.1mm×150mm,2.5 μm)色谱柱、流动相(溶剂A,乙腈;溶剂B,水)、梯度洗脱(0~20 min,20%~100%溶剂A;20~30 min,100%溶剂 A)、流速(0.2 mL/min)、检测波长为254 nm。乙酸乙酯提取物经Waters 2535Q半制备液相(美国Waters 公司)进行精制,其色谱条件为SunFireTM C18(10 mm×250 mm)色谱柱,流动相(溶剂A,乙腈;溶剂B,水)、等度洗脱(0~30 min,40%溶剂A)、流速(4 mL/min)、检测波长为254 nm,分别得到化合物1(18.5 mg)与化合物2(14.2 mg)。纯度高于96%的糖基化产物经Bruker700 MHz核磁共振仪(德国Bruker公司)进行检测分析。
1.2.4 HPLC法检测化合物的水溶性分别取足够量的化合物1~4,分别溶于装有400 μL蒸馏水的1.5 mL离心管,并在室温条件下利用超声波(KH5200DB,中国)辅助进行溶解,使其呈过饱和状态。超声波溶解1 h后,在8000 r/min离心10 min,取上清液稀释至适当浓度,注入HPLC进行分析,并求算水溶液中化合物的浓度[8, 10]。上述实验重复3次。
1.2.5 MTT法将对数生长期细胞,以细胞数5×103/孔接种于96 孔板,每孔100 μL,培养过夜。待细胞贴壁后,每孔加入含有不同浓度药物的培养液100 μL,继续培养48 h,同时设置阳性对照阿霉素(ADM)组与空白对照组,每个药物处理3个复孔。药物处理48 h后,每孔加入MTT溶液继续孵育4 h,弃去培养液,并加入 DMSO 150 μL,37 ℃孵育30 min使结晶物充分溶解,用酶标仪在570 nm 波长下检测每孔的吸光度(D)值,计算细胞存活率[9]。细胞存活率%=(实验组D570 nm-空白组 D570 nm)/(对照组D570 nm-空白组D570 nm)×100%,绘制剂量效应曲线,采用Logit法计算半数抑制浓度(IC50)。上述实验重复3次[11]。
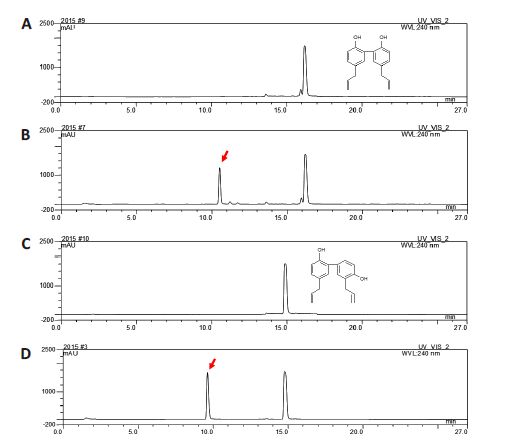
2 结果 2.1 糖基化产物的HPLC分析厚朴酚的酶法糖基化反应液经HPLC分析,从结果(图 2A和2B)中可观察到糖基化产物峰的存在。保留时间(tR)16.2 min处为厚朴酚峰(底物,3),tR=10.5 min处为厚朴酚糖基化产物峰(1)。从图 2C和2D中,可观察到和厚朴酚糖基化产物峰(tR=9.6 min)(2),其酶法糖基化反应的底物,厚朴酚峰出现在tR=14.8 min处(4)。
|
图 2 体外糖基化酶反应液的高效液相色谱分析 Figure 2 HPLC analysis of the in vitro glycosylation reaction mixture. A: Magnolol; B: Glycosylation product of magnolol; C: Honokiol; D: Glycosylation product of honokiol. |
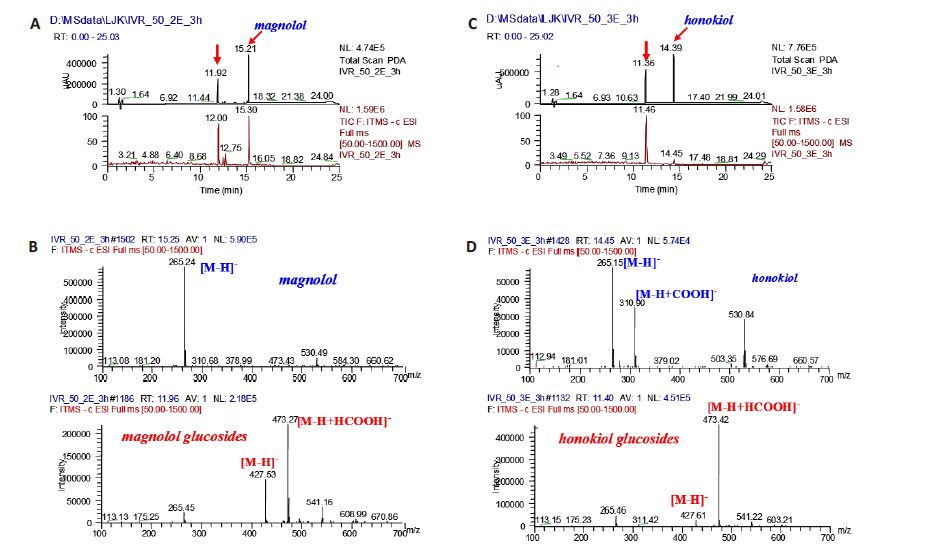
酶法糖基化反应液进一步经LC-MS分析,在负离子模式下,可分别观察到糖基化产物(1)质荷比(m/z)427.5的[M-H]-或m/z 473.3[M-H+HCOOH]-的信号峰(图 3A和3B)和糖基化产物(2)m/z 427.6的[M-H]-或 m/z 473.4[M-H+HCOOH]-的信号峰(图 3C和3D)。与底物的相对分子质量比较(厚朴酚与和厚朴酚分子量均为266),其相对分子质量均增加了162 Da,由此可推测糖基化反应均发生在底物的酚羟基上。
|
图 3 体外糖基化酶反应液的液质联用色谱分析 Figure 3 LC-MS analysis of the in vitro glycosylation reaction mixture. A: Total ion chromatogram of the in vitro glycosylation reaction mixture of magnolol; B: MS spectra of selected ion peak at 15.25 and 11.96 min,respectively; C: Total ion chromatogram of the in vitro glycosylation reaction mixture of honokiol; D: MS spectra of selected ion peak at 14.45 and 11.40 min,respectively. |
化合物1 的1H-NMR(DMSO-d6)数据为:δH 7.11(1H,d,J=8.5 Hz,H-3),7.09(1H,dd,J= 2.1,8.5 Hz,H-4),7.04(1H,d,J=2.2 Hz,H-6),7.02(1H,d,J=2.0 Hz,H-6'),6.95(1H,dd,J=2.2,8.2 Hz,H-4'),6.83(1H,d,J=8.2 Hz,H-3'),5.95(m,H-8 and H-8'),5.02(m,H-9 and H-9'),4.94(1H,d,J=7.8 Hz,H-1''),3.70(1H,dd,J=2.7,11.7 Hz,H-6''α),3.45(m,H-6''β),3.38-3.32(overlapped,H-7,H-7' and H-5''),3.28(m,H-3''),3.13-3.05(overlapped,H-2'' and H-4'')。以上数据与文献[8]比较基本一致,故鉴定化合物1 为magnolol-2- O-β-D-glucopyranoside。
化合物2 的1H-NMR(DMSO-d6)数据为:δH 7.31(1H,dd,J=2.2,8.5 Hz,H-6'),7.27(1H,m,H-2'),7.12(1H,d,J=8.5 Hz,H-5'),7.0(1H,d,J=2.1 Hz,H-6),6.93(1H,dd,J=2.2,8.2 Hz,H-4),6.83(1H,d,J=8.2 Hz,H-3),5.99(m,H-8 and H-8'),5.03(m,H-9 and H-9'),4.81(1H,d,J=7.4 Hz,H-1''),3.77-3.70(overlapped,H-6''α and H-6''β),3.52-3.45(overlapped,H-3'' and H-5''),3.41(m,H-7'),3.30-3.26(overlapped,H-7 and H-2''),3.20-3.15(overlapped,H-4'')。以上数据与文献[8]比较基本一致,故鉴定化合物2 为honokiol-4'-O-β- D-glucopyranoside。
2.4 糖基化修饰显著提高化合物的水溶性利用HPLC法检测厚朴酚、和厚朴酚以及其糖基化产物过饱和水溶液中的浓度。结果显示(表 1),厚朴酚糖基化产物(1)与和厚朴酚糖基化产物(2)的水溶性和其母体化合物(3和4)相比显著提高,分别为48.3和8.0倍,与文献报道基本一致[8]。
| 表 1 化合物1~4的水溶性检测 Table 1 Water solubility of compounds 1~4 determination(Mean± SD,n=3) |
MTT法测定结果显示(表 2),与对照组相比,不同浓度的化合物(0、6.25、12.5、25、50、100、200 μmol/L)处理4 种肿瘤细胞株MDA-MB-231、SMMC7721、 HepG2、SW480,均显示出较强的细胞增殖抑制作用。随着化合物的浓度增加,细胞增殖抑制效果越明显,呈现浓度±赖性,其IC50值为9.41~111.21 μmol/L。
| 表 2 化合物1~4的抑制肿瘤细胞增殖能力 Table 2 Anti-proliferative acitivity of compounds 1~4(IC50,μmol/L,Mean±SD,n=3) |
中药或天然产物作为天然形成的“组合化学样品库”,从中筛选出高效、低毒的单体化合物开发成新药,是抗肿瘤药物研发的重要来源,也符合当今“回归自然”的国际潮流。厚朴酚与和厚朴酚是我国传统中药厚朴的主要有效成分,也是本课题组在前期研究中筛选出的抗肿瘤活性成分[9],据文献报道[9]厚朴酚与和厚朴酚具有多靶点、多途径的抗肿瘤作用。厚朴酚与和厚朴酚结构中各含有一对酚羟基具有较强的抗氧化能力[12],还可抑制肿瘤细胞增殖[9],诱导细胞凋亡[13],抗血管生成[14],逆转肿瘤细胞多药耐药[15],具有良好的应用前景。
中草药含有多种有效成分,其结构与药理作用多种多样,但某些有效成分,因水溶性低或稳定性差或毒副作用太强,极大地限制了临床应用。因此,对这些天然产物进行结构改造是非常必要的,特别是糖基化结构修饰可增强活性与稳定性,提高水溶性与靶向性,改善药代动力学性质[16-17]。离体糖基化酶反应,不仅操作简单,有效地控制反应条件,还可以精确地检测反应结果。本研究首次利用酶法糖基化反应制备了2个新木脂素糖基化产物,即magnolol-2-O-β-D-glucopyrano-side(1)和 honokiol-4'-O-β-D-glucopyranoside(2),并且获得的糖基化产物水溶性明显高于其底物。本文中使用的糖基转移酶(YjiC)具有较广泛的底物选择特异性,以核糖核酸活化后的糖基(NDP-sugar)作为糖供体,可对多种结构类型的化合物进行糖基化结构修饰[10, 18]。厚朴酚在C-2和C-2'位置上具有酚羟基,且分子结构对称,YjiC可将UDP-Glc中的葡萄糖转移至酚羟基上得到糖基化产物,并经HPLC、LC-MS、NMR分析鉴定了一分子葡萄糖连接在C-2位酚羟基[8]。根据氢谱中,糖端基质子信号δ 4.94(1H,d,J=7.8 Hz,H-1'')的耦合常数(J=7.8 Hz),可确认厚朴酚糖基化产物(1)的糖苷键以β构型存在。和厚朴酚在C-2于C-4'位置上具有酚羟基,理论上可存在3个糖基化产物。然而,本研究中只观察到其中的1个糖基化产物,经HPLC、LC-MS、NMR分析鉴定了1分子葡萄糖连接在C-4'位酚羟基的糖基化产物[8],并根据糖端基质子的耦合常数(J=7.4 Hz)确认和厚朴酚糖基化产物(2)的糖苷键以β构型存在。
厚朴酚与和厚朴酚及其糖基化产物(1~4)对4种肿瘤细胞株MDA-MB-231、SMMC7721、HepG2、SW480的抗增殖活性检测实验中,均表现出较强的抑制细胞增殖的作用。有趣的是,HepG2和SW480细胞对糖基化产物的敏感性明显下降(IC50值相差2~5倍),这与糖基化修饰可能降低体外活性的一些报道一致[10, 19]。然而,SMMC7721细胞中,厚朴酚(3)与其糖基化产物(1)抑制细胞增殖的IC50值分别为39.06 μmol/L和16.21 μmol/L;和厚朴酚(4)与其糖基化产物(2)抑制细胞增殖的IC50值分别为24.92 μmol/L和12.51 μmol/L,即SMMC7721细胞对糖基化产物更加敏感,但其原因尚需进一步的探讨。
综上所述,厚朴酚与和厚朴酚的糖基化产物(1和2),不仅显著地提高了水溶性,而且增加了对SMMC7721细胞的敏感性,为今后的厚朴酚系列化合物的研究提供了物质基础。遗憾的是本研究中仅检测了体外抑制细胞增殖的作用,因此有待于进行的体内外药效以及药代动力学研究。
| [1] | Youn UJ, Chen QC, Jin WY, et al. Cytotoxic lignans from the stem bark of Magnolia officinalis[J]. J Nat Prod,2007, 70 (10) : 1687-9. DOI: 10.1021/np070388c. |
| [2] | Ito K, Iida T, Ichino K, et al. Obovatol and obovatal, novel biphenyl ether lignans from the levaves of Magnolia obovata THUNB[J]. Chem Pharm Bull,1982, 30 (9) : 3347-53. DOI: 10.1248/cpb.30.3347. |
| [3] | Lee YJ, Lee YM, Lee CK, et al. Therapeutic applications of magnolol compounds in the Magnolia family[J]. Pharmacol Ther,2011, 130 (2) : 157-76. DOI: 10.1016/j.pharmthera.2011.01.010. |
| [4] | Wu X, Chen X, Hu Z. High-performance liquid chromatographic method for simultaneous determination of honokiol and magnolol in rat plasma[J]. Talanta,2003, 59 (1) : 115-21. DOI: 10.1016/S0039-9140(02)00470-8. |
| [5] | 栗增, 王江, 周宇, 等. 先导化合物结构优化与策略(三) 通过化学修饰改善水溶[J]. 药学学报,2014, 49 (9) : 1238-47. |
| [6] | Gantt RW, Peltier PP, Thorson JS. Enzymatic methods for glyco(diversification/randomization) of drug and small molecules[J]. Nat Prod Rep,2011, 28 : 1811-53. DOI: 10.1039/c1np00045d. |
| [7] | Mandai T, Okumoto H, Oshitari T, et al. Synthesis and biological evaluation of water soluble taxoids bearing sugar moieties[J]. Heterocycles,2001, 54 : 561-6. DOI: 10.3987/COM-00-S(I)34. |
| [8] | Yang L, Wang ZH, Lei H, et al. Neuroprotective glucosides of magnolol and honokiol from microbial-specific glycosylation[J]. Tetrahedron,2014, 70 : 8244-51. DOI: 10.1016/j.tet.2014.09.033. |
| [9] | Li HM, Zhao SR, Huo Q, et al. A new dimeric neolignan from Magnolia grandiflora L. seed[J]. Arch Pharm Res,2015, 38 (6) : 1066-71. DOI: 10.1007/s12272-014-0476-4. |
| [10] | Wu CZ, Jang JH, Woo M, et al. Enzymatic glycosylation of non- benzoquinone geldanamycin analogs via Bacillus UDP-glycosyl- transferase[J]. Appl Environ Microb,2012, 78 (21) : 7680-6. DOI: 10.1128/AEM.02004-12. |
| [11] | 李红梅, 聂丽娟, 霍强, 等. Hsp90 抑制剂槚如酸对乳腺癌细胞 MDA-MB-231 细胞增殖、侵袭、迁移的影响[J]. 南方医科大学学报,2015, 35 (3) : 355-359. |
| [12] | Taira T, Ikemoto K, Miruma A, et al. Effective inhibition of hydroxyl radicals by hydroxylated biphenyl compound[J]. Free Radic Res,1993, 19 : S71-7. DOI: 10.3109/10715769309056s71. |
| [13] | Arora S, Singh S, Piazza GA, et al. Honokiol: a novel natural agent for cancer prevention and therapy[J]. Curr Mol Med,2012, 12 (10) : 1244-52. DOI: 10.2174/156652412803833508. |
| [14] | Chen MC, Lee CF, Huang WH, et al. Magnolol supresses hypoxia- induced angiogenesis via inhibition of HIF-1α/VEGF signaling pathway in human bladder cancer cells[J]. Biochem Pharmacol,2012, 85 (9) : 1278-87. |
| [15] | Xu D, Lu QH, Hu X. Down-regulation of P-glycoprotein expression in MDR breast cancer cell MCF-7/ADR by honokiol[J]. Cancer Lett,2006, 243 : 274-80. DOI: 10.1016/j.canlet.2005.11.031. |
| [16] | 孙婉, 李海凤, 陈静, 等. 基于微生物来源糖类天然产物生物合成的糖基异构化[J]. 药学学报,2013, 48 (2) : 179-86. |
| [17] | Cao J, Cui S, Li SW, et al. Targeted cancer therapy with a 2- deoxyglucose based adriamycin complex[J]. Cancer Res,2013, 73 (4) : 1362-1373. DOI: 10.1158/0008-5472.CAN-12-2072. |
| [18] | Pandy RP, Gurung RB, Parajuli P, et al. Assessing acceptor substrate promiscuity of YjiC-mediated glycosylation toward flavonoids[J]. Carbohyd Res,2014, 393 : 26-31. DOI: 10.1016/j.carres.2014.03.011. |
| [19] | Cheng H, Cao XH, Xian M, et al. Synthesis and enzyme specific activation of carbohydrate geldanamycin conjugates with potent anticancer activity[J]. J Med Chem,2005, 48 : 645-52. DOI: 10.1021/jm049693a. |
 2015, Vol. 35
2015, Vol. 35

