据美国癌症协会最新报告显示:宫颈癌位列全球女性恶性肿瘤发病和致死数的第4位,且发病人群越来越趋于年轻化[1-2],是威胁女性健康的重要杀手。尽管目前拥有放疗、化疗及外科手术等多种有效的方法治疗宫颈癌,但其致死率仍然居高不下,最主要的原因就是肿瘤发生了侵袭转移[3]。所以,寻找抗侵袭转移的新疗法已成为当前治疗宫颈癌的热点及难点。
Rb相关蛋白48(RbAp48)属WD-40蛋白家族,相对分子质量48 000,为一种Rb结合蛋白,参与染色质装配、重塑及核小体修饰等,调控细胞的分化、发育及干细胞的自我更新等,是维持细胞稳定和发育的关键因子[4-5]。近年来研究发现RbAp48还参与了肿瘤的发生发展,与肿瘤的增殖、转移、复发和治疗抵抗有着密切的关系[6]。
本课题组前期研究发现,人宫颈癌细胞的RbAp48蛋白表达明显高于其癌旁组织细胞,下调RbAp48的表达后宫颈癌细胞的生长受到明显的抑制,表明RbAp48可能是治疗宫颈癌的一个潜在靶点[7]。至于下调 RbAp48表达对宫颈癌细胞的迁移和侵袭会产生怎样的作用尚未见报道,本研究对此课题进行了探讨。
1 资料与方法 1.1 细胞株人子宫颈癌细胞株MS751购自中科院上海细胞库。
1.2 主要试剂Ctrl-siRNA、RbAp48-siRNA由广州市锐博生物科技有限公司合成;Lipofectamine RNA imax 购自 Invitrogen 公司;兔抗人RbAp48 单克隆抗体购自 Abcam 公司;兔抗人β-actin、Vimentin、N-cadherin、 E-cadherin、Snail、鼠抗人Twist、山羊抗兔IgG-二抗购自 CST公司;兔抗人MMP-2、TIMP-2 购自博士德公司; ECL 化学发光试剂盒购自Millipore公司。其余试剂均为国产分析纯。
1.3 细胞培养与RNA干扰人宫颈癌细胞MS751用含10%胎牛血清和0.11 g/L丙酮酸钠的MEM培养基、5% CO2、37 ℃培养,取对数生长期细胞用于实验。实验设Control组(Lipofectamine)、对照序列组(Ctrl-siRNA)和实验组(RbAp48-siRNA)。转染前24 h将细胞按4×103/孔接种于96孔板,4×105/孔接种于6孔板中,确保转染时细胞达到50%汇合度,按照lipofectamine RNA imax说明书分别进行转染。
1.4 划痕实验以每孔4 × 105 细胞接种于6 孔板,对照组(CtrlsiRNA)和实验组(RbAp48-siRNA)转染后24 h,用200 μL枪头均匀划痕,PBS清洗3 遍,用含1%胎牛血清和0.11 g/L丙酮酸钠的MEM培养基培养。在划痕后0、24 h对划痕进行拍照。实验重复3次。
1.5 Transwell小室检测细胞的迁移能力按照BD公司使用说明书,将Transwell 小室置于24孔板中,下室加入800 μL含10%胎牛血清和0.11 g/L丙酮酸钠的MEM培养基,上室加入300 μL含1%胎牛血清和0.11 g/L丙酮酸钠的MEM培养基,含对数生长期的MS751细胞2×105。培养48 h后,将小室取出并用 PBS清洗,对上室没有穿过的细胞用湿棉签轻轻擦掉,以100%结晶紫(无水甲醇配制)染色,在200倍显微镜下从小室的上、下、左、右、中共选取5个视野进行计数。实验重复3次。
1.6 Transwell 小室检测细胞的侵袭能力按照BD公司使用说明书,将Transwell 小室置于24孔板中并在底部均匀涂上基质胶,下室加入800 μL含10%胎牛血清和0.11 g/L丙酮酸钠的MEM培养基,上室加入300 μL含1%胎牛血清和0.11 g/L丙酮酸钠的 MEM培养基,含对数生长期的MS751 细胞2×105个。培养48 h后,将小室取出并用PBS清洗,对上室没有穿过的细胞用湿棉签轻轻擦掉,以100%结晶紫(无水甲醇配制)染色,在200倍显微镜下从小室的上、下、左、右、中共选取5个视野进行计数。实验重复3次。
1.7 Western blot检测蛋白表达siRNA转染48 h后,分别提取各组细胞裂解10 min,12 000 r/min、4 ℃离心10 min,取上清,BCA法测总蛋白浓度;蛋白样品上样于12% SDS-PAGE电泳,半干法转印到PVDF膜;室温下用含5%脱脂奶粉的TBST溶液封膜2 h,一抗4 ℃孵育过夜;二抗室温孵育1 h,ECL化学显影。实验重复3次。
1.8 统计学处理应用SPSS 20.0 和Excel软件进行分析,数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较用SNK法,以P<0.01认为差异有统计学意义。
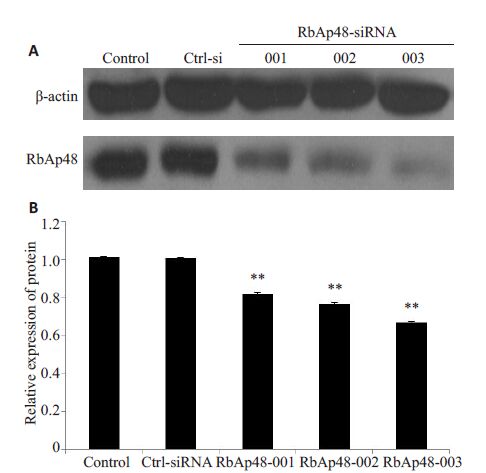
2 结果 2.1 siRNA可有效下调MS751细胞中RbAp48的表达与Control组、Ctrl-siRNA阴性组相比,转染的3条 RbAp48-siRNA 001、002、003均显著降低RbAp48的表达,其中003序列下调效果较佳,被选做用于后续实验(图 1)。
|
图 1 RbAp48-siRNA对MS751细胞RbAp48表达的下调作用 Figure 1 Effect of RbAp48-siRNA on RbAp48 expression in MS751 cells. A: Expression of RbAp48 detected by Western blotting; B: Quantitative analysis of the results of Western blotting. **P<0.01. |
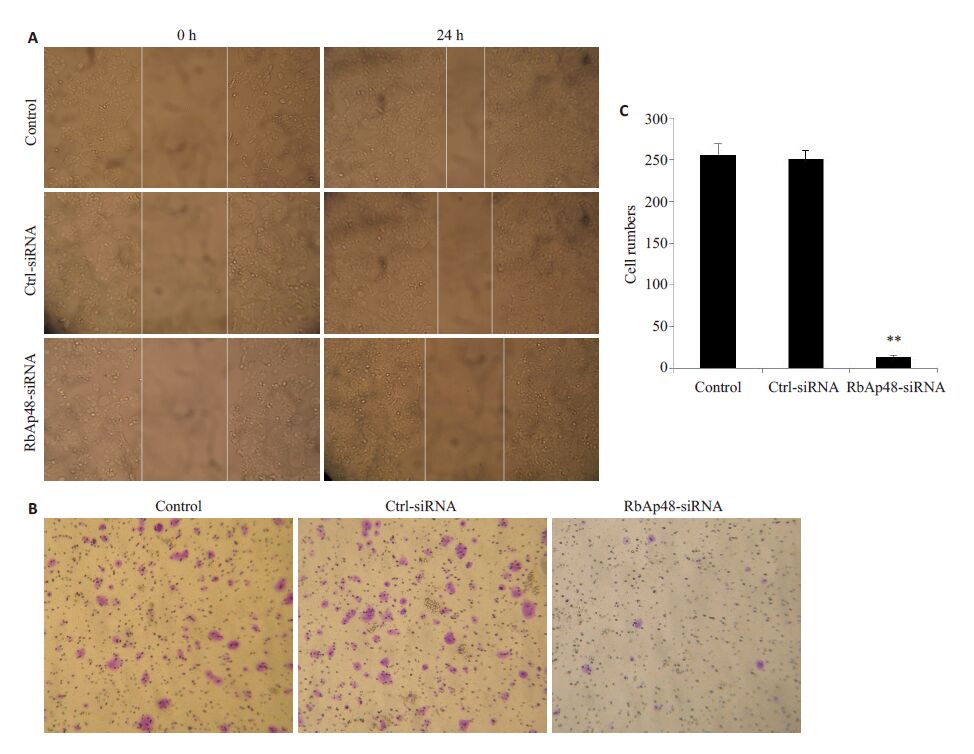
我们先前的研究发现人宫颈癌Hela(腺癌)、 MS751(鳞癌)在转染RbAp48-siRNA后48 h内未见明显细胞增殖抑制作用,尤其是MS751细胞株要在96 h后才有明显的细胞抑制作用[7],鉴于人宫颈癌大多为鳞癌(约>90%),所以本研究选用MS751细胞株观察下调 RbAp48后在细胞增殖尚无明显受抑制时对迁移侵袭的作用。细胞划痕实验显示,转染48 h后Control组及 Ctrl-siRNA 组划痕因细胞迁移而明显变窄,而 RbAp48-siRNA 组划痕仍保持较宽水平,表明细胞的迁移减慢(图 2A)。同样,Transwell 迁移实验显示,转染48 h 后,RbAp48-siRNA 组较对照组迁移的细胞数量明显减少(图 2B,C)。以上两个实验结果显示下调 RbAp48表达后,MS751细胞的迁移受到明显抑制。
|
图 2 下调RbAp48的表达对MS751细胞迁移的影响 Figure 2 Effect of RbAp48 expression down-regulation on migration of MS751 cells. A: Wound healing assay; B: Transwell assay; C: Quantitative analysis of cell migration. **P<0.01. |
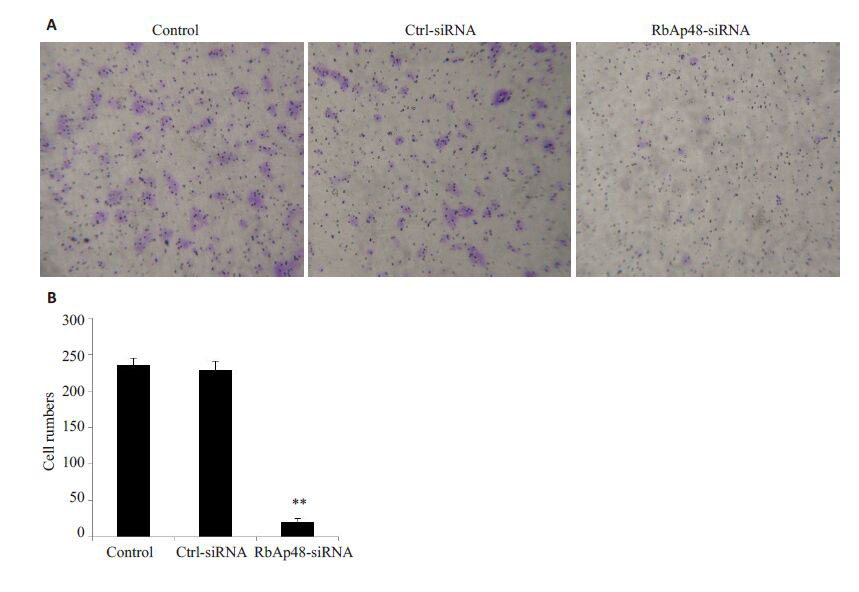
Transwell 侵袭实验显示,RbAp48-siRNA 转染组较Control组及Ctrl-siRNA对照组穿过基质胶的侵袭细胞数量明显减少(图 3)。
|
图 3 下调RbAp48的表达对MS751细胞侵袭能力的影响 Figure 3 Effect of RbAp48 knockdown on invasion of MS751 cells. A: Transwell assay; B: Quantitative analysis of cell invasion. **P<0.01. |
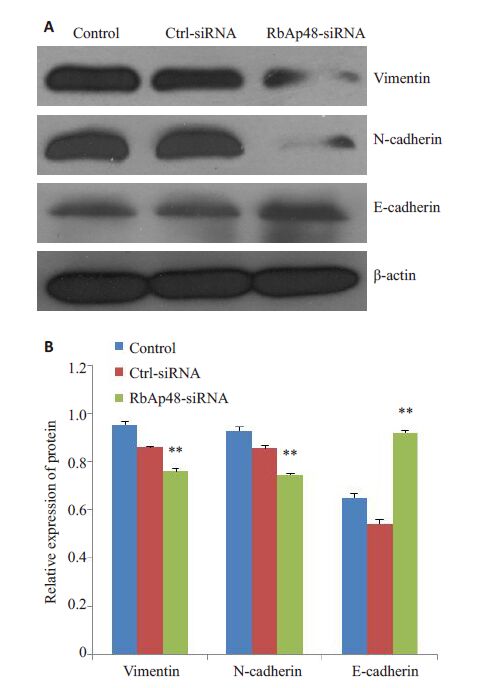
与Control组、Ctrl-siRNA组相比,下调RbAp48表达后,可显著下调间充质细胞表型蛋白Vimentin、Ncadherin的表达,上调上皮型细胞表型蛋白E-cadherin的表达,显示下调RbAp48的表达可抑制MS751细胞的上皮-间充质样变(图 4)。
|
图 4 下调RbAp48 的表达对MS751 细胞Vimentin、 N-cadherin、E-cadherin蛋白表达的影响 Figure 4 Effect of RbAp48 knockdown on the expressions of Vimentin,N-cadherin,and E-cadherin in MS751 cells. A: Western blotting; B: Quantitative analysis. **P<0.01. |
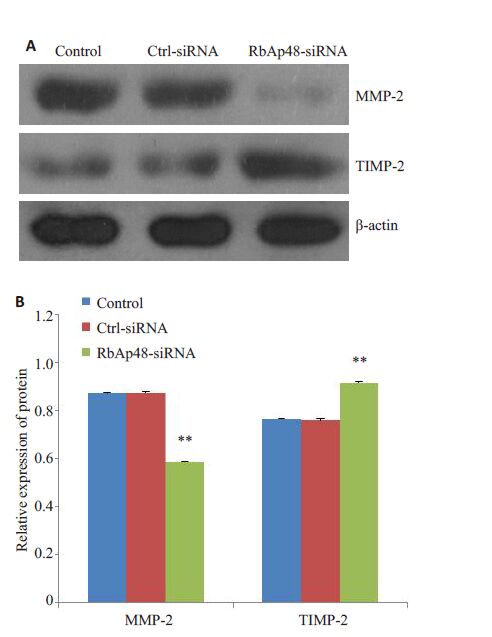
下调RbAp48表达后MS751细胞的基质金属蛋白酶2(MMP-2)表达下降,与之相反,其活性抑制物金属蛋白酶抑制物2(TIMP-2)的表达却明显增加(图 5),表明下调RbAp48后MS751细胞的侵袭细胞外基质的能力会受到抑制。
|
图 5 下调RbAp48 的表达对MS751 细胞MMP-2 和 TIMP-2蛋白表达的影响 Figure 5 Effect of RbAp48 knockdown on the expressions of MMP-2 and TIMP-2 in MS751 cells. A: Western blotting; B: Quantitative analysis. **P<0.01. |
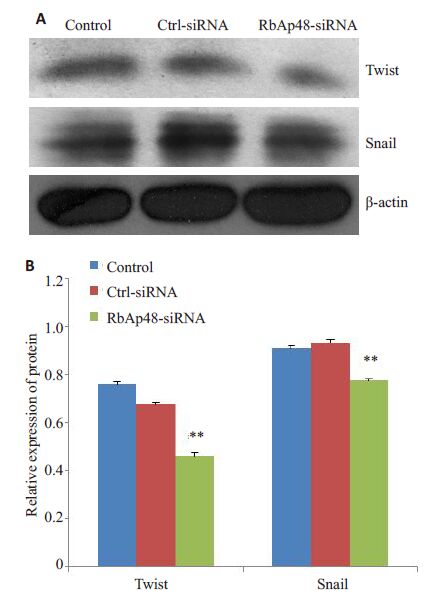
Western blot 结果显示下调RbAp48 表达可使 MS751 细胞EMT上游调节蛋白Twist、Snail 表达下降(图 6),表明其抑制EMT 的作用与Twist、Snail 通路有关。
|
图 6 下调RbAp48 的表达对MS751 细胞Twist、Snail 蛋白表达的影响 Figure 6 Effect of RbAp48 knockdown on the expressions of Twist and Snail in MS751 cells. A: Western blotting; B: Quantitative analysis. **P<0.01. |
肿瘤之所以难以根治,一个重要原因是其具有侵袭转移能力,这是当前抗肿瘤的一大难题[8]。近年来研究证明,癌细胞发生的上皮-间充质样变(EMT)是肿瘤细胞迁移侵袭的一个关键因素[9-10]。所谓EMT是指上皮细胞在特定因素的刺激下细胞转化成具有活动能力强、能够在细胞基质间自由移动的间充质样细胞的过程。这种改变不仅仅是细胞形态学的改变,更重要的是基因表型的改变,这主要包括有(1)上皮细胞表型的降低或缺失,如E-钙黏蛋白等;(2)间质细胞表型呈现过表达,如波形蛋白、N-钙黏蛋白、基质金属蛋白酶(MMP)等。细胞一旦发生EMT样变,则细胞骨架结构会发生变化,细胞形态由立方形变为纺锤形,细胞间的明显黏附性下降,而运动能力明显增强,从而使细胞更易于迁移游动,同时由于MMP(尤其是 MMP-2)的表达及活性增加,使细胞更具有侵袭性,易于发生转移。抑制肿瘤细胞EMT是当前抗肿瘤转移一个极具前途的靶向[11-12]。
本研究发现下调RbAp48 表达后,MS751 细胞的上皮细胞表型蛋白E-cadherin 表达明显增加; E-cadherin是维持细胞上皮表型的重要分子,正常情况下细胞之间的E-cadherin通过胞外的免疫球蛋白结构域相互形成链接,并通过胞浆内的α、γ链接素(α、γ-catenin)与肌动蛋白骨架连接,从而形成稳定的细胞间接触,其表达量的变化是EMT最具标志性的指标之一[13]。结合我们的结果,由于E-cadherin 的上调,显示下调RbAp48 后细胞间的粘附能力会有所增强,细胞的脱离会受到抑制。
EMT 另一个重要变化是Vimentin 表达升高。 Vimentin 是细胞骨架中间纤维的一种,广泛存在于间充质细胞及中胚层来源的细胞中。对于上皮源性细胞,Vimentin表达增多会使得细胞骨架结构发生变化,细胞形态由立方形变为纺锤形,细胞黏附性下降,细胞运动能力增强,从而使细胞更易于迁移游动。此外,N- cadherin 表达增多也是EMT 的重要特征;与 E-cadherin 相反,在间质型细胞中,N-cadherin 具有促进细胞运动和迁移的作用,其介导肿瘤细胞的迁移作用甚至超过E-cadherin所介导的细胞黏附作用。我们的结果发现经RbAp48-siRNA处理后间质细胞表型蛋白Vimentin、N-cadherin 的表达均显著降低,说明下调 RbAp48 后抑制了宫颈癌MS751 细胞的间充质样变,使细胞的迁移能力受到抑制,从而能够抑制肿瘤细胞的转移。
如前所述,MMP表达的增多及活性增强是EMT的一个重要特征,其中尤以MMP-2 最具代表性,而 TIMP-2 是一个重要的金属蛋白酶抑制物,主要抑制 MMP-2 的活性,对其它多种MMP酶也具有抑制作用,同时还具有抑制新生血管生成的作用[14];所以 TIMP-2 表达的升高也是抑制宫颈癌细胞侵袭能力的一个重要因素。我们的实验观察到下调RbAp48表达后MMP-2 的表达受到一定程度的抑制,而TIMP-2 表达却得到提升,这一升一降,也从肿瘤细胞对细胞外基质侵蚀的环节产生抑制MS751侵袭转移作用。
EMT的发生受到诸如非编码RNA、蛋白信号通路等多种因素的调节,其中Twist、Snail是两个比较明确且关键的调节蛋白。Twist 属于碱性螺旋-环-螺旋转录因子家族,具有高度保守性,其基因5'端调节区域的启动子上游含有NF-κB、AP-2、SP-1和RB 的结合位点,并受这些因子的调节;Twist 能够抑制E-钙黏蛋白的表达,促进N-钙粘蛋白表达。Snail在正常上皮细胞中一般不表达,但在许多具有高转移特性的肿瘤细胞中常常呈现高表达,它能显著抑制E-钙黏蛋白及其它一些上皮细胞表型蛋白的表达,同时还会激活诸如波形蛋白、纤连蛋白及金属蛋白酶等间质细胞表型的表达[13, 15]。本实验结果显示在下调RbAp48 表达后,Twist、Snail 蛋白的表达发生下调,表明下调RbAp48表达能够抑制EMT上游调节蛋白Twist、Snail,这对于 MS751 细胞EMT的发生具有负调控的作用,显然这与抗迁移侵袭有关,但至于更深层次的作用机制还有待进一步研究。
肿瘤细胞侵润转移是宫颈癌致死的关键,宫颈癌细胞通过发生EMT从而引发转移及耐药都已得到证实,针对EMT发生通路的靶向治疗也日益受到重视[16],本研究发现下调RbAp48的表达能有效抑制宫颈癌细胞株MS751的迁移和侵袭能力,这给根治宫颈癌提供了一个新思路。鉴于RbAp48在宫颈癌细胞中具有异常的高表达[7],其有望成为治疗宫颈癌的一个新靶点。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin,2015, 65 (1) : 5-29. DOI: 10.3322/caac.21254. |
| [2] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin,2015, 65 (2) : 87-108. DOI: 10.3322/caac.21262. |
| [3] | Gupta GP, Massagué J. Cancer metastasis: building a framework[J]. Cell,2006, 127 (4) : 679-95. DOI: 10.1016/j.cell.2006.11.001. |
| [4] | Xiao LB, Tao YG, Li LL, et al. Polycomb group proteins and their roles in carcinogenesi[J]. Chin Sci Bull,2012, 57 (18) : 2259-64. DOI: 10.1007/s11434-012-5225-9. |
| [5] | Zhen g L, Tang W, Wei FH, et al. Radiation-inducible protein RbAp48 contributes to radiosensitivity of cervical cancer cells[J]. Gynecol Oncol,2013, 130 (3) : 601-8. DOI: 10.1016/j.ygyno.2013.06.002. |
| [6] | Richly H, Aloia L, Di Croce L. Roles of the polycomb group proteins in stem cells and cancer[J]. Cell Death Dis,2011, 2 (9) : e204. DOI: 10.1038/cddis.2011.84. |
| [7] | 钟晶晶, 杨旭锐, 麦梅清, 等. 下调RbAp48表达对Hela细胞株的生长抑制作用[C]//广东省药理学会第七届 2015 学术交流大会论文汇编, 2015: 163-4. |
| [8] | Mitra A, Mishra L, Li SL. EMT, CTCs and CSCs in tumor relapse and drug-resistance[J]. Oncotarget,2015, 6 (13) : 10697-711. DOI: 10.18632/oncotarget. |
| [9] | Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial- mesenchymal transition[J]. Nat Rev Mol Cell Bio,2014, 15 (3) : 178-96. DOI: 10.1038/nrm3758. |
| [10] | Tam WL, Weinberg RA. The epigenetics of epithelial-mesenchymal plasticity in cance[J]. Nat Med,2013, 19 (11) : 1438-49. DOI: 10.1038/nm.3336. |
| [11] | Wang JQ, Wu KJ. Epigenetic regulation of Epithelial-Mesenchymal transition by hypoxia in cancer: targets and therapy[J]. Curr Pharm Des,2015, 21 (10) : 1272-8. DOI: 10.2174/1381612821666141211145610. |
| [12] | Cañadas I, Rojo F, Taus A, et al. Targeting Epithelial-to-mesenc- hymal transition with met inhibitors reverts chemoresistance in small cell lung cance[J]. Clin Cancer Res,2014, 15, 20 (4) : 938-50. |
| [13] | Shamir ER, Pappalardo E, Jorgens DM, et al. Twist-induced dissemination preserves epithelial identity and requires E-cadherin[J]. J Cell Biol,2014, 204 (5) : 839-56. DOI: 10.1083/jcb.201306088. |
| [14] | Carreira Falcao AS, Da Silva Kataoka MS, Picanco Diniz J, et al. A novel cell line derived from pleomorphic adenoma expresses MMP2, MMP9, TIMP1, TIMP2, and shows numeric chromosomal anomalie[J]. PLoS One,2014, 9 (8) : e105231. DOI: 10.1371/journal.pone.0105231. |
| [15] | White RA, Neiman JM, Reddi A, et al. Epithelial stem cell mutations that promote squamous cell carcinoma metastasis[J]. J Clin Invest,2013, 123 (10) : 4390-404. DOI: 10.1172/JCI65856. |
| [16] | Qureshi R, Arora H, Rizvi MA. EMT in cervical cancer: its role in tumour progression and response to therapy[J]. Cancer Lett,2015, 356 (2 Pt B) : 321-31. |
 2015, Vol. 35
2015, Vol. 35

