2. 华北理工大学 附属医院病理科,河北 唐山 063000 ;
3. 华北理工大学 唐山市老年医学重点实验室,河北 唐山 063000
2. Department of Neurology,Affiliated Hospital of Hebei United University,Tangshan 063000,China ;
3. Key Laboratory of Gerontology of Tangshan,Tangshan 063000,China
脑慢性低灌注是由于脑动脉硬化等引起的脑动脉狭窄所致的长期脑组织灌注不足。虽然这种低灌注不引起明显的大面积梗死,但大量研究证明,大脑长期处于缺血缺氧状态,可造成进行性智能及认知功能障碍。同时,脑部低代谢状态也会造成脑实质及脑微血管的损害[1-2]。随着生活水平的改善及老龄化进程的加快,这种由于慢性低灌注造成痴呆的发病率也逐年上升。近年来临床资料及研究表明,女性绝经后的脑血管疾病的患病率远远高于绝经前女性以及同年龄段的男性,可见,循环中雌激素水平的高低与女性中枢神经系统退行性病变有着密切的关系[3]。目前对于该病的治疗多集中在神经元保护,而大脑微血管损伤的保护常常被忽视,由于脑微血管是构成血脑屏障的重要组成部分,微血管的损伤可以进一步加重脑损害。本实验采用雌性去势大鼠BCCAO模型,旨在观察大脑慢性低灌注早期及晚期脑微血管的损伤情况,及生理剂量雌激素替代治疗的影响。
1 材料与方法 1.1 材料SPF级健康成年雌性SD大鼠,体质量280~300 g,65只,购自北京华阜康生物科技股份有限公司(许可证编号:SCXK 京2004-0004)。羊源多克隆VEGF(sc-7133)一抗、鼠源单克隆α-tubulin(32K4827)一抗、大鼠源单克隆IgG(sc-2026)一抗均购自Santa Cruz 公司,17-β-雌二醇、碱磷酶标记的二抗均购自Sigma,ALZET 2002 型渗透缓释泵(缓释14 d);2006 型渗透泵(缓释42 d)购自美国DURECT 公司。
1.2 方法 1.2.1 大鼠双侧卵巢切除术及BCCAO动物模型的建立所有实验动物用10% 水合氯醛(700 mg/kg)腹腔麻醉大鼠后切除其双侧卵巢。于去势后第7 天,制备 BCCAO模型[4]。详细过程如下,将大鼠麻醉后仰卧固定于手术台上,钝性分离并永久性结扎左侧颈总动脉,间隔1周时间以同样方法结扎右侧颈总动脉。雌激素组或安慰剂组于第一次颈总动脉结扎时随即在颈后背部皮下埋置雌激素/安慰剂缓释泵。假手术组(sham组)大鼠去势后只分离颈总动脉,但不结扎。
1.2.2 雌激素泵的配制方法用100%酒精配制10 mg/mL雌二醇溶液(雌激素储备液),然后用20% β-cyclodextrin溶液稀释雌激素储备液100倍至其终溶度为0.1 μg/μL。取200 μL雌二醇溶液加入缓释泵(0.5 μL/h,14 d);取200 μL雌二醇溶液加入缓释泵(0.15 μL/h,42 d)。
1.2.3 制作海马冠状冰冻切片用10%水合氯醛将大鼠腹腔麻醉(700 mg/kg),心脏灌注后取脑,用4% 多聚甲醛后固定过夜,30% 蔗糖脱水至组织下沉,OCT包埋后于-18 ℃制作大脑组织冠状位冰冻切片(25 μm)。
1.2.4 免疫组织化学染色冰冻切片用0.01 M PBS洗10 min×3次,0.4% Triton-PBS打孔30 min,10%马血清(含1% H2O2)室温封闭1 h,加入一抗(1∶50)4 ℃孵育48 h。0.1% Triton-PBS洗10 min×3次,加入相对应的生物素化的二抗(1∶200),室温孵育1 h,0.1% Triton-PBS漂洗10 min×3次,加入链酶亲和素-生物素-过氧化物酶复合物,室温孵育1 h,0.1% Triton-PBS 洗10 min×3,DAB显色后用双蒸水终止显色,梯度酒精脱水,二甲苯透明,用中性树胶封片,光镜下采集图像。
1.2.5 透射电镜样品的制备参照本实验室已建立的方法[5],取大鼠海马组织1 mm3,2.5% 戊二醛后固定4 h,2%四氧化锇固定30 min,组织经梯度酒精脱水,环氧树脂812浸透包埋后,制作组织超薄切片(70 nm),乙酸双氧铀(30 min)和柠檬酸铅(10 min)复染,透射电镜(Hitachi-7650)扫描。
1.2.6 Western blot大鼠麻醉后,低温下分离海马组织,迅速移至液氮冻存。制备海马总蛋白匀浆液,BCA法测定蛋白浓度。100 μg蛋白经7.5% SDS聚丙烯凝胶电泳分离后以湿转法电转移至PVDF膜上,3% BSA封闭1 h,一抗VEGF(1∶200)、α-tubulin(1∶500)4 ℃过夜,TBST洗膜,加入相应的碱磷酶标记的二抗室温孵育2 h,TBST洗膜,NBT/BCIP显色。
1.2.7 统计学处理数据以均数±标准差表示,统计分析采用单因素方差分析(One way ANOVA),多个实验组与一个对照组比较用最小显著差法(LSD),实验组之间比较采用q检验(Newman-Keuls test),P<0.05为统计学有显著差异。
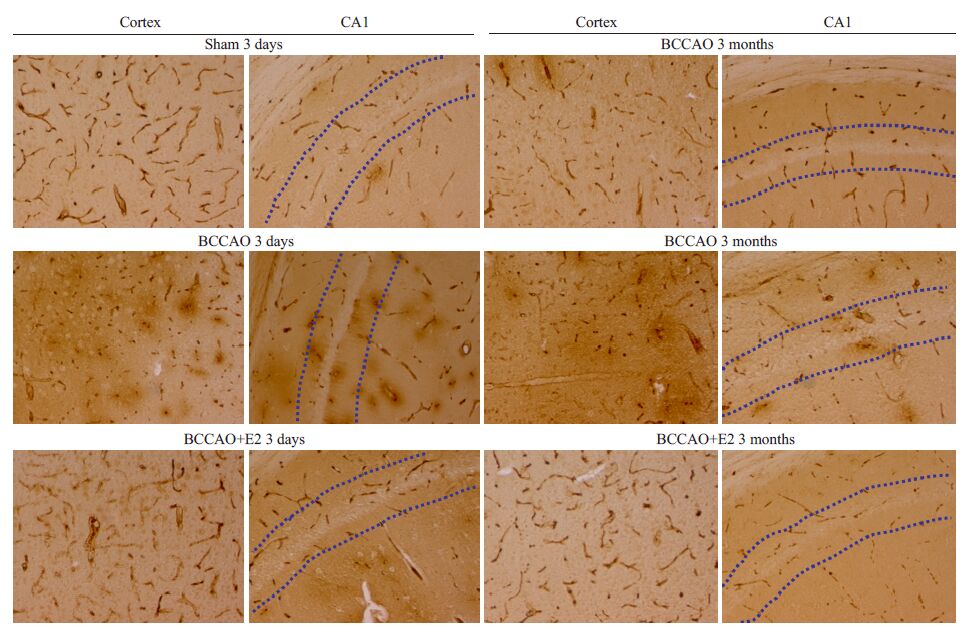
2 结果 2.1 BCCAO后微血管渗漏及E2的影响如图 1所示,大脑皮质sham(3 d/3月)和E2处理组 IgG染色基本限制于血管腔内,而BCCAO后3 d和3月组IgG大量渗出,在血管周围形成明显的棕褐色晕圈;在海马CA1区,BCCAO后3 d组血管周围可见明显的 IgG阳性染色,而BCCAO后3月组血管周围IgG阳性染色较BCCAO3 d显著减少。
|
图 1 慢性低灌注后各组IgG的渗漏以及生理剂量雌激素替代治疗的保护作用 Figure 1 IgG leakage into the brain parenchyma following BCCAO and protective effect of E2 replacement therapy (Original magnification: ×20) . |
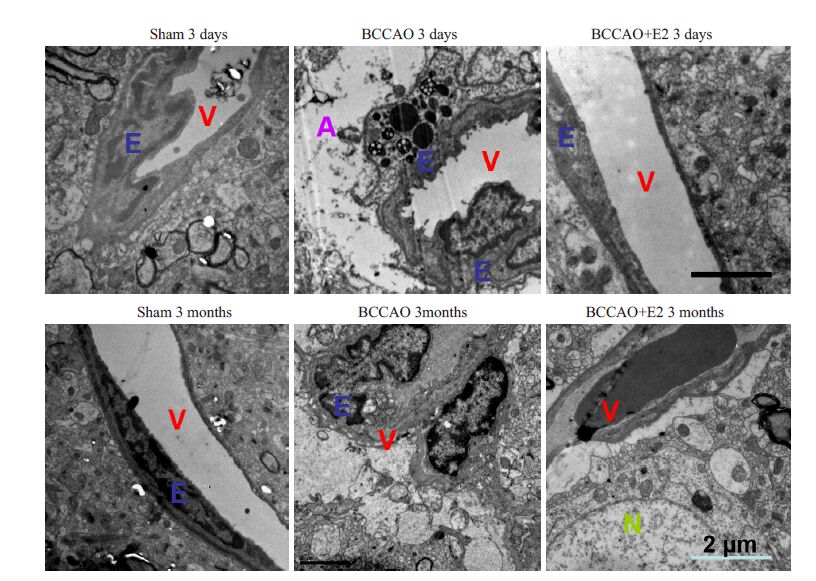
如图 2 所示,sham 3 d组血管周围无水肿,血管壁光滑,基膜完整;BCCAO 3 d组血管周围严重水肿,血管壁薄,基底膜溶解、缺损,可见内皮细胞并列排列,血管外星形胶质细胞形态肥大,线粒体嵴断裂,并可见较多的溶酶体。Sham 3月除轻度基底膜溶解、缺损外,未见血管异常;而BCCAO 3月组血管周围水肿虽然有所改善,但血管管腔扩张,内皮细胞染色质边集、核固缩,并可见血管外线粒体嵴的断裂。连续E2处理组(不管是短期还是长期组)血管周围水肿消失,基底膜及内皮细胞超微结构完整,逆转了BCCAO导致的脑微血管损伤。各组皮层微血管的超微变化同海马CA1区(数据未显示)。
|
图 2 BCCAO后大脑海马CA1区微血管超微结构的变化及生理剂量雌激素替代的保护作用 Figure 2 Ultrastructure changes of blood vessels after BCCAO and protective effect of E2 replacement therapy. E: Endothelium cells,V: Vascular,A: Astrocyte,N: Neuron. |
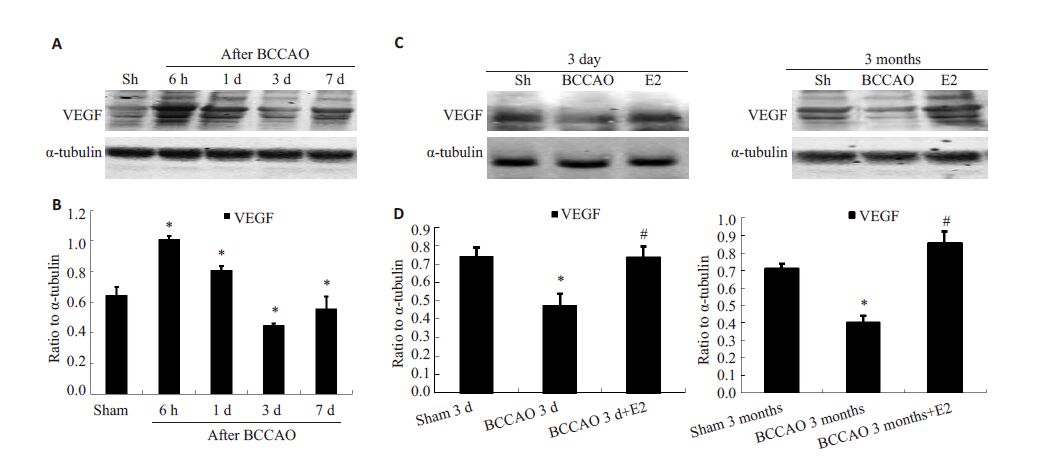
如图 3Western blot 结果所示,海马CA1 区VEGF的表达于BCCAO后6 h,1 d显著增高,此后显著降低,于3 d 达最低,7 d 有所升高;另外,BCCAO 后3 月 VEGF蛋白表达较sham 3月组显著降低(P<0.05),持续给予E2处理组(BCCAO 3 d+ E2,BCCAO 3月+E2)可显著升高BCCAO 后海马CA1 区VEGF 的蛋白表达(P<0.05)。
|
图 3 免疫印记法检测BCCAO后大鼠海马CA1区VEGF的蛋白表达及雌激素的影响 Figure 3 Western blotting results showing VEGF protein expression in the hippocampal CA1 region following BCCAO and the effect of E2. A-B: Time course of VEGF early after BCCAO (F=145.639,*P<0.001 vs. sham group,n=4) ; C-D: Effects of E2 treatment on VEGF protein expression at 3 days and 3 months after BCCAO,respectively (*P<0.05,#P<0.05 vs 3 days and 3 months after BCCAO). |
大鼠双侧颈总动脉永久结扎(BCCAO)模型较好的模拟了因动脉粥样硬化、动脉管腔狭窄等引起的慢性脑低灌注,且这种低灌注状态可以维持数周甚至术后3个月[4],进而对大鼠的学习及认知功能造成损害,促进血管性痴呆的发展,然而其分子机制少见报道。近年有研究证明,循环雌激素水平对维持中枢神经系统稳态具有重要作用,并且雌激素在中枢神经系统退行性疾病,如中风、帕金森氏病、阿尔茨海默氏病等中发挥着重要的神经元保护作用,包括神经营养、学习、认知及记忆功能的维护等[6-7]。课题组以往的研究也证明雌激素可以有效改善脉络丛的结构,保护血脑屏障结构及功能的完整性[8]。本课题组以往的研究证明长期给予生理剂量雌激素能够有效降低全脑缺血诱导的神经元损伤及认知功能障碍[9],然而其是否可以保护慢性低灌注诱导的血管性痴呆及其分子机制,目前尚无报道。
脑微血管由单层的内皮细胞与基底膜所组成,与紧密连接共同构成微血管的通透屏障。其结构及功能的完整性对维持大脑内环境稳态至关重要。且其对内环境改变的反应十分敏感[10]。本实验透射电镜结果发现 BCCAO早期,大脑微血管周围严重水肿,而长期慢性大脑低灌注组血管内皮细胞出现轻度的凋亡现象,可见持续的慢性低灌注状态可引起持续的损害,持续生理剂量雌激素替代治疗组脑微血管超微结构完整。该结果证明慢性低灌注早期即可引起大脑微血管的损伤,而雌激素可显著有效保护大脑微血管的结构完整性。
IgG是一种内源性的血清蛋白。正常生理情况下,血清蛋白不能够透过血脑屏障,当脑组织中有外渗的血清蛋白存在时,即说明血脑屏障损伤,其通透性增加[11]。并且IgG在脑组织的异常积聚会进一步引发中枢神经系统的损伤[12]。本实验中IgG的染色结果证明,在脑皮层和海马CA1区,BCCAO后慢性低灌注早期(3 d)大脑微血管通透性增加,BBB严重受损;BCCAO后3 m IgG 渗漏较早期减轻,但±然可见血管外脑组织IgG较强的阳性染色,生理剂量雌激素替代治疗组无显著的IgG渗漏。因此,我们的结果进一步说明尽管大脑微血管可能存在自我修复能力,但是BCCAO早期导致的血管损伤可持续较长时间,并最终可能导致痴呆。从慢性低灌注早期长期给予生理剂量雌激素能够加强微血管的修复能力,有效改善慢性低灌注状态下脑微血管的结构。
VEGF是对血管形成具有特异性的重要生长因子,脑缺血损伤发生后,内皮细胞、神经元、星形胶质细胞以及小胶质细胞均可以分泌VEGF蛋白,进而诱导血管修复、再生过程[13]。本实验中,VEGF的表达在慢性大脑低灌注后早期反应性增加,可能是局部组织代谢以及功能恢复所必须,因此VEGF的这种反应性增加可能能够促进新生血管的生成,是一种伤害刺激下的代偿反应。随着脑慢性低灌注的进展(BCCAO 3 d,BCCAO 3 m) VEGF蛋白表达始终保持在较低水平,而持续生理剂量 E2处理能够显著上调VEGF的表达,因此我们推断这可能是长期生理剂量17-β-雌二醇替代治疗对慢性低灌注状态下大脑微血管保护作用的机制之一。
总之,慢性大脑低灌注早期就可以引起大脑微血管的损伤,鉴于微血管在维持大脑内环境稳态中的重要作用,人们在关注神经元保护的同时也应该更加重视微血管的保护,长期生理剂量雌激素替代能够通过上调 VEGF的表达有效改善低灌注状态下微血管的结构及功能,但其具体机制仍需进一步研究。
| [1] | Won JS, Kim J, Annamalai B, et al. Protective role of S- nitrosoglutathione (GSNO) against cognitive impairment in rat model of chronic cerebral hypoperfusion[J]. J Alzheimers Dis,2013, 34 (3) : 621-35. |
| [2] | de la Torre JC. Cardiovascular risk factors promote brain hypoperfusion leading to cognitive decline and dementia[J]. Cardiovasc Psychiatry Neurol,2012 : 367516. |
| [3] | Brann DW, Dhandapani K, Wakade C, et al. Neurotrophic and n europrotective actions of estrogen: basic mechanisms and clinical implication[J]. Steroids,2007, 72 (5) : 381-405. DOI: 10.1016/j.steroids.2007.02.003. |
| [4] | Cechetti F, Worm PV, Pereira LO, et al. The modified 2VO ischemia protocol causes cognitive impairment similar to that induced by the standard method, but with a better survival rate[J]. Braz J Med Biol Res,2010, 43 (12) : 1178-83. DOI: 10.1590/S0100-879X2010007500124. |
| [5] | Zhou C, Tu J, Zhang Q, et al. Delayed ischemic postconditioning protects hippocampal CA1 neurons by preserving mitochondrial integrity via Akt/GSK3β signaling[J]. Neurochem Int,2011, 59 (6) : 749-58. DOI: 10.1016/j.neuint.2011.08.008. |
| [6] | Tang H, Zhang Q, Yang L, et al. GPR30 mediates estrogen rapid signaling and neuroprotection[J]. Mol Cell Endocrinol,2014, 387 (1/ 2) : 52-8. |
| [7] | Semenas E, Sharma HS, Nozari A, et al. Neuroprotective effects of 17β-estradiol after hypovolemic cardiac arrest in immature piglets: the role of nitric oxide and peroxidation[J]. Shock,2011, 36 (1) : 30-7. DOI: 10.1097/SHK.0b013e3182150f43. |
| [8] | 黎洁, 朱莹, 杨辉, 等. 雌激素对慢性低灌注大鼠血脑屏障通透性的影响[J]. 中国急救医学,2012, 32 (11) : 1005-8. |
| [9] | Zhang QG, Wang RM, Scott E, et al. Hypersensitivity of the hippocampal CA3 region to stress-induced neurodegeneration and amyloidogenesis in a rat model of surgical menopause[J]. Brain,2013, 136 (Pt 5) : 1432-45. |
| [10] | Rapôso C, Odorissi PA, Oliveira AL, et al. Effect of phoneutria nigriventer venom on the expression of junctional protein and P-gp efflux pump function in the blood-brain barrie[J]. Neurochem Res,2012, 37 (9) : 1967-81. DOI: 10.1007/s11064-012-0817-y. |
| [11] | Michalski D, Grosche J, Pelz J, et al. A novel quantification of blood-brain barrier damage and histochemical typing after embolic stroke in rat[J]. Brain Res,2010, 1359 : 186-200. DOI: 10.1016/j.brainres.2010.08.045. |
| [12] | Michalak Z, Lebrun A, Di Miceli M, et al. IgG leakage May contribute to neuronal dysfunction in drug-refractory epilepsies with blood-brain barrier disruption[J]. J Neuropathol Exp Neurol,2012, 71 (9) : 826-38. DOI: 10.1097/NEN.0b013e31826809a6. |
| [13] | Zechariah A, Elali A, Doeppner TR, et al. Vascular endothelial growth factor promotes pericyte coverage of brain capillaries, improves cerebral blood flow during subsequent focal cerebral ischemi a, and preserves the metabolic penumbra[J]. Stroke,2013, 44 (6) : 1690-7. DOI: 10.1161/STROKEAHA.111.000240. |
 2015, Vol. 35
2015, Vol. 35

