肠出血型大肠埃希菌(Enterohemorrhagic Escherichia coli,EHEC)O157:H7是一种食源性人畜共患肠道病原微生物,可导致食物中毒,引起人和动物严重的腹泻、出血性肠炎(haemorrhagic colitis,HC)、溶血性尿毒综合症(Haemolyticuraemic syndrome,HUS)等[1-3]。其致病作用主要通过产生志贺样毒素和细菌对肠黏膜上皮细胞黏附-抹去损伤(attaching and effacing lesion,A/E损伤)完成[4-5]。在A/E损伤中,效应蛋白EspF 与线粒体和核仁结合、与细胞内SNX9、 N-WASP、Abcf2等蛋白分子结合,导致上皮细胞紧密连接破坏、微绒毛消失、肠上皮细胞骨架重排、肌动蛋白聚集、挚状结构(pedestal)形成,最后细胞凋亡,在A/E损伤中起主要作用[6-7]。效应蛋白EspF是病原菌致病的瑞士军刀,对研究EHEC致病的分子机制举足轻重[8-10]。
核苷酸序列分析表明,espF 的N端1-73aa 相对保守,C端74-248aa 由4 个高度同源的脯氨酸序列PRR组成。本文以EHEC O157:H7 EDL933w 为野生株,利用Red同源重组技术分别构建EHEC O157:H7 espF基因缺失突变株(△espF)、espF 基因N端缺失突变株(△espF/N)、espF基因C端缺失突变株(△espF/C)。基因敲除后要进行基因回补实验,从而通过基因回补后的表型恢复或基因功能恢复来进一步验证该基因的功能[11]。本研究以pBAD33 质粒为载体,建立EHEC基因回补平台,构建相应的espF 基因缺失突变回补株(C-△espF)、espF基因N端缺失突变回补株(C-△espF/N)、 espF 基因C 端缺失突变回补株(C-△espF/C)。通过 RT-PCR实验,证实了espF基因及其N端、C端在相应的回补株中均能成功转录。基因缺失株和回补株的构建为进一步研究EHEC O157:H7 EspF 蛋白不同结构域的功能奠定了基础,有助于深入探讨EspF蛋白导致出血性结肠炎的分子致病机制。
1 材料与方法 1.1 菌株与质粒肠出血型大肠埃希菌O157:H7 美国株EDL 933w(WT)、DH5α pKD46菌株、DH5α pKD4菌株、DH5α菌株由本实验室保存;质粒pBAD33具氯霉素(Cm)抗性,其表达受阿拉伯糖诱导,具有XbaⅠ和Hind Ⅲ限制性酶切位点(ATCC公司)。
1.2 试剂与器材Taq DNA 聚合酶、dNTPs 和DNA 分子量标准(Takara公司);质粒提取试剂盒、PCR 产物(胶)回收试剂盒(Omega公司);限制性内切酶XbaⅠ和Hind Ⅲ、T4 DNA连接酶(Thermo 公司);Primer Extension System和fmol® DNA Cycle Sequencing System(Promega 公司)。电击仪、PCR扩增仪、凝胶成像分析系统。引物合成由上海生工公司完成,基因测序由广州艾基生物技术有限公司完成。
1.3 引物设计与合成根据模板及其上下游的DNA序列,设计含同源臂的引物H1-K1、H2-K2、H3-K3、H4-K4,引物的5'端与欲敲除的目的片段上下游部分序列同源,3'端与卡那霉素抗性基因部分序列同源,在同源臂外设计一对外部鉴定引物F1、R2,在卡那抗性基因内部设计一对内部鉴定引物F2、R1,PKD46鉴定引物46-F、46-R;设计并合成6对引物:E-F、E-R和N-F、C-R,用于扩增espF基因及其N端、C端;33-F、33-R为质粒pBAD33鉴定引物。引物由上海生工公司合成。引物序列见表 1。
| 表 1 本实验所用引物 Table 1 Primers used in this study |
以pKD4质粒为模板,H1-K1、H2-K2为引物,PCR扩增出两端与espF 基因上下游序列同源,中间含有 FRT 结合位点的卡那抗性基因片段,反应条件为:94 ℃ 3 min;94 ℃ 30 s、56 ℃ 30 s、72 ℃ 90 s,35个循环;72 ℃ 10 min。PCR产物切胶回收纯化,溶于纯水待用。
1.5 感受态细胞的制备将转化有pKD46 质粒的EHEC O157:H7 EDL933 w,30 ℃过夜培养。次日1:50扩大培养至D600=0.2~0.3时,加入终浓度为10~30 mmol/L的L-阿拉伯糖,至 D600=0.4~0.6,使pKD46上的重组酶Exo、Bet、Gam充分表达。冰上预冷10 min,4000 r/min,4 ℃,10 min离心,弃培养基;冰预冷的去离子水洗涤1次,冰预冷的10%甘油洗涤2次,每次4000 r/min,4 ℃,15 min,最后加入100 μL冰预冷的10%甘油待用。
1.6 电转化和Red重组系统的表达将冻存的感受态细胞置冰上10 min,100 μL的感受态细胞中加入10 μL的卡那打靶片段胶回收产物,轻微混匀,置冰上15 min,将混合物加入到预冷的电击杯中,于25 μF,200 Ω,3 KV条件下电击;向电击后的菌液中加入1 mL无抗性LB液体培养基,37 ℃,先低速再高速复苏2 h,然后涂布于含有100 μg/mL卡那霉素抗性的LB平板上,37 ℃培养过夜。
1.7 目的片段的扩增采用OL-PCR(over lap PCR),以EHEC O157:H7 EDL933野生株全基因组为模板,引物E-F、E-R和N-F、 C-R分别扩增espF基因及其N端、C端。反应条件为:95 ℃ 5 min;94 ℃ 40 s、56 ℃ 30 s、72 ℃ 50 s,29 个循环;72 ℃ 5 min。产物切胶回收纯化溶于去离子水待用。
1.8 重组质粒的构建分别对目的片段和载体pBAD33 进行XbaⅠ和 Hind Ⅲ双酶切,将目的基因酶切产物和质粒酶切产物按5∶1摩尔比,经T4 DNA连接酶4 ℃连接12 h。连接产物化学转化入E.coli DH5α感受态细胞,涂布于 Cm10 μg/mL、Kana 100 μg/mL抗性的LB平板,37 ℃恒温倒置培养至出现单克隆菌落。
设计并合成质粒pBAD33 的引物:上游引物 pBAD33-F 为5'-ATGCCATAGCATTTTTATCC-3';下游引物pBAD33-R 为5'-GATTTAATCTGTATCAG G-3'。挑选单克隆,以33-F/33-R和E-F/E-R、N-F/33-F、 C-R/E-F为引物对,进行目的基因重组质粒搭桥PCR鉴定。对PCR鉴定阳性的菌株用OMEGA质粒提取试剂盒提取质粒,质粒送公司进行核苷酸测序,测序引物为 pBAD33-F/R。
1.9 大肠杆菌EDL 933w回补株的构建将重组质粒分别转化相应的缺失株△espF、△espF/N和△espF/C感受态细胞,25 μF、200 Ω、3000 V电击。将菌液涂于含有Kana(100 μg/mL)、Cm(10 μg/mL)的 LB固体平板,37 ℃培养过夜。
挑取单克隆,分别以33-F/33-R、E-F/E-R、33-F/ N-F、33-R/C-R为引物进行搭桥PCR鉴定,鉴定阳性的菌株送艾基公司测序,经测序验证成功的菌株即为回补株,分别命名为C-△espF、C-△espF/N和C-△espF/C。
1.10 espF基因回补株在研究基因调控中的作用将C-△espF、C-△espF/N 和C-△espF/C 分别接种至5 mL的Cm 10 μg/mL、Kana 100 μg/mL的LB培养基中,培养至平台期,将2代菌继续培养,至对数生长期时,以1∶1000 倍稀释转至新配的5 mL Cm10 μg/mL、 Kana 100 μg/mL(0.2%阿拉伯糖)的LB 培养基中。37 ℃培养,当其第3 代菌培养至对数生长末期,收集菌体。
用Omega Bacterial RNA kit 提取菌体的总RNA,DNaseⅠdigestion 去除总RNA 中DNA 污染,Prime- ScriptTM Ⅱ 1st Strand cDNA Synthesis Kit将RNA逆转录成cDNA。以cDNA为模板,分别以E-F、E-R和N-F、 C-R 为引物对进行PCR扩增,扩增参数:95 ℃预变性3 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 50 s,共30 个循环;72 ℃ 5 min;4 ℃保存。通过回补株的RT-PCR 结果,判定基因espF 及其N端核苷酸片段espF/N、C端核苷酸片段espF/C 在以pBAD33 质粒为载体的回补株 C-△espF、C-△espF/N和C-△espF/C中是否正常转录。
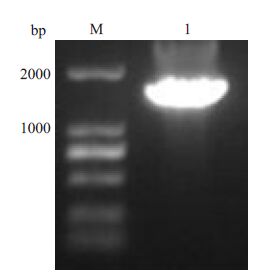
2 结果 2.1 获得卡那抗性打靶片段以pKD4质粒为模板,H1-K1、H2-K2为引物,进行 PCR扩增产物切胶回收,并进行琼脂糖凝胶电泳,获得卡那抗性打靶片段,大小为1577 bp(图 1)。
|
图 1 卡那抗性片段回收后电泳验证 Figure 1 Electrophoresis verification of kana fragment. M: DL2000 marker; 1: Fragment of kana fragment. |
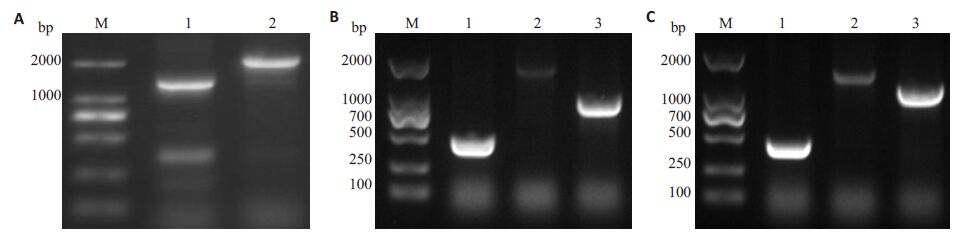
分别以EHEC O157:H7 EDL933w野生株和espF基因缺失突变株的全基因组为模板,用设计的鉴定引物 F1、R2 PCR扩增进行验证(图 2A)。分别以espF基因N端缺失突变株、C端缺失突变株全基因组为模板,以鉴定引物F2/R1、F1/R1、F2/R2 进行搭桥PCR 扩增验证(图 2B、C)。
|
图 2 各菌株的电泳验证 Figure 2 Electrophoresis verification of the constructed strains. A: EHEC O157: H7 EDL933w ΔespF. M: DL2000 marker; 1: Wild-type as template(1289 bp); 2: ΔespF as template(2019 bp); B: EHEC O157: H7 EDL933w ΔespF/N. M: DL2000 marker; 1: Primer pair F2-R1(471 bp); 2: Primer pair F1-R1(2015 bp); 3: Primer pair F2-R2(1002 bp); C: EHEC O157:H7 EDL933w △espF/C. M: DL2000 marker; 1: Primer pair F2-R1(471 bp); 2: Primer pair F1-R1(1487 bp); 3: Primer pair F2-R2(1221 bp) |
目的基因片段大小与理论值一致,以EHEC O157: H7 EDL 933wΔespF、△espF/N和△espF/C菌株全基因组为模板,PCR扩增后产物连同引物一并交与艾基公司测序,结果显示缺失株构建成功。
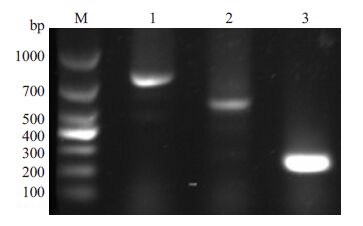
2.3 扩增espF基因及其N端、C端核苷酸片段以EHEC O157:H7 EDL933w全基因组为模板,PCR扩增espF基因及其C端、N端(图 3)。
|
图 3 espF基因及其N端、C端片段扩增 Figure 3 Amplification of espF and its N and C fragment by PCR. M: DL1000 marker; 1:Fragment of espF(779 bp); 2: Fragment of espF/C(561 bp);3: Fragment of espF/N(254 bp). |
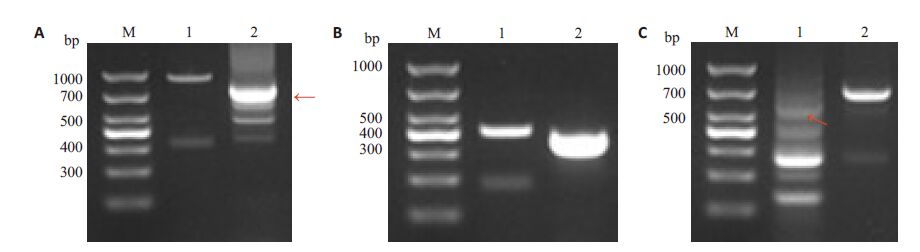
挑取单菌落提质粒作为模板,用质粒引物对33-F/33-R和目的片段引物对E-F/E-R、N-F/33-F、C-R/E-F分别进行搭桥PCR筛选鉴定(图 4A~C)。出现目的条带的菌液质粒送艾基公司测序,使用Bioedit软件进行序列比对,确证质粒重组成功。
|
图 4 重组质粒搭桥PCR鉴定 Figure 4 Screening of recombinant plasmid by cross PCR. A: pBAD33-△ espF M: DL1000 marker; 1: Amplification of fragment using primer 33-F and 33-R(948 bp); 2: Amplification of fragment using primer E-F and E-R(779 bp),as the red arrow showed; B: pBAD33-△espF/N by cross PCR. M: DL1000 marker; 1: Amplification of fragment using primer33-F and 33-R(423 bp); 2: Amplification of fragment using primer 33-F and N-F(373 bp); C: Screening of recombinant plasmid pBAD33-△espF/C by cross PCR. M: DL1000 marker; 1: Amplification of fragment using primer C-R and E-F(557 bp),as the red arrow showed; 2: Amplification of fragment using primer 33-F and 33-R(732 bp) |
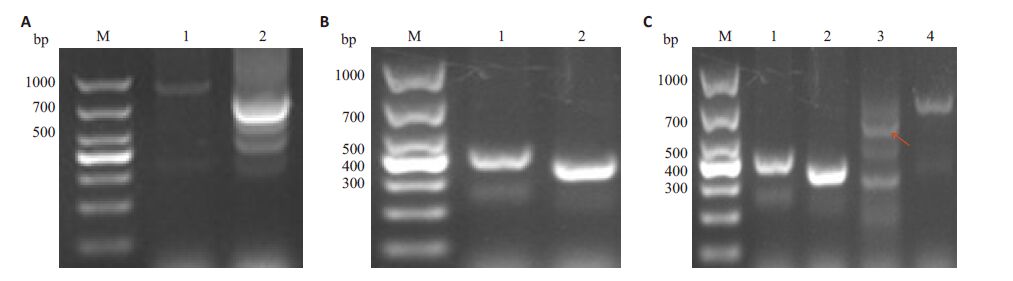
挑取单菌落提质粒作为模板,用质粒引物对33-F/33-R 和目的片段引物对E-F/E-R、33-F/N-F、33-R/C-R分别进行搭桥PCR筛选鉴定(图 5A~C)。
|
图 5 基因缺失回补株鉴定 Figure 5 Screening of complementary strain by cross PCR. A: C-△espF M: DL1000 marker; 1: Amplification of fragment using primer 33-F and 33-R(948 bp); 2: Amplification of fragment using primer E-F and E-R(779 bp); B: C-△espF/N by cross PCR. M: DL1000 marker. 1: Amplification of fragment using primer 33-F and 33-R(423 bp); 2: Amplification of fragment using primer 33-F and N-F(373 bp); C: C-△espF/C by cross PCR. M: DL1000 marker; 3: Amplification of fragment using primer 33-R and C-R(607 bp,red arrow); 4: Amplification of fragment using primer 33-F and 33-R(732 bp). |
出现目的条带的菌液送艾基公司测序,使用 Bioedit软件进行序列比对,确证回补株构建成功,分别命名为C-△espF、C-△espF/N和C-△espF/C。
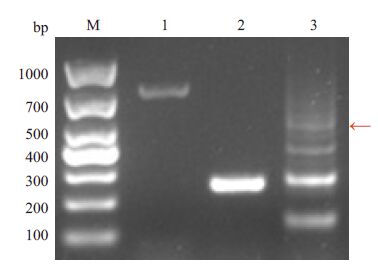
2.6 基因缺失回补株C-△espF、C-△espF/N和C-△espF/C的RT-PCR扩增收集经阿拉伯糖诱导生长至对数期的菌体,提取总RNA 后反转录成cDNA,分别以引物对E-F/E-R、 N-F/E-R、E-F/C-R进行RT-PCR,见图 6。可见espF基因及其N端核苷酸片段espF/N、C端核苷酸片段espF/C在以pBAD33质粒为载体的回补株C-△espF、C-△espF/N和C-△espF/C中均正常转录。
|
图 6 逆转录PCR琼脂糖凝胶电泳 Figure 6 Agarose gel electrophoresis of the RT-PCR products of the target genes. M: DL1000 marker; 1: RT-PCR of C-△ espF(779 bp); 2: RT- PCR of C-△ espF/N(254 bp); 3: RT-PCR of C-△ espF/C (557 bp, arrow). |
1983年,Riley等[12]首次报道肠出血性大肠埃希菌 O157:H7在美国密执安州和俄勒冈州引起严重食源性疾病—出血性结肠炎,引起了广泛关注。此后,由 EHEC O157:H7引起的散发病例和小型暴发在世界范围内不断发生[3, 13-14],对公共卫生和人类健康构成了极大威胁。目前,EHEC O157:H7致病机制研究大多集中在 LEE致病岛上的毒力基因功能研究上。espF基因位于 LEE4,通过TTSS进入宿主细胞[15]。EHEC中,EspF蛋白C端含有4个高度同源的脯氨酸序列PRR,N端为功能区[10, 16-17]。Nagai等[18]通过敲除N端第1-134个氨基酸残基发现了突变株毒性减弱;Marches等[19]证实PRR含有SH3(src homology 3) 结合基序PxxP,能与宿主细胞 SNX9蛋白的SH3结合域特异性结合。本课题组已证实EHEC O157:H7的EspF蛋白N端在细菌感染过程中能与宿主细胞mtHsp70结合,启动线粒体凋亡途径,从而诱发细胞凋亡。那么,EspF蛋白的C端在细菌引起的细胞凋亡中扮演着怎样的角色呢?EspF蛋白又是如何调控其他蛋白从而发挥致病作用呢?
在此基础上,本研究选择EDL 933w为野生株,利用Red同源重组系统,成功构建了△espF、△espF/N和△espF/C基因突变株。Red同源重组技术直接在细菌染色体上对DNA进行直接修饰,实现精准、快速的基因敲除[20]。利用线性打靶DNA,两侧同源臂长度在35~60 bp,在重组酶的作用下,高效的诱导线性打靶DNA与靶基因进行同源重组[21]。同源臂容易合成,只需要一次同源重组即可实现基因敲除,因此大大地提高了可行性,得到了广泛应用。
缺失株构建成功后,我们构建了相应的回补株,期望在后续实验中通过基因回补后的表型恢复或基因功能恢复来进一步验证espF基因的功能。载体的正确选择是回补株构建的关键所在,而回补载体得以成功重组主要在于目的基因和质粒的最佳摩尔比。本研究通过设置梯度摩尔比进行实验,发现目的基因和质粒的摩尔比为5∶1时,重组质粒连接成功的效率最高,最佳摩尔比的得出使基因回补实验平台更加稳定高效。由于 pBAD33载体上含有阿拉伯糖操纵子的pBAD启动子及双向调控子araC基因,它可以受阿拉伯糖诱导。阿拉伯糖存在时可以诱导pBAD启动子发生转录;阿拉伯糖不存在时pBAD启动子发生很低水平的转录;而在葡萄糖存在时pBAD启动子转录被抑制[11]。本实验在设计引物时,N端和C端核苷酸片段分别添加了起始密码子、终止密码子和SD序列,从而实现阿拉伯糖诱导后核苷酸的正确转录,回补株中espF基因及其N端和C端核苷酸片段都得以理想表达。该回补系统通过诱导条件的可控,从而实现诱导的可控,以阿拉伯糖的加入量来控制靶基因的表达量,实现对表达的控制,使基因功能的研究更具针对性;最佳摩尔比的探索不仅提高了回补载体正确重构的效率,也使得该回补平台更加高效快捷。
本研究成功构建了EHEC O157:H7 EDL933w espF基因缺失株,搭建了EHEC 基因回补实验平台,目前本实验室拥有野生株,缺失株△espF、△espF/N、△espF/C 和回补株C-△espF、C-△espF/N、C-△espF/C共七株EDL933w基因突变菌株,为下一步揭示EspF蛋白不同结构域功能、EspF蛋白对其他蛋白的表达和分泌的调控机制以及EspF蛋白导致出血性结肠炎的分子机制奠定了坚实的基础。
| [1] | Zhao S, Zhou Y, Wang C, et al. The N-Terminal Domain of EspF Induces Host Cell Apoptosis after Infection with Entero- haemorrhagic Escherichia coli O157:H7[J]. PLoS ONE,2013, 8 (1) : e55164. DOI: 10.1371/journal.pone.0055164. |
| [2] | Kaper JB, Nataro JP, Mobley HL. Pathogenic Escherichia coli[J].2004, 2(2): 123-40. |
| [3] | Rangel JM, Sparling PH, Crowe C, et al. Epidemiology of Escherichia coli O157:H7 outbreaks, United States, 1982-2002[J]. Emerg Infect Dis,2005, 11 (4) : 603-9. DOI: 10.3201/eid1104.040739. |
| [4] | Garmendia J, Frankel G, Crepin VF. Enteropathogenic and enterohemorrhagic Escherichia coli infections: translocation, tran- slocation, translocation[J]. Infect Immun,2005, 73 (5) : 2573-85. DOI: 10.1128/IAI.73.5.2573-2585.2005. |
| [5] | Dean P, Kenny B. The effector repertoire of enteropathogenic E. coli: ganging up on the host cel[J]. Curr Opin Microbiol,2009, 12 (1) : 101-9. DOI: 10.1016/j.mib.2008.11.006. |
| [6] | Weflen AW, Alto NM, Viswanathan VK, et al. E. coli secreted protein F promotes EPEC invasion of intestinal epithelial cells via an SNX9-dependent mechanism[J]. Cell Microbiol,2010, 12 (7) : 919-29. DOI: 10.1111/cmi.2010.12.issue-7. |
| [7] | Nougayrede JP, Foster GH, Donnenberg MS. Enteropathogenic Escherichia coli effector EspF interacts with host protein Abcf2[J]. Cell Microbiol,2007, 9 (3) : 680-93. DOI: 10.1111/cmi.2007.9.issue-3. |
| [8] | Holmes A, Muhlen S, Roe AJ, et al. The EspF Effector, a Bacterial Pathogen's Swiss Army Knife[J]. Infection and Immunity,2010, 78 (11) : 4445-53. DOI: 10.1128/IAI.00635-10. |
| [9] | Kenny B, Valdivia R. Host-microbe interactions: bacteria[J]. Curr Opin Microbiol,2009, 12 (1) : 1-3. DOI: 10.1016/j.mib.2009.01.002. |
| [10] | Aitio O, Hellman M, Skehan B, et al. Enterohaemorrhagic Escherichia coli exploits a tryptophan switch to hijack host f-actin assembly[J]. Structure,2012, 20 (10) : 1692-703. DOI: 10.1016/j.str.2012.07.015. |
| [11] | 陈振鸿, 王丽, 张义全, 等. 副溶血弧菌基因回补实验方法的建立与应用[J]. 南方医科大学学报,2014 (01) : 70-4. |
| [12] | Riley LW, Remis RS, Helgerson SD, et al. Hemorrhagic Colitis Associated with a Rare Escherichia coli Serotype[J]. New England Journal of Medicine,1983, 308 (12) : 681-5. DOI: 10.1056/NEJM198303243081203. |
| [13] | 王燕, 谢贵林, 杜琳. 大肠杆菌O157:H7感染流行概况[J]. 微生物学免疫学进展,2008, 36 (1) : 51-8. |
| [14] | Mellmann A, Harmsen D, Cummings CA, et al. Prospective genomic characterization of the German enterohemorrhagic Escherichia coli O104:H4 outbreak by rapid next generation sequencing technology[J]. PLoS One,2011, 6 (7) : e22751. DOI: 10.1371/journal.pone.0022751. |
| [15] | Lodato PB, Kaper JB. Post-transcriptional processing of the LEE4 operon in enterohaemorrhagic Escherichia coli[J]. Mol Microbiol,2009, 71 (2) : 273-90. DOI: 10.1111/mmi.2009.71.issue-2. |
| [16] | Alto NM, Weflen AW, Rardin MJ, et al. The type III effector EspF coordinates membrane trafficking by the spatiotemporal activation of two eukaryotic signaling pathways[J]. J Cell Biol,2007, 178 (7) : 1265-78. DOI: 10.1083/jcb.200705021. |
| [17] | Mayer BJ. SH3 domains: complexity in moderation[J]. J Cell Sci,2001, 114 (Pt 7) : 1253-63.. |
| [18] | Nagai T, Abe A, Sasakawa C. Targeting of enteropathogenic Escherichia coli EspF to host mitochondria is essential for bacterial pathogenesis: critical role of the 16th leucine residue in EspF[J]. J Biol Chem,2005, 280 (4) : 2998-3011. DOI: 10.1074/jbc.M411550200. |
| [19] | Munera D, Crepin VF, Marches O, et al. N-terminal type III secretion signal of enteropathogenic Escherichia coli translocator protein[J]. J Bacteriol,2010, 192 (13) : 3534-9. DOI: 10.1128/JB.00046-10. |
| [20] | 姜娜, 王艳春, 马志宏, 等. 一种基于温敏质粒的新型基因敲除方法[J]. 中国生物工程杂志,2010 (03) : 85-9. |
| [21] | 韩朋, 孙琦, 赵素慧, 等. 肠出血型大肠埃希菌O157:H7 ppk基因缺失株的构建及其生物学特性分析[J]. 南方医科大学学报,2014 (06) : 904-8. |
 2015, Vol. 35
2015, Vol. 35

