2. 南方医科大学南方医院 感染内科,广东 广州 510515
2. Department of Infectious Disease,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China
高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)是一类真核细胞细胞核内含量丰富的非组蛋白染色体结合蛋白。HMGB1参与核小体结构的构建和稳定,调节基因的转录,参与细胞的增殖[1],分泌于细胞外的HMGB1能够与细胞表面晚期糖基化终末产物受体(RAGE)结合,在调节细胞分化,增殖,炎症,迁移和生存等细胞生命活动中起重要作用[2]。有报道在多种肿瘤组织中有HMGB1 的高表达,提示 HMGB1可能参与肿瘤的发生发展[3-5]。
鼻咽癌的治疗以放射治疗为主[6],其治疗失败的主要原因为局部复发和远处转移[7]。我们课题组前期针对HMGB1在鼻咽癌中的表达进行了研究[8],但是其在鼻咽癌细胞株C666-1中的作用尚未见文献报导。本文拟观察HMGB1对人鼻咽癌细胞株C666-1增殖的影响并探讨其可能的机制。
1 资料和方法 1.1 材料C666-1 人鼻咽癌细胞株来源于南方医科大学肿瘤研究所,胎牛血清购自BD公司;PRMI 1640培养基、 PBS、OPTI-MEN购自GIBCO公司;胰蛋白酶消化液购自吉诺公司;瞬时转染试剂Lipofectamine RNAiMAX购自Life Technologies 公司;RIPA蛋白裂解液购自罗氏公司;Western blot 电泳系统为Bio-Rad 公司产品; PVDF膜购自Bio-Rad 公司;BCA蛋白浓度测定试剂盒、蛋白Marker购自Thermo Fisher Scientific公司;脱脂奶粉购自广州威佳科技有限公司;牛血清白蛋白购自广州斯佳科技有限公司;Cyclin D1单克隆鼠抗体购自 Santa Cruz公司,β-actin兔单克隆抗体购自Bioword公司;羊抗兔、抗鼠二抗购自Abcam 公司;发光液购自 Bio-Rad公司;显影液、定影液购自天津市世纪奥博商贸有限公司;发光胶片购自Carestream公司;细胞周期检测试剂盒购自碧云天公司;Cell Counting Kit-8(CCK-8)细胞增殖-毒性检测试剂盒购自DOJINDO公司;EDU检测试剂盒购自吉凯公司;siHMGB1,siNC由上海吉玛公司合成;siHMGB1 RNA Oligo:正义链5'-3'CCCGUUAUGAAAGAGAAAUTT和反义链5'- 3'AUUUCUCUUUCAUAACGGGTT;siNC RNA Oligo:正义链5'-3'UUCUCCGAACGUGUCACGUTT和反义链5'-3'ACGUGACACGUUCGGAGAATT。
1.2 方法 1.2.1 细胞培养人鼻咽癌细胞株C666-1采用含10%胎牛血清的PRMI 1640培养基培养,置于37 ℃,5% CO2培养箱内培养,并于倒置显微镜下观察细胞生长状态,每1~2 d适时更换培养基,细胞长到80%左右用胰酶消化传代。取生长状态良好的细胞用于实验。
1.2.2 siRNA瞬时转染取生长状态良好的细胞,前1 d晚上铺6孔板,每个6孔板细胞密度约为30%~40%,确保细胞均匀铺于板底。第2天早上待细胞贴壁后不久即进行siRNA转染,每孔先将5 μLsiRNA和5 μL iMAX分别稀释于250 μL Opti-MEN中,置于冰盒孵育5 min,然后将二者混匀,静置20 min,加至残留有1.5 mL培养基的6孔板中。放入培养箱中培养用于后续的实验。
1.2.3 质粒瞬时转染取生长状态良好的细胞,前1 d晚上铺6孔板,每个6孔板细胞密度约为70%~80%,确保细胞均匀铺于板底。第2 天早上待细胞贴壁后不久即进行质粒转染,将5 μg 质粒和10 μL P3000 稀释于125 μL Opti-MEN中,另将3.75 μL lipo-3000也稀释于125 μL Opti-MEN中,然后将二者混匀,室温静置5 min,加至残留有2.25 mL培养基的6孔板中。放入培养箱中培养,5 h后换液,用于后续的实验。
1.2.4 Cell Counting Kit-8(CCK-8)试验取瞬时转染12 h之后的细胞铺96孔板,细胞重悬成单细胞悬液,每孔1×103个细胞,100 μL培基,每组3个复孔,由于孔板周边孔液体容易蒸发,故96孔板边上一圈的孔不铺细胞,只加PBS或者培基,培基用于调零。细胞置于37 ℃,5% CO2培养箱内培养。12 h之后第1次检测,每孔加入10 μL的CCK-8溶液(注意不要在孔中生成气泡,它们会影响A值的读数)。将培养板在培养箱内孵育2 h后用酶标仪测定在450 nm处的吸光度。24 h之后第2次检测,以后每隔1 d的同时间点进行检测。
1.2.5 细胞周期检测细胞瞬时转染之后72 h,待细胞长至80%~90%面积,弃培基,PBS洗2遍,胰酶消化,收集细胞沉淀,PBS 洗2 遍,弃PBS,用预冷的75%酒精固定细胞(把细胞缓慢加入酒精中,一边加,一边摇匀,防止产生絮状物),放入-20 ℃保存,至少固定8 h 以上。上机前准备:取固定好的细胞,离心弃上清,PBS洗2遍,加入300~400 μL PBS重悬,吹散成单细胞悬液,加入5 μL的RNase,放置15 min之后加入5 μL浓度为10 pmol/L的PI。避光染色5 min后,流式细胞仪上机检测。重复3次。
1.2.6 EDU取瞬时转染24 h 之后的细胞铺96 孔板,细胞重悬成单细胞悬液,每孔5×103个细胞,100 μL培基,每组3个复孔,细胞置于37 ℃,5% CO2培养箱内培养。12 h 之后EDU 检测。细胞加入1000∶1 稀释的 EDU溶液培养2 h,弃培基,PBS洗2遍,每遍5 min,每孔加50 μL 固定液室温孵育30 min,弃固定液后每孔加50 μL 2 mg/mL甘氨酸,弃甘氨酸溶液,PBS清洗1遍,每孔100 μL渗透剂脱色摇床孵育10 min,PBS洗1遍。每孔加50 μLAPOLLO染色液,避光室温脱色摇床孵育30 min,再加入100 μL渗透剂,脱色摇床清洗2~3遍,每遍10 min,弃渗透剂,每孔100 μL甲醇清洗1~2次,PBS清洗1次,最后核染拍照。
1.2.7 Western blot取瞬时转染48 h之后的细胞,弃培养基,PBS洗3遍后吸干,加入配置好的RIPA细胞裂解液充分裂解(1×RIPA∶100×CK∶100×磷酸酶抑制剂=100∶1∶1)。将裂解液吸入标记好的EP管中,漩涡振荡器上每隔10 min震荡1次,每次15 s,共3次。12 000 g,4 ℃离心30 min,将上清转移至一新的EP管中(注意不要吸到沉淀物)。用BCA蛋白定量试剂盒测定蛋白浓度:取一块96孔板,根据样品的数量,按50体积BCA试剂A加1体积BCA试剂B(200∶4),配制适量BCA工作液,摇床上充分混匀;各孔加入200 μL的BCA工作液,18 μL ddH2O,2 μL蛋白样品(标准品按照说明书加样);37 ℃放置30 min后,在562 nm波长下比色测定,以蛋白含量(μg)为纵坐标,吸光值(A)为横坐标,绘出标准曲线。根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品总体积(2 μL),即为样品实际浓度(单位μg/μL)。按照蛋白样品的浓度计算出30 μg样品的上样体积,用裂解液将样品体积配齐,按照蛋白样品与5×SDS loading buffer体积比为4∶1制备上样缓冲液,95 ℃水浴锅煮10 min。配置10%的聚丙烯酰胺凝胶,80 V,30 min;100 V,90 min电泳。250 MA,120 min转膜。5%脱脂奶粉封闭60 min,加入一抗4 ℃孵育过夜。TBST洗10 min×3次,加入适当比例稀释的二抗,室温孵育60 min,TBST洗10 min×3,暗室内曝光,洗片。
1.3 统计分析所有计量数据均采用均数±标准差表示,采用 SPSS16.0 统计软件进行分析,样本均数的比较采用 Student's t检验进行统计,以P<0.05为差异具有统计学意义。
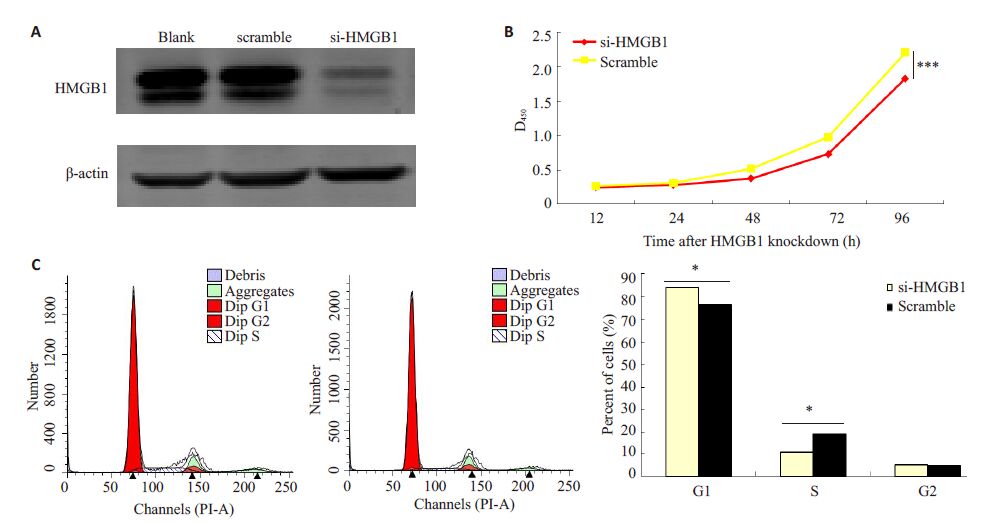
2 结果 2.1 干扰HMGB1后抑制鼻咽癌细胞株C666-1的增殖C666-1 细胞转染si-HMGB1 和阴性对照后,Western blot 验证其干扰效率,结果显示与对照组相比,HMGB1的表达水平下调(图 1A)。瞬时干扰C666-1细胞 HMGB1 基因,行CCK-8 和细胞周期实验检测干扰 HMGB1 后细胞增殖和周期的变化,结果显示干扰 HMGB1后,细胞增殖能力减弱(P<0.001),处于G1期细胞比例增多(P<0.001),S期细胞比例下降(P<0.001,图 1B,C)。表明HMGB1能够促进鼻咽癌细胞株C666-1的增殖。
|
图 1 干扰HMGB1后抑制鼻咽癌细胞株C666-1的增殖 Figure 1 Proliferation of C666-1 cells was inhibited after HMGB1 knockdown. A: Western blot analysis of the interference efficiency; B: CCK-8 analysis; C: Cell cycle analysis. ***P<0.001 vs nc. |
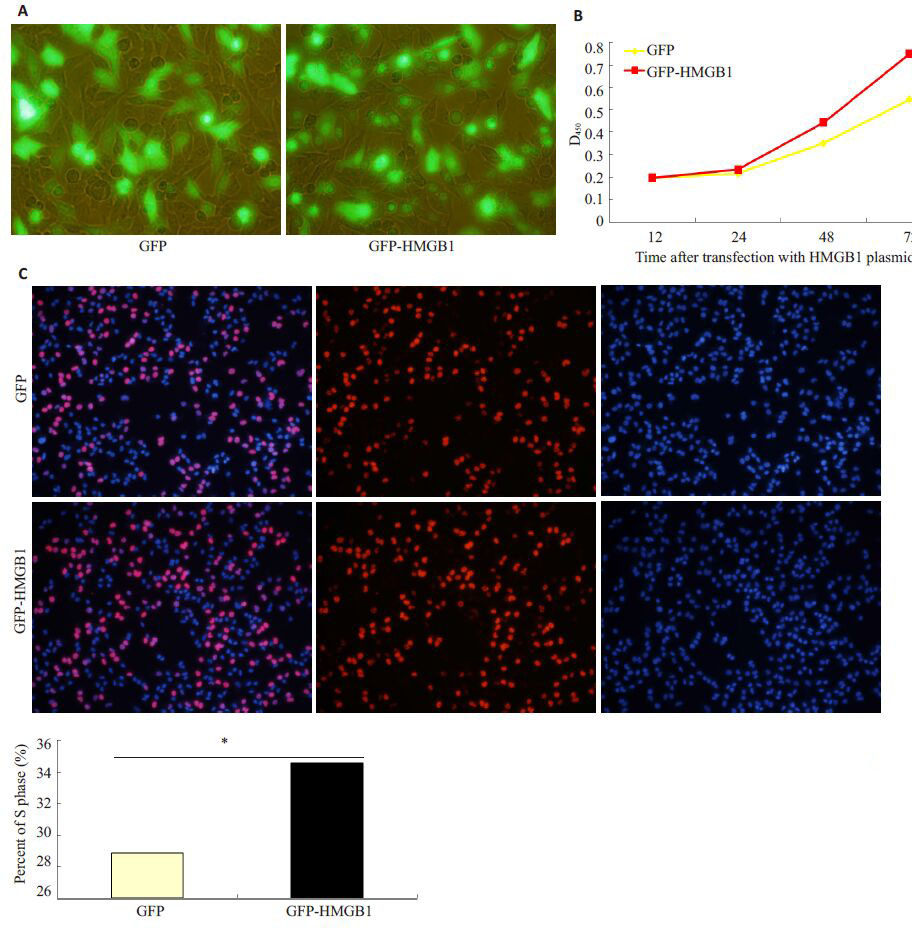
C666-1细胞转染带GFP的HMGB1质粒和空GFP质粒后,荧光显微镜观察其转染效率,结果显示质粒转染效率约60%~70%,并主要在核内表达(图 2A)。瞬时过表达HMGB1,行CCK-8 和EDU 实验检测过表达 HMGB1后细胞增殖的变化,结果显示过表达HMGB1后,细胞增殖能力增强(P<0.001),处于S期细胞比例增多(P<0.05,图 2B,C)。表明HMGB1 能够促进鼻咽癌细胞株C666-1的增殖。
|
图 2 过表达HMGB1后促进鼻咽癌细胞株C666-1的增殖 Figure 2 Proliferation of C666-1 cells after trasnfection with the HMGB1 plasmid. A: Transfection efficiency observed by fluorescence microscopy; B: CCK-8 analysis; C: EDU analysis. *P<0.05,***P<0.001 vs nc. |
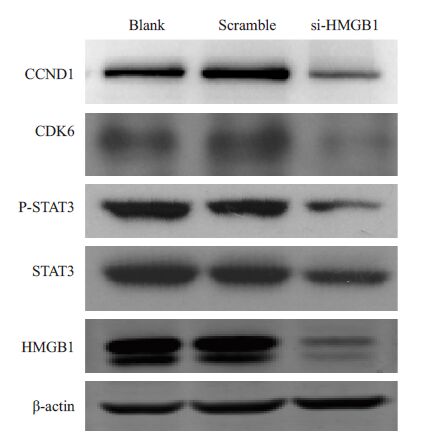
在C666-1细胞中转染si-HMGB1和阴性对照,验证其干扰效率后,取瞬时干扰HMGB1的C666-1细胞行Western blot检测周期相关蛋白及相关通路蛋白表达的变化,结果显示下调HMGB1 后STAT3,P-STAT3,cyclin D1和CDK6的表达也下调(图 3),表明HMGB1可能通过STAT3通路促进cyclin D1和CDK6的表达。
|
图 3 HMGB1促进鼻咽癌C666-1细胞STAT3,PSTAT3,cyclin D1和CDK6的表达 Figure 3 HMGB1 promotes the expressions of STAT3,P-STAT3,cyclin D1 and CDK6 in C666-1 cells analyzed by Western blotting. |
HMGB1作为一种非组蛋白染色质结合蛋白,能够调节基因的转录,参与炎症,增殖等,在多种肿瘤中,如骨肉瘤,结肠癌,肝癌,胃癌,胶质瘤,喉癌中高表达,提示HMGB1 参与肿瘤的发生发展[9-13]。此外,高表达 HMGB1的肿瘤细胞或者坏死的肿瘤细胞释放HMGB1到细胞外,激活的免疫细胞也可以主动分泌HMGB1[14],通过与RAGE结合,促进周围的肿瘤细胞增殖,从而使肿瘤不断长大[15]。在结肠癌,肝癌,胸腺癌及食道癌中观察到HMGB1 和RAGE的高表达[16-17]。提示细胞内 HMGB1 和分泌到细胞外的HMGB1 及其相关信号通路在肿瘤的发展中起着重要作用。分泌型HMGB1还可以刺激其他细胞产生相应的复杂的生物学效应,调节细胞分化,生长,成熟,调节炎症,神经生长,血管生成等。HMGB1 调节肿瘤的相关信号通路有JAK/STAT通路[18],肿瘤中STAT3的过度活化,可以抑制肿瘤细胞凋亡及促进细胞周期进程[19-20]。HMGB1与RAGE结合后,可以激活ERK1/2,NF-kB,JNK,Rac 等通路,通过 ERK1/2-Cyclin D1,NF-kB/Cyclin D1 等促进肿瘤增殖[21-22]。此外,HMGB1 也可以和Toll 样受体TLR2 和 TLR4结合,诱导相应细胞的活化,最终活化NF-kB,从而促进肿瘤增殖和转移[23-25]。在很多文献中有报道,干扰肿瘤细胞HMGB1可以通过下调Cyclin D1介导肿瘤细胞G1/S期阻滞,从而抑制细胞增殖[26-31]。
鼻咽癌是一种多基因遗传性疾病,其发病与遗传因素,EB病毒感染,环境因素,饮食文化等多种因素相关,好发于我国广东,广西,湖南,福建等地区。鼻咽癌由于部位隐蔽,不易于早期诊断,且易于复发和转移,尽管有关其发病机制的研究很多,对其分子机制也进行了深入探索,但是目前临床上整体治疗效果仍不理想。寻找早期诊断的分子标志,治疗靶标及预后监测因子,对鼻咽癌的治疗起着至关重要的作用。
我们在鼻咽癌细胞株C666-1中干扰HMGB1基因后,通过细胞周期和CCK-8实验发现,相对于对照组,细胞S期比例下降,增殖能力减弱,说明HMGB1能促进鼻咽癌细胞株C666-1 的增殖。western blot 检测发现下调HMGB1,能减弱cyclin D1和CDK6的表达,说明HMGB1可能通过促进cyclin D1和CDK6表达促进细胞由G1期进入S期,从而促进鼻咽癌细胞C666-1的增殖。这也提示HMGB1可能是鼻咽癌发生发展中一个重要的促癌因素,并有可能为鼻咽癌诊断和治疗提供新的方向。
| [1] | 曹清心, 刘宇, 凌昌全. HMGB1 与肿瘤相关性的研究进展[J]. 临床肿瘤学杂志,2012, 17 (3) : 282-5. |
| [2] | Huebener P, Pradere JP, Hernandez C, et al. The HMGB1/RAGE axis triggers neutrophil-mediated injury amplification following necrosi[J]. J Clin Invest,2015, 125 (2) : 539-50. DOI: 10.1172/JCI76887. |
| [3] | Zhao CB, Bao JM, Lu YJ, et al. Co-expression of RAGE and HMGB1 is associated with cancer progression and poor patient outcome of prostate cancer[J]. Am J Cancer Res,2014, 4 (4) : 369-77. |
| [4] | Yang GL, Zhang LH, Bo JJ, et al. Increased expression of HMGB1 is associated with poor prognosis in human bladder cancer[J]. J Surg Oncol,2012, 106 (1) : 57-61. DOI: 10.1002/jso.v106.1. |
| [5] | Kostova N, Zlateva S, Ugrinova I, et al. The expression of HMGB1 protein and its receptor RAGE in human malignant tumors[J]. Mol Cell Biochem,2010, 337 (1/2) : 251-8. |
| [6] | Haberer-Guillerm S, Touboul E, Huguet F. Intensity modulated radiation therapy in nasopharyngeal carcinoma[J]. Eur Ann Otorhinolaryngol Head Neck Dis,2015, 132 (3) : 147-51. DOI: 10.1016/j.anorl.2014.02.008. |
| [7] | Ho FC, Tham IW, Earnest A, et al. Patterns of regional lymph node metastasis of nasopharyngeal carcinoma: a meta-analysis of clinical evidence[J]. BMC Cancer,2012, 12 (1) : 98. DOI: 10.1186/1471-2407-12-98. |
| [8] | Wu D, Ding Y, Wang S, et al. Increased expression of high mobility group box 1 (HMGB1) is associated with progression and poor prognosis in human nasopharyngeal carcinoma[J]. J Pathol,2008, 216 (2) : 167-75. DOI: 10.1002/path.v216:2. |
| [9] | Zhang J, Liu C, Hou R. Knockdown of HMGB1 improves apoptosis and suppresses proliferation and invasion of glioma cells[J]. Chi J Cancer Res,2014, 26 (6) : 658-68. |
| [10] | Zhang CC, Gdynia G, Ehemann V, et al. The HMGB1 protein sensitizes colon carcinoma cells to cell death triggered by proapoptotic agents[J]. Int J Oncol,2015, 46 (2) : 667-76. |
| [11] | Qiu G, Li Y, Liu Z, et al. Clinical value of serum HMGB1 in diagnosis and prognosis of laryngeal squamous cell carcinoma[J]. Med Oncol,2014, 31 (12) : 316. DOI: 10.1007/s12032-014-0316-x. |
| [12] | Ueda M, Takahashi Y, Shinden Y, et al. Prognostic significance of high mobility group box 1 (HMGB1) expression in patients with colorectal cancer[J]. Anticancer Res,2014, 34 (10) : 5357-62. |
| [13] | Meng Q, Zhao J, Liu H, et al. HMGB1 promotes cellularproliferation and invasion, suppresses cellular apoptosis in osteosarcoma[J]. Tumour Biol,2014, 35 (12) : 12265-74. DOI: 10.1007/s13277-014-2535-3. |
| [14] | Palmblad K, Schierbeck H, Sundberg E, et al. High systemic levels of the cytokine-inducing HMGB1 isoform secreted in severe macrophage activation syndrome[J]. Mol Med,2014, 20 : 538-47. |
| [15] | Bassi R, Giussani P, Anelli V, et al. HMGB1 as an autocrine stimulus in human T98G glioblastoma cells: role in cell growth and migration[J]. J Neurooncol,2008, 87 (1) : 23-33. DOI: 10.1007/s11060-007-9488-y. |
| [16] | Moser B, Janik S, Schiefer AI, et al. Expression of RAGE and HMGB1 in thymic epithelial tumors, thymic hyperplasia and regular thymic morphology[J]. PLoS One,2014, 9 (4) : e94118. DOI: 10.1371/journal.pone.0094118. |
| [17] | Chen RC, Yi PP, Zhou RR, et al. The role of HMGB1-RAGE axis in migration and invasion of hepatocellular carcinoma cell lines[J]. Mol Cell Biochem,2014, 390 (1/2) : 271-80. |
| [18] | Liu H, Yao YM, Yu Y, et al. Role of Janus kinase/signal transducer and activator of transcription pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages[J]. Sho ck,2007, 27 (1) : 55-60. DOI: 10.1097/01.shk.0000233197.40989.31. |
| [19] | Wagner KU, Schmidt JW. The two faces of Janus kinases and their respective STATs in mammary gland development and cancer[J]. J Carcinog,2011, 10 (32) : 50-8. |
| [20] | Slattery ML, Lundgreen A, Kadlubar SA, et al. JAK/STAT/SOCS- signaling pathway and colon and rectal cancer [J/OL]. Mol Carcinog, 2013, 52(2): 155-66. |
| [21] | Pusterla T, Nemeth J, Stein I, et al. Receptor for advanced glycation endproducts (RAGE) is a key regulator of oval cell activation and Inflammation-Associated liver carcinogenesis in mice[J]. Hepato- logy,2013, 58 (1) : 363-73. |
| [22] | Feng XJ, Liu SX, Wu C, et al. The PTEN/PI3K/Akt signaling pathway mediates HMGB1-induced cell proliferation by regulating the NF-κB/cyclin D1 pathway in mouse mesangial cells[J]. Am J Physiol Cell Physiol,2014, 306 (12) : C1119-28. DOI: 10.1152/ajpcell.00385.2013. |
| [23] | Xu X, Zhu H, Wang T, et al. Exogenous high-mobility group box 1 inhibits apoptosis and promotes the proliferation of lewis cells via RAGE/TLR4-dependent signal pathways[J]. Scan d J Immunol,2014, 79 (6) : 386-94. DOI: 10.1111/sji.2014.79.issue-6. |
| [24] | Agalave NM, Larsson M, Abdelmoaty S, et al. Spinal HMGB1 induces TLR4-mediated long-lasting hypersensitivity and glial activation and regulates pain-like behavior in experimental arthritis[J]. Pain,2014, 155 (9) : 1802-13. DOI: 10.1016/j.pain.2014.06.007. |
| [25] | Conti L, Lanzardo S, Arigoni M, et al. The noninflammatory role of high mobility group box 1/Toll-like receptor 2 axis in the self- renewal of mammary cancer stem cells[J]. FASEB J,2013, 27 (12) : 4731-44. DOI: 10.1096/fj.13-230201. |
| [26] | Ko YB, Kim BR, Nam SL, et al. High-mobility group box 1 (HMGB1) protein regulates tumor-associated cell migration through the interaction with BTB domain[J]. Cell Signal,2014, 26 (4) : 777-83. DOI: 10.1016/j.cellsig.2013.12.018. |
| [27] | Chen J, Xi B, Zhao Y, et al. High-mobility group protein B1 (HMGB1) is a novel biomarker for human ovarian cancer[J]. Gynecol Oncol,2012, 126 (1) : 109-17. DOI: 10.1016/j.ygyno.2012.03.051. |
| [28] | Chen J, Liu X, Zhang J, et al. Targeting HMGB1 inhibits ovarian cancer growth and metastasis by lentivirus-mediated RNA interference[J]. J Cell Physiol,2012, 227 (11) : 3629-38. DOI: 10.1002/jcp.v227.11. |
| [29] | Feng X, Hao J, Liu Q, et al. HMGB1 mediates IFN-γ-induced cell proliferation in MMC cells through regulation of cyclin D1/CDK4/ p16 pathway[J]. J Cell Biochem,2012, 113 (6) : 2009-19. DOI: 10.1002/jcb.v113.6. |
| [30] | Song B, Song WG, Li ZJ, et al. Effect of HMGB1 silencing on cell proliferation, invasion and apoptosis of MGC-803 gastric cancer cell[J]. Cell Biochem Funct,2012, 30 (1) : 11-7. DOI: 10.1002/cbf.v30.1. |
| [31] | Ke S, Zhou F, Yang H, et al. Downregulation of high mobility group box 1 modulates telomere homeostasis and increases the radiosensitivity of human breast cancer cell[J]. Int J Oncol,2015, 46 (3) : 1051-8. |
 2015, Vol. 35
2015, Vol. 35

