2. 安徽省活性生物大分子重点实验室,安徽 芜湖 241002
2. Anhui Provincial Key Laboratory of Active Biological Macro-molecules,Wuhu 241002,China
炎症是活体组织受到外界有害物质刺激时所产生的防御反应。其潜在机制可能与单核巨噬细胞活化有关。脂多糖(LPS)是革兰氏阴性菌细胞壁的主要成分,被认为是诱导炎症反应的典型刺激物,在炎症反应中发挥重要的生物学作用。机体感染时脂多糖释放入血,通过与其受体结合激活胞内多条信号途径如NF-кB,JAK-STATs,MAPKs等调节机体的炎症反应和免疫反应[1],诱发单核巨噬细胞产生和释放大量炎症因子和炎症介质,如TNF-α,IL-6,NO,PGE2等[2-5]。
高迁移率族蛋白1(HMGB1,NP_002119)作为一个核蛋白,在维持核小体结构、染色质重塑、基因转录调节过程中发挥重要作用[6]。大量的实验数据和临床研究表明,胞外的HMGB1是许多炎症性疾病如脓毒症发生的主要致病因素[7-8]。JAK/STATs信号级联是介导炎症和免疫反应的重要信号途径。近期研究表明,JAK/STAT1信号通路通过诱导HMGB1核定位序列中Lys的乙酰化,调控脂多糖和IFN-β诱发的HMGB1 主动释放[9]。该研究结果意味着,JAK-STAT1信号通路可以作为药物抑制HMGB1释放的潜在靶点。
一旦释放到细胞外环境,HMGB1可作为1个潜在晚期促炎细胞因子,通过激活一系列胞内信号途径如:MAPKs,诱发促炎细胞因子和炎症介质释放,对机体造成“二次炎症”打击[10]。近年来的研究亦表明,HMGB1在脓毒症的发生和发展过程中发挥着关键性作用[8]。目前,许多脓毒症的治疗策略主要靶向“早期炎症介质”如TNF-α,IL-1 等,而对晚期炎症因子的关注却较少。因此,抑制HMGB1的释放和(或)阻止HMGB1的促炎活性可能成为帮助脓毒症患者获得更好治疗效果的更有效可行的手段。
瑞香素是从瑞香属植物长白瑞香中提取出来的有效成分,又名祖师麻甲素,其药理作用极为广泛,具有抗炎、抗氧化、神经保护等作用[11-13]。目前有关瑞香素的抗炎机制主要集中在其对早期炎症因子的影响,但是瑞香素能否调控晚期炎症因子HMGB1 的释放并进而抑制HMGB1 诱发的“二次炎症”打击尚未见文献报道。
在本研究中,我们采用RAW264.7 细胞为研究对象,探究瑞香素对脂多糖诱导HMGB1 释放的抑制作用,并探讨潜在作用机制。以THP-1 细胞为研究对象,检测瑞香素对rhHMGB1诱发炎症反应的影响,并试图探究其作用机制。我们的研究结果表明,瑞香素抑制脂多糖诱发的HMGB1 释放,可能与减弱JAK-STAT1 信号途径的激活有关。瑞香素也能够抑制rhHMGB1诱导的炎症因子和炎症介质的释放。本研究为瑞香素的抗炎作用机制提供了新的理论±据和见解。
1 材料和方法 1.1 试剂和抗体瑞香素(纯度>98%)为Sigma产品,rhHMGB1购于R&D(美国)。COX-2、iNOS、JNK、p-JNK、p38、p-p38,ERK、p-ERK,STAT1、p-STAT1、JAK1、p-JAK1、JAK2、p-JAK2 单克隆抗体以及GAPDH多克隆均为CST 产品。IL-6、TNF-α ELISA 试剂盒为RayBiotech 产品,PGE2、HMGB1均购于武汉华美生物试剂公司,NO检测试剂盒为南京建成生物工程研究所产品。
1.2 细胞培养RAW264.7鼠巨噬细胞株和THP-1(人急性单核淋巴细胞株)由南京师范大学生物化学研究所殷志敏教授提供。RAW264.7 用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的高糖DMEM完全培养基,THP-1细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的1640完全培养基,置于37 ℃、5% CO2的培养箱中常规培养,实验用细胞均为对数生长期。
1.3 炎症因子检测RAW264.7 细胞接种于12 孔细胞培养板,不同浓度的瑞香素(10、20、40 μmol/L)或JAK 抑制剂Ruxolitinib(INCB018424)1 μmol/L 预处理细胞2 h,然后用脂多糖(100 ng/mL)刺激或不刺激细胞18 h,收集上清,EILSA试剂盒检测HMGB1的水平,具体操作按照试剂盒说明书进行。THP-1细胞接种于12孔细胞培养板,不同浓度的瑞香素(10、20、40 μmol/L)预处理细胞2 h,然后用rhHMGB1(500 ng/mL)刺激或不刺激细胞6 h,收集上清,分别用TNF-α、IL-6、PGE2 EILSA试剂盒检测细胞因子水平,具体操作按照试剂盒说明书进行。
1.4 NO检测THP-1细胞接种于12孔细胞培养板,不同浓度的瑞香素(10、20、40 μmol/L)预处理细胞2 h,然后用rhHMGB1(500 ng/mL)刺激或不刺激细胞6 h,收集上清,NO检测试剂盒检测NO释放。具体操作严格按照试剂盒说明书进行。
1.5 Western blottingRAW264.7和THP-1细胞按照实验分组分别进行药物处理,弃去细胞培养基,用预冷的PBS洗1次,然后加入细胞裂解液(含蛋白酶抑制剂)冰上裂解30 min,收集细胞裂解液,4 ℃、12 500 r/min离心10 min,上清加入上样缓冲液煮沸10 min,使蛋白充分变性。根据蛋白含量测定结果,每组样品取等量蛋白上样,进行SDS-PAGE电泳。电泳后的蛋白转移至硝酸纤维素膜(NC)上。TBST洗膜3次,然后加入相应一抗4 ℃孵育过夜,第2天加入Odyssey专用的荧光二抗室温避光孵育2 h,然后TBST洗膜3次,最后去离子水洗膜1次,用Odyssey双色红外激光成像系统扫描,并用配套软件分析实验结果。
1.6 统计分析实验数据均采用均数±标准差表示,统计分析采用单因素方差分析,SPSS17.1 统计软件分析实验结果。P<0.05表示差异有统计学意义。
2 结果 2.1 瑞香素抑制脂多糖诱导的HMGB1释放实验结果表明,脂多糖刺激能够显著诱发HMGB1的释放,瑞香素预处理组HMGB1 的释放与脂多糖刺激组相比明显下降,抑制效应呈现浓度±赖性(表 1,P<0.05)。
| 表 1 瑞香素抑制脂多糖诱导的HMGB1释放 Table 1 Daphnetin suppressed lipopolysaccharide (LPS)-induced HMGB1 release in RAW264.7 cells (Mean±SD,n=3) |
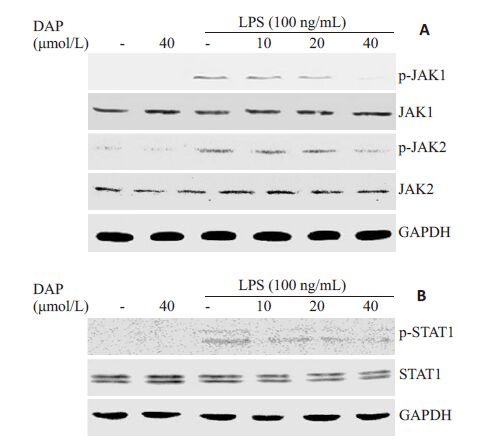
我们已有的研究表明脂多糖刺激RAW264.7细胞,JAK1/2、STAT1均被磷酸化,分别在30 min和4 h磷酸化水平达到最高点[4]。所以,在本研究中用不同浓度的瑞香素(10、20、40 μmol/L)分别预处理RAW264.7细胞2 h,然后脂多糖分别作用30 min或4 h,收集胞内总蛋白,进行免疫印迹检测p-JAK1/2和p-STAT1的表达水平。图 1结果显示,脂多糖刺激RAW264.7细胞,JAK1/2、STAT1 的磷酸化水平显著提高,瑞香素预处理组细胞,p-JAK1/2、p-STAT1的水平明显被抑制,并且抑制程度表现出剂量±赖性。
|
图 1 瑞香素抑制脂多糖诱导的JAK-STAT1信号通路激活 Figure 1 Daphnetin attenuated the activation of JAK-STAT1signaling pathway in LPS-challenged RAW264.7 cells. |
THP-1细胞用不同浓度的瑞香素(10、20、40 μmol/L)预处理2 h,然后500 ng/mL rhHMGB1刺激6 h,分别检测TNF-α、IL-6、PGE2、NO等的水平。实验结果表明rhHMGB1 刺激能够显著诱发炎症因子和炎症介质的释放,瑞香素预处理组炎症因子和炎症介质的释放与rhHMGB1单独刺激组相比明显下降(P<0.05),抑制效应呈现浓度±赖性(表 2)。
| 表 2 瑞香素抑制rhHMGB1诱导的促炎因子和促炎症介质的释放 Table 2 Daphnetin inhibited rhHMGB1-induced release of pro-inflammatory cytokines and mediators in THP-1 cells(Mean±SD,n=3) |
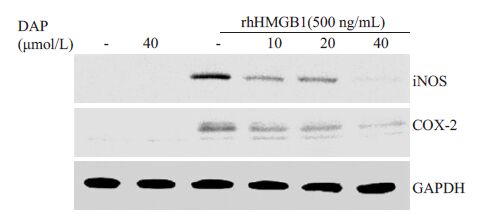
药物处理同2.3,rhHMGB单独刺激THP-1 细胞,胞内iNOS、COX-2的表达水平显著上调,然而瑞香素预处理组能够明显下调该两种蛋白的表达水平(图 2)。该实验结果表明,瑞香素能够通过下调iNOS、COX-2的表达水平抑制炎症介质NO和PGE2的释放。
|
图 2 瑞香素抑制rhHMGB1诱导的iNOS、COX-2表达 Figure 2 Daphnetin attenuated the expression of iNOS and COX-2 induced by rhHMGB1 in THP-1 cells. |
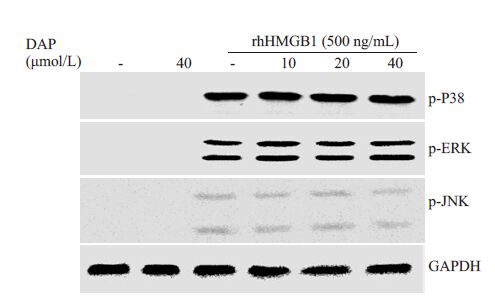
THP-1细胞用不同浓度的瑞香素(10、20、40 μmol/L)预处理2 h,然后500 ng/mL rhHMGB1 刺激30 min,Western blot 分别检测ERK、p38、JNK的磷酸化水平。图 3结果表明,rhHMGB1作用THP-1细胞30 min,p38、ERK、JNK的磷酸化水平明显提高。然而,瑞香素预处理THP-1 细胞,rhHMGB1 触发的MAPKs信号的激活并无显著影响。该研究结果显示,瑞香素对rhHMGB1诱导的MAPKs信号途径的激活无抑制作用。
|
图 3 瑞香素对rhHMGB1诱导MAPKs信号激活的影响 Figure 3 Effect of daphnetin on rhHMGB1-induced activation of MAPKs signaling in THP-1 cells. |
HMGB1是30多年前发现的存在于真核细胞核内的非组蛋白DNA结合蛋白,因其在聚丙烯酞胺凝胶电泳(PAGE)中迁移速度快而得名。作为真核细胞的一个重要核蛋白,在维持核小体结构、染色质重塑、基因转录调节过程中发挥重要作用。研究表明,HMGB1在胞外多种刺激作用下,能够从胞核转位到胞质,并进一步分泌到胞外环境。胞外的HMGB1能够通过与其相应受体结合,通过激活胞内多条信号途径诱发机体的炎症反应[14]。因此,HMGB1 被认为是一个“晚期炎症因子”。目前很多的抗炎机制研究主要集中在对早期炎症因子的影响方面,而对HMGB1的影响报道较少。
本研究主要探讨了瑞香素对HMGB1释放及其诱发炎症反应的影响,并对其可能的作用机制进行了初探。研究结果表明,瑞香素浓度±赖性的抑制脂多糖诱导的HMGB1 释放,而且该抑制效应可能与瑞香素对JAK-STAT1信号途径的抑制密切相关。不同刺激诱发的HMGB1释放有主动和被动释放两种方式,前者主要发生在活化的单核巨噬细胞,而后者主要来自损伤和坏死的组织细胞。体内外实验均表明,脂多糖刺激RAW264.7细胞能够诱发HMGB1的释放[15],所以我们选择RAW264.7细胞为研究对象,探究瑞香素能否抑制脂多糖诱导的HMGB1释放。通过ELISA实验检测细胞培养基中HMGB1的水平,统计结果显示,瑞香素能够显著减弱脂多糖诱发的HMGB1释放,且抑制效应表现出浓度±赖性(表 1)。HMGB1主动释放的前提是其从胞核到胞质的转位过程,然而我们对HMGB1的核质转位机制了解尚少。已有的研究表明HMGB1的翻译后修饰如乙酰化、磷酸化有助于核质转位的发生[16],JAK-STAT1信号途径也参与了HMGB1的核质转位过程[9]。接下来我们又对JAK-STAT1 信号进行了检测。结果发现,瑞香素能够剂量±赖性地抑制脂多糖激活的JAK-STAT1 信号途径(图 1)。JAK 抑制剂预处理RAW264.7细胞,然后脂多糖刺激细胞18h,HMGB1的释放明显下降。该结果更进一步证明了抑制JAK-STAT1 信号途径的激活,可能是瑞香素减弱HMGB1释放的潜在机制之一(表 1)。但是该实验结果尚需更多的实验来验证,如干扰STAT1之后,再检测瑞香素对脂多糖诱导HMGB1释放的影响。
胞外HMGB1可以作为潜在致炎因子诱发机体出现“二次炎症”反应。我们紧接着对瑞香素能否抑制HMGB1诱导的炎症反应进行了探究。在该部分的研究中,我们采用人THP-1细胞为研究对象,不同浓度瑞香素预处理细胞2 h,然后rhHMGB1作用6 h,ELISA检测炎症因子TNF-α、IL-6、PGE2的水平,NO检测试剂盒检测NO的释放,免疫印迹检测iNOS、COX-2的表达水平。如表 2所示,瑞香素能够下调HMGB1诱发的炎症因子和炎症介质的释放,抑制效应呈现为浓度±赖性。瑞香素对rhHMGB1诱导的iNOS、COX-2的表达同样有抑制作用(图 2)。已有的研究表明,胞外HMGB1诱发的炎症反应与MAPKs、NF-кB信号通路相关。因此,我们还对瑞香素抑制HMGB1诱导炎症反应的分子机制进行了初步研究。然而,遗憾的是我们的结果显示,瑞香素对rhHMGB1诱导的MAPKs信号的活化并无显著影响(图 3)。已有的研究表明,瑞香素能够显著抑制脂多糖诱导的MAPKs信号途径激活,发挥抗炎作用[12]。分析出现这种差异的可能原因是:刺激物和所选细胞的差异以及瑞香素的来源不同。不同的刺激,不同的细胞会引发不同的胞内信号途径的激活,不同来源的瑞香素,所引起的生物学可能也会有所不同。NF-кB信号途径也是HMGB1诱发的主要信号,在未来的实验中,我们将进一步探讨瑞香素能否通过调控该信号通路抑制HMGB1诱发的炎症反应。
总之,本研究揭示了瑞香素的抗炎作用与抑制晚期炎症因子HMGB1的释放密切相关,暗示了HMGB1可能作为瑞香素抗炎作用的新靶点,扩大了瑞香素的应用范围。通过潜在机制的初步探讨,为瑞香素抑制晚期炎症反应提供了新的理论±据和新见解。但是瑞香素如何对抗HMGB1诱导的反应尚不明确,进一步探讨瑞香素抑制HMGB1诱发“二次炎症”的潜在分子机制是我们未来研究工作的重点。
| [1] | Pan XL, Cao X, Li N, et al. Forsythin inhibits lipopo- lysaccharide-induced inflammation by suppressing JAK-STAT and p38 MAPK signalings and ROS production[J]. Inflamm Res,2014, 63 (7) : 597-608. DOI: 10.1007/s00011-014-0731-7. |
| [2] | Szekanecz Z, Koch AE. Macrophages and their products in rheumatoid arthriti[J]. Curr Opin Rheumatol,2007, 19 (3) : 289-95. DOI: 10.1097/BOR.0b013e32805e87ae. |
| [3] | Kang YJ, Wingerd BA, Arakawa T, et al. Cyclooxygenase-2 gene transcription in a macrophage model of inflammation[J]. J Immunol,2006, 177 (11) : 8111-22. DOI: 10.4049/jimmunol.177.11.8111. |
| [4] | Qi ZL, Yin F, Lu LA, et al. Baicalein reduces lipopolysaccharide- induced inflammation via suppressing JAK/STATs activation and ROS production[J]. Inflamm Res,2013, 62 (9) : 845-55. DOI: 10.1007/s00011-013-0639-7. |
| [5] | Lee W, Yoo H, Kim JA, et al. Barrier protective effects of piperlo- nguminine in LPS-induced inflammation in vitro and in vivo[J]. Food Chem oxicol,2013, 58 : 149-57. DOI: 10.1016/j.fct.2013.04.027. |
| [6] | Yamada S, Maruyama I. HMGB1, a novel inflammatory cytokine[J]. Clin Chim Acta,2007, 375 (1/2) : 36-42. |
| [7] | Andersson U, Tracey KJ. HMGB1 is a therapeutic target for sterile inflammation and infection[J]. Annu Rev Immunol,2011, 29 : 139-62. DOI: 10.1146/annurev-immunol-030409-101323. |
| [8] | Diener KR, Al-Dasooqi N, Lousberg EL, et al. The multifunctional alarmin HMGB1 with roles in the pathophysiology of sepsis and cance[J]. Immunol Cell Biol,2013, 91 (7) : 443-50. DOI: 10.1038/icb.2013.25. |
| [9] | Lu B, Antoine DJ, Kwan K, et al. JAK/STAT1 signaling promotes HMGB1 hyperacetylation and nuclear translocation[J]. Proc Natl Acad Sci USA,2014, 111 (8) : 3068-73. DOI: 10.1073/pnas.1316925111. |
| [10] | Venereau E, Casalgrandi M, Schiraldi M, et al. Mutually exclusive redox forms of HMGB1 promote cell recruitment or proinflammatory cytokine release[J]. J Exp Med,2012, 209 (9) : 1519-28. DOI: 10.1084/jem.20120189. |
| [11] | Liu ZY, Liu J, Zhao KL, et al. Protective effects of daphnetin on Sodium taurocholate-induced severe acute pancreatitis in rats[J]. Mol Med Rep,2014, 9 (5) : 1709-14. |
| [12] | Yu WW, Wang HH, Ying HJ, et al. Daphnetin attenuates microglial activation and proinflammatory factor production via multiple signaling pathway[J]. Int Immunopharmacol,2014, 21 (1) : 1-9. DOI: 10.1016/j.intimp.2014.04.005. |
| [13] | Yang L, Yang Q, Zhang K, et al. Neuroprotective effects of daphnetin against NMDA Receptor-Mediated excitotoxicity[J]. Molecules,2014, 19 (9) : 14542-55. DOI: 10.3390/molecules190914542. |
| [14] | Karuppagounder V, Arumugam S, Thandavarayan RA, et al. Modulation of HMGB1 translocation and RAGE/NFκB cascade by quercetin treatment mitigates atopic dermatitis in NC/Nga transgenic mice[J]. Exp Dermatol,2015, 24 (6) : 418-23. DOI: 10.1111/exd.2015.24.issue-6. |
| [15] | Zhou HT, Ji XE, Wu Y, et al. A Dual-Role of Gu-4 in suppressing HMGB1 secretion and blocking HMGB1 Pro-Inflammatory activity during inflammation[J]. PLoS One,2014, 9 (3) : e89634. DOI: 10.1371/journal.pone.0089634. |
| [16] | Yang H, Lundback P, Ottosson L, et al. Redox modification of cysteine residues regulates the cytokine activity of high mobility group Box-1 (HMGB1)[J]. Mol Med,2012, 18 (2) : 250-9. |
 2015, Vol. 35
2015, Vol. 35
