核仁素(C23)是核仁的主要成分,细胞核仁素的合成与细胞分裂的速率呈正相关,因此核仁素在恶性肿瘤细胞和快速分裂细胞的表达量高,而在正常细胞和静止细胞表达量低。核仁素的高表达在某些恶性肿瘤的发生起重要作用[1-3]。
宫颈鳞癌的发生经历上皮单纯性增生、宫颈上皮内瘤变(CIN)、原位癌和浸润性癌的过程,在此过程中细胞内何种蛋白物质起关键作用尚未清楚。目前已有研究表明下调核仁素表达可抑制宫颈癌细胞株的生长[4],而检测核仁素在宫颈上皮内瘤变和宫颈鳞癌组织中的表达国内外尚未见报道。本研究用免疫组织化学检测核仁素在宫颈癌和癌前病变组织的表达,比较其表达差异,探讨核仁素表达对该癌发生发展的作用。
1 材料与方法 1.1 标本来源50例宫颈鳞癌和65例宫颈上皮内瘤变及其周围正常宫颈组织来自湘南学院附属医院病理科2012 年~2014年外检资料。50例宫颈鳞癌患者年龄35~55岁,平均40岁;65例宫颈上皮内瘤变患者年龄30~45岁,平均35岁。术前均未做过放疗和化疗。
1.2 方法 1.2.1 免疫组化检测所有标本经10%中性福尔马林固定,石蜡包埋,4 μm厚切片,免疫组化染色。核仁素鼠抗人单克隆抗体(1∶400)为Santa Cruz产品。免疫组化采用SP法,DAB染色,苏木精复染。用与第一抗体同种动物非免疫血清代替一抗作为阴性对照,以人正常肝细胞的胞核作阳性对照。
1.2.2 结果判断阳性细胞呈棕黄色颗粒状,定位于细胞核。阳性细胞数少于10%判断为阴性,大于是10%为阳性。综合分析每张切片的阳性细胞数和染色强度,由两位病理医师用Allred评分法独立进行半定量分析[5]:阳性细胞数:无细胞着色为0分;阳性细胞数<1/100为1分;阳性细胞数1/100~1/10为2分;阳性细胞数1/10~1/3为3分;阳性细胞数1/3~2/3为4分;阳性细胞数>2/3为5分。染色强度:无着色0分;弱着色1分;中等着色2分;强着色3分。阳性细胞数和染色强度得分之和为该例标本的免疫组化半定量得分。
1.2.3 结果分析比较核仁素在宫颈鳞癌、宫颈上皮内瘤变和正常宫颈鳞状上皮表达的差异;分析核仁素表达量与宫颈鳞癌和宫颈上皮内瘤变病理分级的关系。
1.3 统计学处理采用SPSS 13.0软件进行统计学分析,率的比较用χ2检验;两组间均数比较用配对资料t检验,P<0.05认为差异有统计学意义。
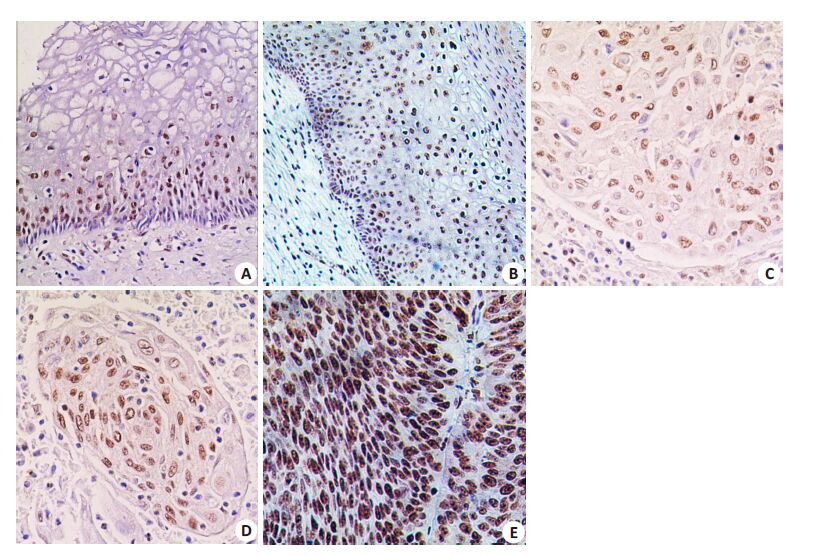
2 结果 2.1 核仁素在宫颈鳞癌、宫颈上皮内瘤变和正常宫颈组织中的阳性表达率免疫组化检测发现,核仁素在正常宫颈鳞状上皮仅表达于基底细胞(图 1A),在宫颈上皮内瘤变表达于异型增生细胞(图 1B),而在宫颈鳞癌组织中呈弥漫阳性表达(图 1C,D,E)。核仁素在3种组织的表达均定位于细胞核,未见胞质表达。核仁素的阳性表达率在宫颈鳞癌为100%,在宫颈上皮内瘤变为77%,而在正常宫颈上皮组织只有8%。统计学分析表明,核仁素阳性表达率在宫颈鳞癌显著高于宫颈上皮内瘤变和正常宫颈组织,在宫颈上皮内瘤变显著高于正常宫颈组织(P<0.01,表 1)。
|
图 1 核仁素在宫颈鳞癌和非癌组织中的表达 Figure 1 Nucleolin immunostaining in cervical squamous cell carcinoma and noncarcinoma cervical tissues. |
| 表 1 核仁素在宫颈鳞癌和非癌组织中的阳性表达率和半定量分析 Table 1 Nucleolin positivity rates and immunostaining score in cervical squamous cell carcinoma and noncarcinoma cervical tissues (Mean±SD) |
免疫组化半定量评分表明,核仁素在宫颈鳞癌表达量(7.6±0.3)显著高于宫颈上皮内瘤变(6.1±0.2)和正常宫颈组织(3.0±0.2);而宫颈上皮内瘤变核仁素表达量显著高于正常宫颈组织(P<0.01,表 1)。证明在宫颈癌的多步癌变过程中核仁素表达量递增。此外,核仁素表达量在中-低分化宫颈鳞癌(7.9±0.1)(图 1D,E)显著高于高分化鳞癌(7.0±0.2)(图 1C),P<0.01。进一步分析发现,核仁素表达量在高级别上皮内瘤变(CIN Ⅱ、Ⅲ)(6.0±0.1)显著高于低级别上皮内瘤变(CINⅠ)(4.0±0.2),P<0.01。以上结果表明在宫颈鳞癌和宫颈上皮内瘤变组织核仁素表达水平与病变的病理分级呈正相关(表 2)。
| 表 2 核仁素在宫颈鳞癌和宫颈上皮内瘤变表达量与肿瘤病理分级的关系 Table 2 Correlation of nucleolin expression levels with tumor histological grades in cervical squamous cell carcinoma and cervical intraepithelial neoplasia (CIN)(Mean±SD) |
宫颈癌是育龄妇女最常见的恶性肿瘤,它的发生与宫颈HPV感染有关。然而大约一半的病人尽管有HPV感染,却没有表现出宫颈癌或癌前病变的组织学改变,说明HPV感染只是宫颈癌发生的早期事件。目前还没有宫颈癌癌变的蛋白质标记物,在宫颈上皮从低级别上皮内瘤变到高级别上皮内瘤变,再发展到浸润性癌的多步骤癌变过程中细胞内何种蛋白质起重要作用目前尚不清楚。核仁素是核仁的主要蛋白质成份,占核仁蛋白的10%,核仁素与细胞的增殖和生长有关,它和核仁组织者区都是反映核仁活动的重要物质,两者在恶性肿瘤均呈高表达。据文献报道,核仁素在多种恶性肿瘤细胞呈高度表达,如前列腺癌、肝细胞癌和大脑胶质瘤[1-3]。本研究发现,从宫颈正常鳞状上皮发展到宫颈上皮内瘤变再发展到宫颈鳞癌的过程中,核仁素表达量递增,即核仁素在宫颈鳞癌中的表达显著高于宫颈上皮内瘤变和正常宫颈组织,宫颈上皮内瘤变中核仁素表达显著高于正常宫颈组织。此外,核仁素在宫颈上皮内瘤变组织只表达于异型增生的细胞,在正常宫颈上皮只表达于基底细胞,证明核仁素素表达增高与细胞增生活跃有关,核仁素高表达是宫颈鳞癌发生的早期事件。
核仁素主要定位于核仁,但同时具有在核仁、细胞核和细胞质之间穿梭运行的特性[6-7]。因此在某些细胞,尤其是恶性肿瘤细胞可出现核仁素的胞质表达[1-2]。核仁素作为核仁的重要组份,在细胞分裂增殖的时候可迁移到胞核外,核仁素的这种分布变化可能是细胞增殖的早期信号[8]。某些肿瘤在恶变过程中,核仁素在细胞内的分布也发生改变,如从正常肝细胞到肝细胞癌[1]、从前列腺上皮内瘤变到前列腺癌[2]、从良性脑膜瘤到恶性脑膜瘤[9]、以及从色素痣、非典型色素痣到恶性黑色素瘤[10],核仁素在细胞核和细胞质内均呈阳性表达。本研究发现,核仁素在正常宫颈鳞状上皮、宫颈上皮内瘤变和宫颈鳞癌组织中只表达于细胞核,均未出现胞质表达。
核仁素的过度表达不仅与肿瘤的发生有关,而且与肿瘤的生物学行为有关。据文献报道,下调肿瘤细胞表面的核仁素能抑制宫颈癌细胞株、肝细胞癌和胶质母细胞瘤的生长[1, 3-4],下调肝细胞癌表面核仁素表达,癌细胞增殖和迁移能力明显受到抑制[1];阻断肿瘤细胞表面的核仁素可抑制横纹肌样瘤和黑色素瘤细胞的生长[11-12];核仁素表达与某些恶性肿瘤的进展相关[13-14],高度表达核仁素的癌细胞提示预后更差[15-16]。核仁素在前列腺癌的高表达和核外迁移与该癌病理分级呈正相关[2]。本研究发现,核仁素表达量与宫颈鳞癌和宫颈上皮内瘤变的病理分级呈正相关,即核仁素表达量越高,病变级别就越高;提示核仁素表达越高,病人预后越差。
总之,宫颈鳞状上皮在癌变过程中核仁素表达增高,核仁素表达增高与宫颈鳞癌的病理分级呈正相关,提示核仁素的过度表达对宫颈癌的发生和发展起重要作用。因此核仁素可作为宫颈癌和宫颈非癌组织鉴别的有用标记。
| [1] | 蒙国照, 肖胜军, 曾思恩, 等. 细胞表面核仁素表达下调抑制肝癌细胞生长[J]. 中华肿瘤杂志,2011, 33 (1) : 23-7. |
| [2] | 蒙国照, 丁宇, 高双全, 等. 核仁素的表达定位和定量与前列腺癌演变的关系[J]. 临床与实验病理学杂志,2011, 27 (12) : 1310-3. |
| [3] | Xu Z, Joshi N, Agarwal A, et al. Knocking down nucleolin expression in gliomas inhibits tumor growth and induces cell cycle arrest[J]. J Neurooncol,2012, 108 : 59-67. DOI: 10.1007/s11060-012-0827-2. |
| [4] | 刘洪丽, 张友忠, 吕昌帅, 等. 核仁素表达下调对宫颈癌细胞hela生物学行为的影响[J]. 山东大学学报(医学版),2013, 11 : 46-50. |
| [5] | Allred D C, Clark G M, Elledge R, et al. Association of p53 protein expression with tumor cell proliferation rate and clinical outcome in node-negative breast cancer[J]. J Natl Cancer Inst,1993, 85 : 200-6. DOI: 10.1093/jnci/85.3.200. |
| [6] | Eun JJ, Hui Y, Youmie P, et al. Induction of nucleolin translocation by acharan sulfate in A549 human lung adenocarcinoma[J]. J Cellular Biochemistry,2010, 110 (5) : 1272-8. DOI: 10.1002/jcb.v110:5. |
| [7] | Daniely Y, Dimitrova D, Borowiec J A. Stress-dependent nucleolin mobilization mediated by p53-nucleolin complex formation[J]. Mol Cell Biol,2002, 22 (16) : 6014-22. DOI: 10.1128/MCB.22.16.6014-6022.2002. |
| [8] | Otake Y, Soundararajan S, Sengupta TK, et al. Overexpression of nucleolin in chronic lymphocytic leukemia cells induces stabilization of bcl2 mRNA[J]. Blood,2007, 109 : 3069-75. |
| [9] | Ohkoudo M. Morphometrical analysis of nucleolin immunohistochemistry in meningiomas[J]. Acta Neuropathol,1996, 92 (1) : 1-7. DOI: 10.1007/s004010050481. |
| [10] | Mourmouras V, Cevenini G, Cosci E, et al. Nucleolin protein expression in cutaneous melanocytic lesions[J]. J Cutan Pathol,2009, 36 (6) : 637-46. DOI: 10.1111/cup.2009.36.issue-6. |
| [11] | Krust B, El Khoury D, Soundaramourty C, et al. Suppression of tumorigenicity of rhabdoid tumor derived G401 cells by the multivalent HB-19 pseudopeptide that targets surface nucleolin[J]. Biochimie,2011, 93 (3) : 426-33. DOI: 10.1016/j.biochi.2010.10.015. |
| [12] | El Khoury D, Destouches D, Lengagne R, et al. Targeting surface nucleolin with a multivalent pseudopeptide delays development of spontaneous melanoma in RET transgenic mice[J]. BMC Cancer,2010, 10 : 325. DOI: 10.1186/1471-2407-10-325. |
| [13] | Hsu TI, Lin SC, et al. MMP7-mediated cleavage of nucleolin at Asp255 induces MMP9 expression to promote tumor malignancy[J]. Oncogene,2015 (34) : 7. |
| [14] | Semba S, Mizuuchi E, Yokozaki H. Requirement of phosphatase of regenerating liver-3 for the nucleolar localization of nucleolin during the progression of colorectal carcinoma[J]. Cancer Sci,2010, 101 (10) : 2254-61. DOI: 10.1111/cas.2010.101.issue-10. |
| [15] | Qian B, Yao YS, Liu YH, et al. Nucleolin identified by comparative massspectra analysis is a potential marker for invasive progression of hepatocellular carcinoma[J]. Mol Med Rep,2014, 10 (3) : 1489-94. |
| [16] | Wu CD, Chou HW, Kuo YS, et al. Nucleolin antisense oligodeoxynucleotides induce apoptosis and may be used as a potential drug for nasopharyngeal carcinoma therapy[J]. Oncol Rep,2012, 27 (1) : 94-100. |
 2015, Vol. 35
2015, Vol. 35
