海水具有高渗、碱性、低温、细菌含量高等独特的理化性质,既往研究表明海水浸泡不仅会加大烧伤创面局部组织水肿程度,加重血管内皮细胞损伤,造成更加严重的微循环障碍[1],还会加重创面感染程度[2],影响机体的血流动力学、体液代谢及内脏器官功能[3-5],对烧伤后落入海水中的患者造成极为不利的影响。寻找一种可改善海水对创面造成的不利影响、促进创面愈合,同时可减轻医护人员工作强度的治疗方案,以应对成批烧烫伤合并海水浸泡患者救治是目前临床面临的一个课题。封闭负压引流作为治疗烧伤创面的新技术应用于临床取得了良好的治疗效果[6],但对于海水浸泡后的创面是否有效尚未有明确实验数据。本实验以4% TBSA深Ⅱ度背部皮肤烫伤合并海水浸泡的新西兰大白兔为动物模型,观察伤后不同处理组间病理学改变、毛细血管及内皮细胞结构变化、创面愈合情况等指标,探讨封闭负压吸引联合肝素溶液湿敷治疗对海水浸泡后烧伤创面的治疗作用,为平时及战时海上烧伤患者的救治提供实验参考依据。
1 资料与方法 1.1 器材及设备人工配方海水,由广州沃特尔水处理科技有限公司提供配方,主要成分为(g/L):NaCl 25.516、KCl 0.825、MgCl2 2.347、MgSO4 3.325、CaCl2 1.241。pH8.02,海水密度1.05~1.06。H-7500型电子显微镜(Hitachi公司)。CH20BIMF200 型光学显微镜(Olympus 公司)。恒温水浴箱。
1.2 动物模型及分组处理新西兰大白兔20只(南方医科大学实验动物中心提供)体质量2.0 kg~2.5 kg,雌雄不限(不含孕兔),兔龄3~4个月。80 g/L 硫化钠背部脱毛。3%戊巴比妥纳按体质量30 mg/kg作耳缘静脉麻醉,将各组动物四肢固定,将已脱毛区域用4 cm×4 cm大小,36层经99 ℃恒温水浴浸泡的纱布平铺于烫伤部位17s,造成实验动物4个1% TBSA深Ⅱ度烫伤创面(病理切片证实)[7],其中3个创面给予海水浸泡2 h。对照组不进行浸泡,给予常规换药治疗(A组)。海水浸泡的3组创面分别给予常规换药治疗(B 组)、单纯负压吸引治疗(C 组)、负压吸引合并肝素治疗(D组)。负压引流创面(C、D组)每日给予生理盐水50 mL冲洗1次,D组创面冲洗后经管路给予5000 U/mL肝素溶液3 mL浸湿负压引流敷料,1 h后启动负压吸引装置继续给予封闭负压吸引治疗。
1.3 标本采集分别于术后第1、3、5、7天随机抽取5只动物,麻醉后于创面切取约2 cm×1 cm大小组织标本。分别进行病理学检测、含水量计算,取材后继续饲养至创面愈合。
1.4 检测指标 1.4.1 组织病理学观察光镜标本4%甲醛溶液固定, HE染色,观察创面组织病理形态学变化。电镜标本2.5%戊二醛固定。送电镜室逐级进行脱水、浸透、包埋和定位,制备超薄切片,醋酸双氧铀及柠檬酸铅双重电子染色,透射电镜观察。
1.4.2 创面VEGF表达阳性率及血管密度统计标本4%甲醛固定,常规石蜡包埋、切片。检测时脱蜡水化, 抗兔VEGF抗体及CD31抗体进行免疫组化染色。微血管的判定与计数参照Weidner的计数方法,视野内任何一个被染成棕黄色的单个内皮细胞或内皮细胞簇作为一个微血管,分界明确的内皮细胞按一条血管计数,管腔>8个红细胞大小或带有肌层的血管均不计数。先在低倍(×40)镜下全面观察切片,确定CD31阳性微血管高密度区,再在(×400 倍)视野下进行微血管计数,取5个视野进行计数,然后取平均值,作为该组织的微血管密度(MVD)。
VEGF阳性结果判定采用半定量计分法判定[9]。先按阳性着色程度评分,无着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。再按阳性细胞所占比例评分,0分为<5%;1分为5%~10%;2分为11%~50%;3分为51%~80%;4 分为>80%. 两者乘积判定阳性结果:0分为阴性(-);1~4 分为弱阳性(+);5~8 分为中度阳性(++);9~12分为强阳性(+++)。
1.4.3 观察创面愈合情况用毫米方格纸法计算于第3、 5、7、14天残余创面面积,统计创面完全愈合时间,判断创面愈合标准为创面上皮覆盖。
1.4.4 测定组织含水量采用干湿重法测量各组动物创面含水量,组织含水量=(湿质量-干质量)/湿质量。
1.5 统计学处理计量资料的比较采用重复测量方差分析,多重比较用LSD法(方差不齐用Dunnett T3法)。等级资料用数值变量(N)表示,两个样本之间的比较采用Wilcoxon秩和检验。
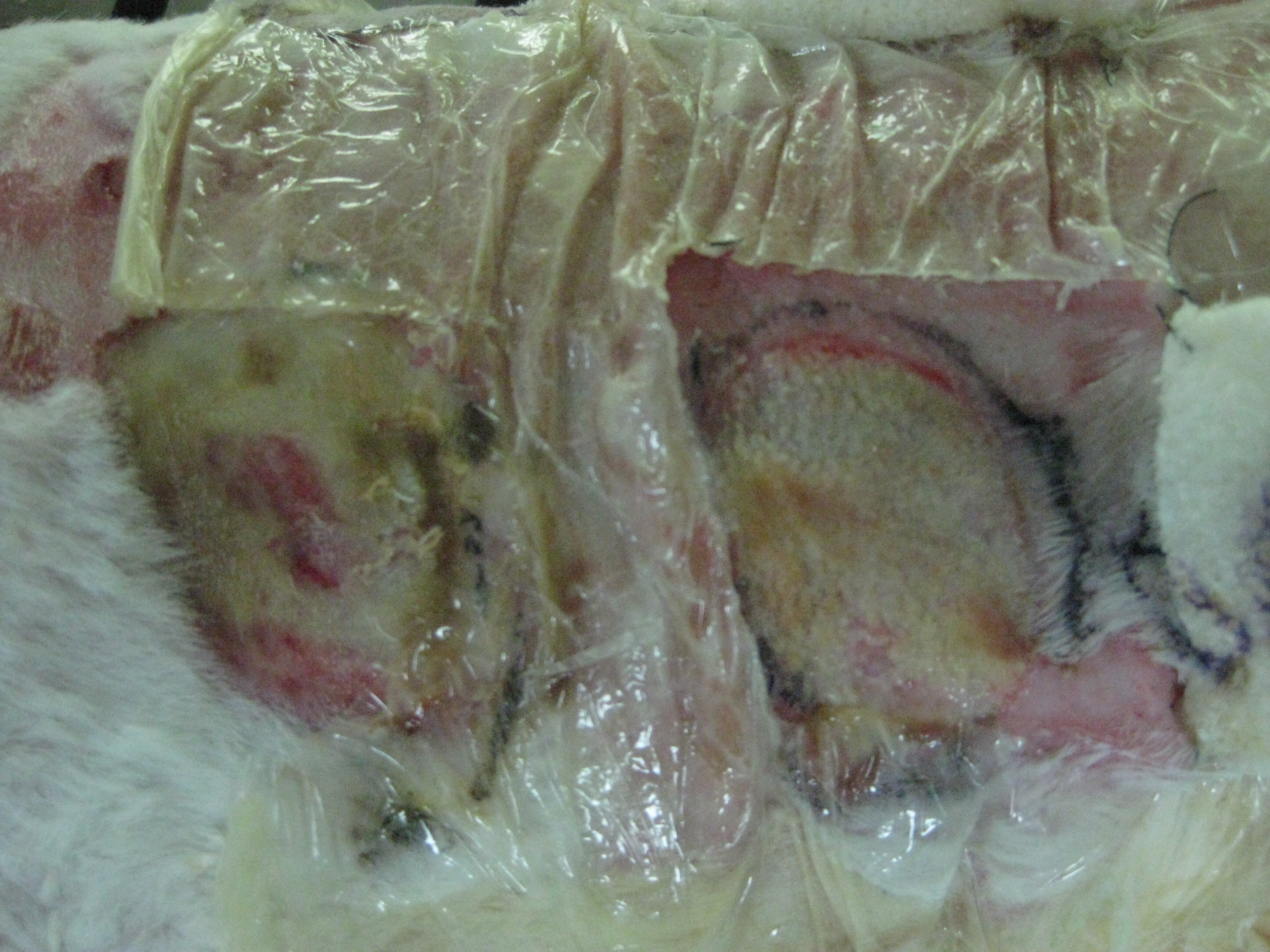
2 结果 2.1 创面大体观察伤后第1天,各组创面均有水肿,常规换药组(A组)创面较干燥,海水浸泡组(B组)创面干枯、加深,切开取材时见痂下组织水肿明显,封闭负压引流组(C组)及联合治疗组(D组)创面较湿润。伤后第3天,各组创面仍肿胀,A、B组创面可见坏死组织附着,B组可见明显坏死灶,C、D组创面坏死组织较少,基底较新鲜、红润(图 1)。切开时见组织内水肿仍十分明显。伤后第5天,A组创面表面结有薄层痂皮,B组创面加深明显,表面坏死组织结成厚痂皮,C、D组创面基底较湿润,无明显痂皮,D组创面坏死组织较C组少,并更为红润。伤后第7天,A组创面坏死组织逐渐溶痂,少量液化坏死组织附着,B组创面坏死组织较厚,可见少量脓性分泌物,C、D组创面坏死组织部分脱落,基底较新鲜,部分创面上皮化。
|
图 1 动物大体观察 Figure 1 General observation of animal 3 days after scald burns. group B (left) and group D(right). The wounds were dealed with common dressing (group A), common dressing after seawater immersion (group B), vacuum sealing drainage after seawater immersion (group C), vacuum sealing drainage combined with heparin irrigation after seawater immersion (group D). |
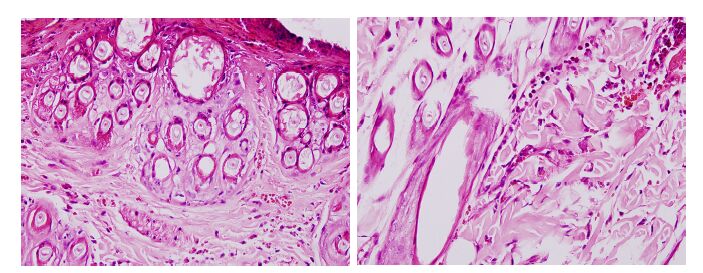
伤后第1 天,各组创面表皮均脱落、坏死,真皮水肿,炎症细胞浸润,微血管扩张,可见少量炎症细胞浸润,以B组最明显,并可见大量红细胞外渗到组织间。伤后第3天,B组(图 2)创面组织仍水肿明显,微血管扩张,管腔内可见栓塞红细胞,真皮层坏死组织加深,炎症细胞浸润明显,C、D组创面胶原纤维水肿程度较A、B组轻,D组炎症细胞浸润程度及红细胞外渗情况较其他组轻。伤后第5天,各组创面组织水肿均有所减轻,A、B、C组仍有大量炎症细胞浸润,胶原纤维水肿伴坏死,可见破裂血管及外渗红细胞聚集,D组创面炎症细胞较少,胶原纤维水肿程度较轻。伤后第7天,各组创面组织内炎症细胞较前减少,可见血管扩张、充血,多可见新生血管。C、D组新生血管较A、B组多,D组创面及毛囊内出现新生鳞状上皮。
|
图 2 伤后第3天光镜下B组(左)及D组(右)创面组织学改变 Figure 2 Histological changes of the wound tissues in group B (left) and group D (right) 3 days after scald burns (HE staining, original magnification: ×400). |
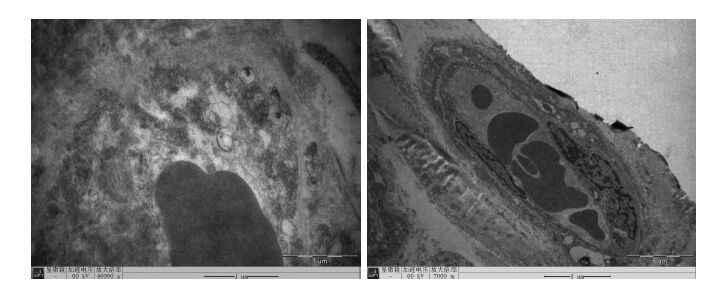
电子显微镜观察结果:A组血管腔内可见红细胞堆积,内皮细胞尚完整,细胞间隙增宽,线粒体内出现空泡,可见核糖体。B组毛细血管基膜部分消失,管腔内可见皱缩变形红细胞,内皮间隙明显增大,细胞间边界不清,部分内皮细胞坏死,部分内皮细胞凋亡,残存内皮细胞胞质明显减少(图 3左)。C组毛细血管内皮基膜完整,细胞间隙增宽,细胞间连接打开。部分内皮细胞出现凋亡,内有空泡,可见自噬体形成。D组毛细血管基膜完整,腔内可见散在红细胞,内皮细胞尚完整,染色质聚集到核膜下,细胞间隙增宽(图 3右)。
|
图 3 伤后第3天,B组(左)和D组(右)电镜图片 Figure 3 Electron microscopy the wound tissues in group B (left) and group D (right) 3 days after scald burns. |
创面组织含水量统计结果显示,A、B、C、D各分组间之间差异有统计学意义,(F=94.07,P<0.05)。不同时相点间各组差异有统计学意义(F=236.3,P<0.05)。正常组织含水量测量值为65.45±0.49%。伤后第1天,各组创面较正常组织含水量均升高,其中A组创面含水量最低,提示海水浸泡的3 组创面含水量高于单纯烫伤组。各组创面组织含水量于伤后第3天达到峰值,后逐渐下降。伤后第5天C、D组下降至接近第1天时水平,其中D组下降最明显且水平最低,B组含水量在各组间仍最高。C、D组含水量已经低于A组(表 1)。
| 表 1 伤后各时相点各组烫伤创面组织含水量结果 Table 1 Water content in the wound tissues of the 4 groups at different time points (%) (n=20) |
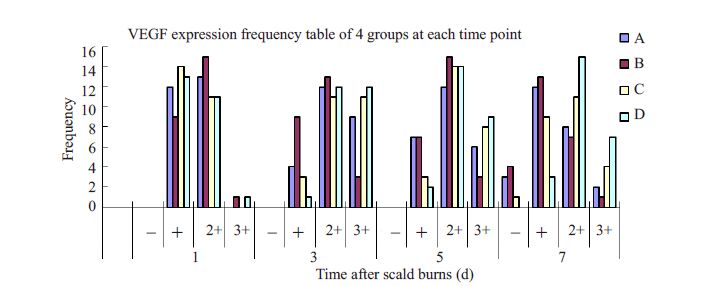
免疫组化染色图片发现,VEGF主要分布在血管、毛囊及创面基底部的细胞。伤后第1 天,B 组创面VEGF表达阳性程度最高,可能是损伤程度最高引起。第3天开始,C、D两组创面VEGF阳性程度迅速增加,颗粒呈棕黄色的细胞明显增多,D组密度最高,并持续至第5天。至第7天时A、B组VEGF表达略有减弱,C、D组仍呈现高表达状态(图 4)。2.5 微血管密度检测
|
图 4 伤后各时相点VEGF表达频数表图 Figure 4 VEGF expression frequency table of 4 groups at each time point (n=20). |
毛细血管密度变化规律类似于VEGF表达规律,阳性信号主要定位于胞浆中。伤后第1天,各组创面血管密度无明显差异,第3~7 天各组创面血管密度逐渐增加,D组各时相点微血管密度(MVD)均最高,B组最低,各组间差异有统计学意义(F=123.36,P<0.05)。在微血管生成时间上看,D组出现最早,且高峰值最高,B组微血管生成较晚且密度低。不同时间点间差异有统计学意义(F=952.75,P<0.05,表 2)。
| 表 2 伤后各时相点各组创面MVD结果 Table 2 Microvessel density(MVD)of the 4 groups at each time point (n=20) |
各组创面愈合率以D组最高,B组最低,伤后第14天时D组创面愈合率为82.12%±2.01%,而B组愈合率为55.94%±1.93%。各组创面愈合率组间差异有统计学意义(F=339.480,P<0.05)。不同时相点间愈合率差异比较均有统计学意义(F=7528.880,P<0.05,表 3)。
| 表 3 伤后各时相点各组烫伤创面愈合率%比较 Table 3 Wound healing rate of 4 groups at each time point (%, n=20) |
世界大洋的平均盐度约为3.5%,含有大量无机盐成分,其中Na+,Cl-的浓度约为血浆的4~5倍,K+的浓度约为血浆的2~3倍,其渗透压可达1300 mOsm/L,约为血浆的5~6倍。pH在8.10~8.21左右,呈高渗、碱性环境[4]。海水独特的理化性质对于烧伤创面将产生明显的不利影响,可使组织水肿、渗透压升高,破坏细胞膜功能,大量金属离子和水分进入胞内,引起细胞肿胀,甚至溶解坏死,加重炎症反应。低温及高渗可加重血管内皮细胞的损伤,同时造成血管收缩、血流减慢,导致大量微血栓形成,明显加深创面[9]。既往实验表明,早期使用淡水冲洗或湿敷均可减轻创面的损伤程度[1]。
封闭负压引流(VSD)技术与传统换药方式相比,对于海水浸泡造成烧伤创面加重的各项因素有着较为针对性的治疗特点。首先,封闭负压引流可持续引流创面渗液,有利于减轻局部组织水肿,加快清除渗入组织间隙的有害离子,尽快去除海水理化特性对组织造成的不利影响。其次,封闭负压引流可改善创面局部血运[10]、加快坏死组织清除,促进细胞增殖[11],其所形成的微酸性环境有利于减轻碱性海水造成的损伤。另外,海水中含有大量有害细菌,既往文献表明,海水浸泡后的烧伤创面易发生多种细菌的混合感染[12],而封闭负压引流治疗对于感染创面有着良好的引流及减轻感染的效果。在本实验中的检测结果表明,与常规换药相比,VSD治疗后创面的组织含水量低,坏死组织清除快,VEGF表达高,新生血管密度高,创面愈合较快,与既往研究结果相吻合[13]。
肝素作为烧伤创面用药有较长历史,其抗凝、溶栓、抗炎[14-15]、结合内源性生长因子、促进创面愈合等作用也得到实验及临床的证实[16]。研究表明,肝素具有与血管内皮细胞高度结合的特性,肝素体内的靶器官即为血管内皮,另外肝素对血管内皮的亲和性还与组织部位有关,其对微血管内皮细胞的亲和力远远超过与大血管内皮细胞的亲和力[17]。肝素与血管内皮细胞结合后,可以与血管内皮上多种促血管生长因子相结合,并且以结合形式与受体结合而发挥生物学效应[18]。既往肝素的应用多为浅表注射、外喷、湿敷包扎,动物试验表明大剂量肝素可明显缓解创面疼痛,改善创面微循环,降低重度烧伤动物的死亡率[19]。本实验给予封闭负压引流联合应用肝素溶液湿敷治疗创面,既有利于及时清除坏死组织及渗液、减轻水肿,又可利用VSD敷料保水性使肝素溶液充分作用于创面,发挥其治疗作用,可针对性地缓解海水的有害因素对烧伤创面的影响。病理切片结果发现与单纯VSD治疗相比,联合肝素湿敷后,血管栓塞程度低,管腔内红细胞积聚少,新生血管出现早,更加有利于促进创面愈合。
血管内皮生长因子(VEGF)是一种多功能细胞因子,可特异性作用于血管内皮细胞,在机体内广泛表达于成纤维细胞、平滑肌细胞、内皮细胞等多种细胞。通过与血管内皮细胞上的特异性受体结合,发挥其促血管内皮细胞增殖和血管生成作用,是促血管再生的最终通道。血管再生是创面愈合的关键环节之一,创面VEGF含量的变化与创面微血管密度的变化在时间上有较强的相关性[20]。有研究表明VEGF表达的高低会影响伤口的愈合,成为创面愈合的重要观察指标[21]。在微血管检测方面,发现cd34可同时表达于已存在和新生血管中,故本实验选用主要表达于新生血管中的cd31作为检测指标,并发现联合治疗组创面新生血管出现早且密度较高。
肝素和封闭负压引流联合应用,对于改善海水浸泡后烧伤创面转归的原因可能有以下几点:(1)得益于VSD敷料的保水特性,肝素可大剂量、长时间作用于创面,有助于减轻动物的疼痛,降低动物因应激反应造成的体力消耗;(2)肝素的溶栓、抗凝效果与负压引流相互促进,更能有效地改善组织循环;(3)肝素溶液可避免沉积在VSD敷料内的炎性渗出物形成凝血块,避免管道阻塞,有利于通畅引流。
本研究通过创面大体观察、对比组织含水量、病理及免疫组化切片观察等,发现VSD治疗可有效地减轻海水浸泡后烧伤创面的组织水肿,改善组织微循环,加快坏死组织的清除,促进新生血管的生长,加用肝素溶液湿敷后,改善循环及促进愈合的效果更加明显。表明海水浸泡后早期进行负压封闭引流并进行肝素溶液湿敷可减轻烧烫伤创面的组织损伤,促进创面愈合,对于临床上烧烫伤合并海水浸泡创面的治疗可提供一定的参考依据。
| [1] | 马军, 王甲汉, 李志清, 等. 大鼠烫伤合并海水浸泡后创面病理学改变的特点[J]. 南方医科大学学报,2009, 29 (6) : 1297-9. |
| [2] | 卜海激, 申洪, 朱天岭, 等. 犬海水中火器伤细菌感染定量研究[J]. 第一军医大学学报,2003, 23 (6) : 598-601. |
| [3] | 孙笑非, 虞积耀, 鹿尔训, 等. 兔烧伤合并海水浸泡血流动力学变化[J]. 海军总医院学报,2002, 15 (4) : 193-5. |
| [4] | 王育红, 鹿尔驯, 虞积耀, 等. 海水浸泡腹部开放性损伤对大鼠体液代谢的影响[J]. 第二军医大学学报,2000, 21 (8) : 786-8. |
| [5] | 王大鹏, 孙笑非, 徐华彪, 等. 兔烧伤合并海水浸泡后重要器官的病理变化[J]. 中国兽医学报,2006, 26 (4) : 418-9. |
| [6] | 尹会男, 柴家科, 李利根. 负压创面疗法应用于深Ⅱ度烧伤创面的临床观察[J]. 中华损伤与修复杂志:电子版,2011, 6 (1) : 69-73. |
| [7] | 刘利兵, 于军, 张学策, 等. 新西兰兔烫伤模型的建立[J]. 第四军医大学学报,2009, 30 (1) : 86-8. |
| [8] | Hao XP, Willis JE, Pretlow TG, et al. Loss of fragile histidine triad expression in colorectal carcinomas and premalignant lesions[J]. Cancer Res,2000, 60 (1) : 18-21. |
| [9] | 范子锋, 邱学文, 王甲汉. 烧伤后海水浸泡对机体基本病理生理的影响[J]. 广东医学,2005, 26 (3) : 417-8. |
| [10] | 吕小星, 陈绍宗, 李学拥, 等. 封闭负压引流技术对创周组织水肿及血管通透性的影响[J]. 中国临床康复,2003, 7 (8) : 1244-5. |
| [11] | Mou?s CM, Heule F, Hovius SE. A review of topical negative pressure therapy in wound healing: sufficient evidence?[J]. Am J Surg,2011, 201 (4) : 544-56. DOI: 10.1016/j.amjsurg.2010.04.029. |
| [12] | 韩善桥, 虞积耀, 王大鹏, 等. 烧伤合并海水浸泡动物感染实验研究[J]. 中国卫生检验杂志,2013, 23 (1) : 101-2. |
| [13] | 邱学文, 王甲汉, 盛颖萍, 等. 封闭负压引流对兔深Ⅱ度烫伤创面的促愈合作用[J]. 广东医学,2008, 29 (8) : 1276-8. |
| [14] | Lakshmi TS, Shanmugasundaram NA, Babu M. Efficacy of desulfated heparin mitigating inflammation in rat burn wound model[J]. J Biomed Mater Res B Appl Biomater,2011, 97B (2) : 215-23. DOI: 10.1002/jbm.b.v97b.2. |
| [15] | Lever R, Smailbegovic A, Page CP. Locally available heparin modulates inflammatory cell recruitment in a manner Independent of anticoagulant activity[J]. Eur J Pharmacol,2010, 630 (1/3) : 137-44. |
| [16] | 王慧媛, 王凌峰, 巴特. 肝素促进创面愈合作用的研究进展[J]. 中华临床医师杂志:电子版,2013, 7 (2) : 727-9. |
| [17] | Macig T, Mehrmna T, Friesel R, et al. Heparin binds endothelial cell growth factor, the principal mitogne in the bovinebarin[J]. Scienee,1984, 225 : 932-5. DOI: 10.1126/science.6382607. |
| [18] | Sperinde GV, Nugent MA. Mechanisms of fibroblast growth factor 2 intracellular processing: a kinetic analysis of the role of heparan sulfate proteoglycans[J]. Biochemistry,2000, 39 (13) : 3788-96. DOI: 10.1021/bi992243d. |
| [19] | Green BE, Artz CP. An appraisal of heparin in burns:experimental study[J]. Surg Forum,1959, 10 : 343. |
| [20] | 赵雷, 王莉, 姜叙诚, 等. hVEGF基因工程生物膜对全层皮肤缺损创面愈合的影响[J]. 上海交通大学学报:医学版,2006, 26 (9) : 1015-8. |
| [21] | 许伟榕, 王莉, 赵涵芳, 等. 人血管内皮生长因子基因工程生物膜愈合大鼠皮肤创伤的初步研究[J]. 外科理论与实践,2006, 11 (3) : 244-7. |
 2015, Vol. 35
2015, Vol. 35

