2. 机能实验中心,广东 广州 510182 ;
3. 广东省人民医院//广东省医学科学院//广东省精神卫生中心,广东 广州 510120
2. Functional Experiment Center, Guangzhou Medical University, Guangzhou 510182, China ;
3. Guangdong Mental Health Center, Guang Dong General Hospital, Guangzhou 510120, China
快速眼动(REM)睡眠是睡眠的重要阶段[1],既往临床和动物等研究发现:剥夺REM睡眠后,机体不但学习记忆力功能下降,一些焦虑、易激惹等负面情绪也容易增加[2]。REM睡眠剥夺可能通过改变机体脑内神经递质的水平,进而影响动物的行为[3]。海马是重要的脑区,与学习记忆和情绪密切相关[4]。一氧化氮(NO)作为重要的神经递质和神经调质,与学习记忆、焦虑行为的产生有着密切的联系[5-6]。神经源性一氧化氮合酶(nNOS)、内皮细胞源性一氧化氮合酶(eNOS)和诱导性一氧化氮合酶(iNOS)是NO合成的重要限速酶。在神经系统中,nNOS发挥了在调控情绪等方面发挥了重要的作用[5-6]。
青少年期是由幼年期向成年期过渡的特殊时期。现代社会中,由于工作或学习压力重等各种社会因素,睡眠不足在青少年期人群中广泛存在[7]。人类青少年期约为12~18岁,鼠类的青少年期约为3~4周龄[8]。与成年期相比,青少年期的中枢神经系统突触结构和功能发育有很多特点,如:大脑快速发育,神经突触的过度增长,然后快速剪除[9]。与成年机体相比,青少年REM睡眠频率高、持续时间长。因此REM睡眠对青少年和成年情绪的影响可能不同,但目前无相关研究报道。
本研究通过水平台方法建立REM睡眠剥夺模型,观察比较REMS剥夺对不同年龄段小鼠焦虑行为、海马NO 水平和nNOS 表达的影响,以探讨REM 睡眠对C57BL/6J小鼠焦虑情绪是否有年龄差异,同时探讨其机制。
1 材料与方法 1.1 材料实验动物:正常雄性C57BL/6J小鼠,SPF级。成年期C57BL/6J 小鼠(8~12 周龄)体质量18~24 g,青少年期C57BL/6J 小鼠(3~4 周龄)体质量8~12 g,购自广东省医学实验动物中心。室内温度控制在22.0~24.0 ℃,光/暗周期为12∶12,晨6:00灯光亮。动物每笼5只,自由饮食饮水。
仪器与试剂:高架十字迷宫(BW-DEP207,软隆科技);酶标仪(ELX800UV,美国BioTek);台式高速冷冻离心机(ST16R,德国Thermo);电动匀浆器(F6/10,德国FLUKO);空气浴振荡器(HZQ-C,东明科技);脱色摇床(TS-1000,其林贝尔);BCA 蛋白浓度测定试剂盒(P0012S,碧云天);NO检测试剂盒(S0021,碧云天);兔抗鼠nNOS 抗体(SIGMA);0.9% 氯化钠注射液(H20023145,华仁药业);组织裂解液(Tris-HCl+双蒸水+10% SDS+丙三醇)
1.2 动物模型制作按照随机原则,将青少年期和成年期C57BL/6J小鼠各自分为3个亚组:正常对照组(NC),大平台组(WP)和快速眼动睡眠剥夺(REMSD)组,每组15只。睡眠剥夺期间,正常对照组在鼠笼中饲养并且不做任何干预。WP组动物被置于含有6个圆形的大平台(高10 cm、直径12 cm、高于水面以上0.5 cm)的开口水箱(长70 cm,宽50 cm,高50 cm)内中完成;将布置的平台均间隔4 cm(边到边),小鼠可以自由从一个平台跳跃到另一个平台来实现自由走动但不能同时跨立在两个平台上。大平台上的小鼠可以自由活动及睡眠并不会掉落入水,从而建立了WP模型进行对照。REMSD组动物被置于含有9个圆形的小平台(高10 cm、直径2 cm、高于水面以上0.5 cm)的开口水箱内中,当小鼠站立在小平台上开始进入REMS时,小鼠全身肌肉出现松弛后掉入水中并惊醒,从而建立了REMSD模型。REMS 剥夺时间为上午10:00至次日上午10:00,时间长度为24 h。睡眠剥夺期间灯光持续照射。所有动物在睡眠剥夺结束后进行行为测试(10:00~12:00)
1.3 高架十字迷宫(EMP)实验PSD睡眠剥夺实验结束后,所有动物均需通过高架十字迷宫实验。高架十字迷宫外型呈交叉十字,高于地面72 cm,由2条对称的开放臂(3 cm×5 cm),2条对称的闭合臂(30 cm×5 cm×18 cm)和1个联接四条臂的中间区(5 cm×5 cm)组成,开放臂和中间区完全开放,而闭合臂仅有顶部和近中间区开放;正上方摄像机可见全部区域。实验前小鼠适应测试室的弱光安静环境1 h。将1只小鼠放入中间区(小鼠背向实验者而头朝向任一开放臂)开始实验录像记录,实验者迅速安静离开区域1 m外,允许小鼠在其中自由探索,共历时5 min;每次实验前后清洁迷宫(祛除小鼠遗留的气味避免干扰实验结果),方可进行测试实验。观察并记录①进入开放臂次数(OE),进入任一条开放臂的次数,以鼠的四个爪子全部进入开放臂内为准;②开放臂停留时间(OT);③进入闭合臂次数(CE),进入任一条封闭臂的次数,以鼠的4 个爪子全部进入闭合臂内为准;④闭合臂停留时间(CT)。由①~④分别计算出进入开放臂和闭合臂的总次数(OE+CE);进入开放臂次数比例(OE%),即OE/OE+CE%;开放臂停留时间比例(OT%),即OT/ OT+CT%。
1.4 海马组织样本的制备及蛋白含量测定所有动物高架十字迷宫完毕后,迅速颈椎脱臼处死,冰皿上快速分离出海马体并称质量,在冰水浴下将海马体置于含PMSF的组织裂解液(400∶1)中进行快速间断电动匀浆(25 000 r/min)10 min,匀浆后4 ℃低温高速离心(12 000 r/min)5 min,取其上清液置于-80 ℃超低温冰箱待用。使用BCA蛋白浓度测定试剂盒按说明书步骤将标准样和上清液样本分别按0、1、2、4、8、12、16、20 μL加到96孔板中并用组织裂解液补足到20 μL,然后加入200 μL BCA工作液,37 ℃空气浴振荡器中放置20~30 min。最后使用波长570 nm的酶标仪测定各孔吸光度,绘制标准曲线并计算出上清液的蛋白浓度。
1.5 海马NO水平检测根据各组上清液蛋白浓度,用组织裂解液将其调整一致。各组上清液蛋白浓度调整一致后,使用NO检测试剂盒按说明书步骤将标准样品按0、10、20、40、60、80、100 μmol/L浓度各50 μL和上清液样本50 μL加到96孔板中,在各孔中加入50 μL室温Griess Reagent I。然后各孔中再加入室温Griess Reagent II并摇匀,最后使用波长570 nm的酶标仪测定各孔吸光度,绘制标准曲线计算出各组上清液中NO水平。
1.6 Western blot检测海马nNOS表达根据各组上清液蛋白浓度,用组织裂解液将其调整一致。计算含50 μg蛋白的上清液样本为上样量,加入5×SDS上样缓冲液稀释至终浓度为1×(上样总体积一般在15~20 μL),上样前要将上清液样品于沸水中煮5~10 min使蛋白变性。用制胶板配置好下层5%浓缩胶和上层12%分离胶,每孔加20 μL样品进行SDS-PAGE电泳,然后取出胶后按顺序叠加PVDF膜,在转膜槽中将蛋白转膜至PVDF膜上,PVDF膜在TBS缓冲液清洗后置于5%脱脂奶粉中常温封闭2 h,而后予兔抗鼠nNOS(1∶50)摇床上4 ℃过夜。予羊抗兔二抗(1∶50)摇床上常温2 h,将处理好的PVDF膜侵泡在发光液中1 min,最后在暗室中曝光洗胶片后拍照。通过Quatity 4.5软件进行光密度分析。
1.7 统计学方法数据采用SPSS 17.0统计软件进行统计分析。结果以均数±标准差表示。对青少年期和成年期C57BL/ 6J小鼠的进臂总次数,进入开放臂次数和时间、进入封闭臂次数和时间以及海马NO水平和nNOS表达进行正态分布检验,如果为正态分布,则采用ANOVA检验每个亚组间是否有显著性差异,之后两组组间比较采用LSD方法;如果为非正态分布,则采用Kruskal-Wallis Test秩和检验,两组组间比较采用两样本的秩和检验。 P<0.05为差异有统计学意义。
2 结果 2.1 高架十字迷宫结果 2.1.1 总体活动情况在青少年期C57BL/6J小鼠中,3个亚组进臂总次数无显著性差异(P>0.05,表 1)。
| 表 1 青少年期与成年期C57BL/6J小鼠各组间的进臂总次数的差异 Table 1 Difference of total number of arm entries in subgroups of adolescent and adult C57BL/6J mice(Mean±SD) |
成年期REMSD组C57BL/6J小鼠进臂总次数显著高于NC组(χ2=6.8,P<0.01)和WP组(χ2=8.4,P<0.01)。进臂总次数,而NC组和WP组两组间无明显差异(χ2=13.4,P>0.05,表 1)。
2.1.2 开臂活动青少年期C57BL/6J小鼠REMSD组、WP组和NC组的开臂进入次数,开臂进入次数占总进臂次数百分比,开臂停留时间和开臂停留时间占总时间百分比均无明显差异(P>0.05,表 2)。
| 表 2 青少年期与成年期C57BL/6J小鼠各组间的进入开放臂次数、进入开放臂次数/进臂总次数(%)、开放臂停留时间(s)、开放臂停留时间/进臂总时间(%)的差异 Table 2 Difference of number of open arm entries、percentage of number of open arm entries、open arm time, percentage of open arm time in adolescent and adult C57BL/6J mice(Mean±SD) |
在成年期C57BL/6J 小鼠中,REMSD组小鼠开臂进入次数显著高于NC组(χ2=3.8,P<0.05)。与NC组和WP组相比,REMSD组小鼠开臂进入次数占总进臂次数百分比明显降低(χ2=20.8,P<0.01);REMSD组小鼠开臂停留时间显著低于NC 组和WP 组(χ2=16.1,P<0.01),WP组与NC组小鼠开臂停留时间无显著差异(χ2=9.9,P>0.05);与NC组和WP组相比,REMSD组小鼠开臂停留时间占总时间百分比明显降低(χ2=16.1,P<0.01,表 2)。
2.1.3 闭臂活动青少年期C57BL/6J小鼠REMSD组、WP组和NC组的闭合臂进入次数,闭合臂进入次数占总进臂次数百分比,闭合臂停留时间和闭合臂停留时间占总时间百分比均无明显差异(表 3)。
| 表 3 青少年期与成年期C57BL/6J小鼠各组间进入闭合臂次数、进入闭合臂次数/总进臂次数比例(%)、闭合臂停留时间(s)、闭合臂停留时间/进臂总时间(%)的差异 Table 3 Difference of number of closed arm entries、percentage of number of closed arm entries、closed arm time, percentage of closed arm time in adolescent and adult C57BL/6J mice(Mean±SD) |
在成年期C57BL/6J 小鼠中,REMSD组小鼠闭合臂进入次数显著高于NC组(χ2=3.8,P<0.05)和WP组(χ2=2.5,P<0.01)。NC组和WP组小鼠闭合臂进入次数无显著差异(χ2=9.8,P>0.05);与NC 组和WP 组相比,REMSD组小鼠闭合臂进入次数占总进臂次数百分比明显增高(χ2=20.8,P<0.01);REMSD组小鼠闭合臂停留时间显著高于NC组(χ2=4.7,P<0.01)和WP组(χ2=10.6,P<0.01)。NC组和WP组小鼠闭合臂停留时间无显著差异(χ2=7.4,P>0.05);与NC 组和WP 组相比,REMSD组小鼠闭合臂停留时间占总时间百分比明显增高(χ2=6.1,P<0.01,表 3)。
2.1.4 NO检测结果青少年期C57BL/6J 小鼠的海马中,REMSD组中NO水平明显高于NC组和WP组,且有显著性差异(P<0.05,表 4)。NC组与WP组的NO水平未见显著性差异(P>0.05)。成年期C57BL/6J小鼠的海马中,各亚组间NO水平未见显著性差异(表 4)。
| 表 4 各组C57小鼠海马的NO水平 Table 4 Nitric oxide level in hippocampus in subgroups of adolescent and adult C57BL/6J mice(Mean±SD, n=15) |
在青少年期和成年C57BL/6J小鼠海马中,均可发现nNOS的表达。青少年期C57BL/6J小鼠的海马中,REMSD组中nNOS表达明显高于NC组和WP组,且有显著性差异(P<0.05,图 1);NC组与WP组的nNOS表达未见显著性差异。成年期C57BL/6J小鼠的海马中,各亚组间nNOS表达未见显著性差异(图 1)。
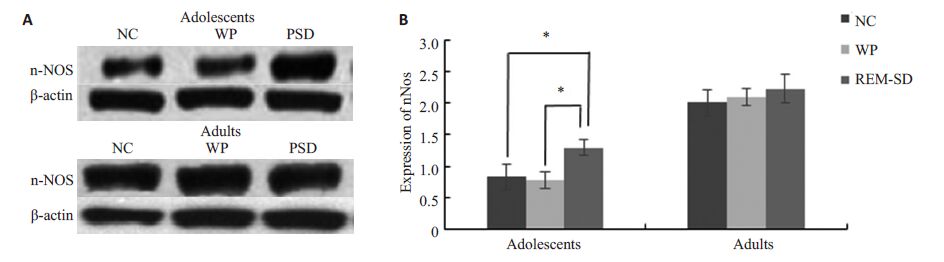
|
图 1 青少年期与成年期C57BL/6J小鼠各组海马nNOS蛋白表达 Figure 1 Western blotting of nNOS protein expression in subgroups of adolescent and adult C57BL/6J mice NC: normal control group. WP: wide platform group; REMSD: REM sleep deprivation 24 h group *P<0.01. |
目前许多研究发现:由于学习压力、网络成瘾等多种因素,青少年睡眠不足广泛存在。大量临床和动物研究结果都表明睡眠不足导致机体焦虑,但是关于睡眠不足青少年和成年的焦虑行为的影响有何差异,目前研究并不多。Talbot等[10]的临床研究发现:短暂限制青少年和成年人睡眠时间少于6.5 h后,这两个人群的焦虑程度都有增高;进一步研究发现,青少年由于睡眠不足导致的焦虑程度明显低于成年人。本研究结果发现:REM睡眠剥夺24 h导致成年期动物焦虑行为和自发行为增多,而对青少年期动物的焦虑行为影响不显著。尽管本研究结果和临床研究所采用的实验对象、实验方法等有很多差异。如,临床研究剥夺的是REM和NREM睡眠,而本研究只剥夺了REM睡眠。但是临床实验和本研究结构都提示:睡眠对焦虑的影响程度与年龄相关。也就是说,睡眠不足导致青少年焦虑情绪和行为明显低于成年。睡眠剥夺对青少年和成年动物焦虑行为影响程度不同,可能和神经系统发育的结构和功能相关。与成年神经系统相比,青少年期神经系统的突触数量比较多,形态多样[11];此外,神经递质水平和受体表达也有很大差异,如青少年期海马、前额叶皮质、杏仁核等脑区的多巴胺受体数量明显高于成年期[12]。在睡眠剥夺期间,青少年期脑内分子水平的变化与成年脑不同,可能是机体焦虑行为改变有所差异的分子生物学机制。
3.2 REM 睡眠剥夺24 h对青少年期和成年期C57BL/ 6J小鼠海马NO水平和nNOS蛋白表达的影响既往研究发现NO在调控焦虑情绪和行为等方面发挥了重要的作用[5-6]。Volke[13]通过腹腔注射抑制nNOS活性后,小鼠在闭臂停留时间明显延长,说明NO可以减轻动物的焦虑。NO在调控睡眠中也发挥了重要的作用。在成年大鼠,持续6 h缺氧引起的睡眠缺乏可以导致海马内NO水平明显增高[14],通过抚触剥夺大鼠正常睡眠6 h,可以发现大鼠前额叶皮质、中脑等脑区NO水平升高,但海马内NO水平未发现明显变化[15-16]。以上研究使用的实验方法剥夺了所有时相的睡眠,即REM和NREM睡眠。在本研究中,我们采取水平台法特异性剥夺REM睡眠24 h,结果发现青少年期小鼠海马NO水平升高,nNOS蛋白表达增强;而成年大鼠海马内NO和nNOS均无明显改变。需要注意的是,REM睡眠剥夺也可以导致氧应激,产生大量的活性氧,少量NO通过和活性氧结合,生成适量过氧亚硝酸盐(ONOO▔),对神经元有一定的保护作用[17]。因此,在青少年期,海马NO水平和nNOS表达轻度增高,可能会适量中和活性氧,减少焦虑情绪和行为。但是,需要注意的是,过量的NO可以导致细胞内ONOO▔过度积存,抑制线粒体活性,导致神经元凋亡和死亡。在本研究中,我们只剥夺小鼠REM睡眠24 h,因此,有必要进一步探讨延长REM睡眠剥夺时间后,青少年期和成年期小鼠焦虑行为、海马内NO水平的改变。
综上所述,REM睡眠剥夺24 h 对青少年期小鼠与成年小鼠焦虑行为的影响程度不同,而海马内NO水平和nNOS变化的差异是其可能机制之一。
| [1] | Urbano FJ, D, onofrio SM, Luster BR, et al. Pedunculopontine nucleus gamma band activity-preconscious awareness, waking and REM sleep[J]. Front Neurol,2014, 5 (2) : 210. |
| [2] | Suchecki D, Tiba PA, Tufik S. Hormonal and behavioural responses of paradoxical sleep-deprived rats to the elevated plus maze[J]. J Neuroendocrinol,2002, 14 (7) : 549-54. DOI: 10.1046/j.1365-2826.2002.00812.x. |
| [3] | Berro LF, Santos R, Hollais AW, et al. Acute total sleep deprivation potentiates cocaine-induced hyperlocomotion in mice[J]. Neurosci Lett,2014, 579 (2) : 130-3. |
| [4] | Bannerman DM, Rawlins JN, Mchugh SB, et al. Regional dissociations within the hippocampus--memory and anxiety[J]. Neurosci Biobehav Rev,2004, 28 (3) : 273-83. DOI: 10.1016/j.neubiorev.2004.03.004. |
| [5] | Moosavi M, Abbasi L, Zarifkar A, et al. The role of nitric oxide in spatial memory stages, hippocampal ERK and CaMKII phosphorylation[J]. Pharmacol Biochem Behav,2014, 122 (2) : 164-72. |
| [6] | Sestakova N, Puzserova A, Kluknavsky M, et al. Determination of motor activity and anxiety-related behaviour in rodents: methodological aspects and role of nitric oxide[J]. Interdiscip Toxicol,2013, 6 (3) : 126-35. |
| [7] | 张斌, 郝彦利, 任衍镇. 广州市小学生的学业成绩与睡眠状况的相关性研究[J]. 中国心理卫生杂志,2013, 27 (6) : 462-7. |
| [8] | Spear LP. The adolescent brain and age-related behavioral manifestations[J]. Neurosci Biobehav Rev,2000, 24 (4) : 417-63. DOI: 10.1016/S0149-7634(00)00014-2. |
| [9] | Alkadhi K, Zagaar M, Alhaider I, et al. Neurobiological Consequences of sleep deprivation[J]. Curr Neuropharmacol,2013, 11 (3) : 231-49. DOI: 10.2174/1570159X11311030001. |
| [10] | Talbot LS, Mcglinchey EL, Kaplan KA, et al. Sleep deprivation in adolescents and adults: changes in affect[J]. Emotion,2010, 10 (6) : 831-41. DOI: 10.1037/a0020138. |
| [11] | Negrón-Oyarzo I, Pérez Má, Terreros G, et al. Effects of chronic stress in adolescence on learned fear, anxiety, and synaptic transmission in the rat prelimbic cortex[J]. Behav Brain Res,2014, 259 : 342-53. DOI: 10.1016/j.bbr.2013.11.001. |
| [12] | Mastwal S, Ye Y, Ren M, et al. Phasic dopamine neuron activity elicits unique mesofrontal plasticity in adolescence[J]. J Neurosci,2014, 34 (29) : 9484-96. DOI: 10.1523/JNEUROSCI.1114-14.2014. |
| [13] | Volke V, Soosaar A, Kõks S, et al. 7-Nitroindazole, a nitric oxide synthase inhibitor, has anxiolytic-like properties in exploratory models of anxiety[J]. Psychopharmacology (Berl),1997, 131 (4) : 399-405. DOI: 10.1007/s002130050309. |
| [14] | Ramanathan L, Siegel JM. Sleep deprivation under sustained hypoxia protects against oxidative stress[J]. Free Radic Biol Med,2011, 51 (10) : 1842-8. DOI: 10.1016/j.freeradbiomed.2011.08.016. |
| [15] | Kalinchuk AV, Mccarley RW, Porkka-Heiskanen T, et al. Sleep deprivation triggers inducible nitric oxide-dependent nitric oxide production in wake-active basal forebrain neurons[J]. J Neurosci,2010, 30 (40) : 13254-64. DOI: 10.1523/JNEUROSCI.0014-10.2010. |
| [16] | Colas D, Bezin L, Gharib A, et al. REM sleep control during aging in SAM mice: a role for inducible nitric oxide synthase[J]. Neurobiol Aging,2005, 26 (10) : 1375-84. DOI: 10.1016/j.neurobiolaging.2004.11.002. |
| [17] | Masood A, Banerjee B, Vijayan VK, et al. Modulation of stress-induced neurobehavioral changes by nitric oxide in rats[J]. Eur J Pharmacol,2003, 458 (1/2) : 135-9. |
 2015, Vol. 35
2015, Vol. 35

