2. 西门子(中国)有限公司医疗业务领域磁共振事业部,北京 100102
2. Group of MR Business, China Healthcare Sector, Siemens Ltd., Beijing 100102, China
随着临床上3T高场强磁共振成像扫描仪的应用,膝关节软骨磁共振成像得到明显提高。同时由于更高的静态磁场强度,更高的梯度强度,以及专用线圈如相控阵线圈等技术的利用使关节软骨的高分辨成像在较短的时间内成像成为可能。目前基质诱导的自体软骨细胞移植技术(MACI)已经被用于临床[1-3]。因此临床需要1 种能够无创并定量评估移植软骨修复过程中的生化指标变化的技术。其中,软骨延迟增强磁共振成像(dGEMRIC)技术已被一些科学和临床试验证实,可以定量评估关节软骨的糖胺聚糖(GAG)的含量[4-6]。而GAG的变化不仅可以反应移植软骨的生化信息也可以评价软骨移植物成熟度,可以作为评价软骨的生物标志物。
国内尚无关于MACI术后移植软骨GAG的深浅层分布的体内成像研究,也没有长期随访观察GAG含量变化的相关研究。本文利用dGEMRIC技术动态随访评估移植软骨的GAG深浅层分布及变化规律。
1 对象与方法 1.1 研究对象7例膝关节MACI术的患者接受了术后MRI随访评估,其中女4例,男3例;27~52岁(45±3.28岁),共对11膝14处软骨损伤进行评估,软骨缺损位于:股骨滑车4处,股骨内侧髁4处,髌骨6处。软骨缺损面积在关节镜检下评估,平均缺损面积约为:1.899±0.298 cm2/处(0.8~5.0 cm2,n=14)。所有的患者在术后3、6和12月进行3 次dGEMRIC扫描。所有患者都签署了知情同意书,无MRI检查相关禁忌症及对造影剂过敏。
1.2 图像采集(1)采用15 通道膝关节线圈在3T磁共振扫描仪(Siemens,Skyra)对患者进行扫描。扫描时膝关节位于线圈中央,采用脚先进、仰卧位模式。扫描序列包括矢状位3D-VIBE、高分辨矢状位、横轴位、冠状位FS-PDWI[7],矢状位打药前以及打药后T1 mapping 序列。根据Burstein[8]等的研究,膝关节软骨增强扫描静脉注射用0.2 mmol/kg 的钆喷酸葡胺(Gd-DTPA2-),并于注射后病人适度匀速步行20 min,90 min后采集打药后T1 mapping图像。尽量保持打药前后扫描位置一致;(2)成像参数如下:矢状位3D-VIBE:TR 11.6 ms,TE5.44 ms,FOV 150 mm×150 mm,矩阵381×448,扫描时间5 min 27 s;高分辨矢状位FS-PDWI:TR 3000 ms,TE 31 ms,FOV 140 mm×140 mm,矩阵336×448,扫描时间4 min 44 s;高分辨横轴位FS-PDWI:TR 3790 ms,TE 31 ms,FOV 140 mm×140 mm,矩阵336×448,扫描时间4 min 27 s;高分辨冠状位FS-PDWI:TR 2400 ms,TE 35 ms,FOV 140 mm×140 mm,矩阵381×448,扫描时间4 min 42 s[7];T1 mapping:TR 15 ms,TE 2.7 ms,FOV 160 mm×160 mm,矩阵384×384,扫描时间5 min37 s。
1.3 数据分析(1)所有MR 图像数据传送至Siemens syngo workplace 后处理工作站,并自动生成T1 map伪彩图,由两名影像诊断医生进行双盲测量数据并记录,共同讨论得出一致结果;(2)结合外科手术记录、矢状位3D-VIBE、 高分辨矢状位FS-PDWI选择显示移植软骨最佳层面并勾勒出感兴趣区。感兴趣区应该包括移植软骨及邻近正常对照区(在3D-VIBE序列上厚度正常、表面完整、 无信号改变的正常软骨)(图 1)。感兴趣区数据测量应该包括软骨全层并进行深浅层评估。根据Katja Pinker[9] 的研究感兴趣区软骨深浅层的厚度应该大致一致。感兴趣区数据应连续测量3次打药前、打药后T1值并求平均值。各时间点感兴趣尽量放在同一位置(图 2);(3)各时间点感兴趣区的△R1 值计算如下:R1pre=1/T1pre R1post=1/T1post △R1=R1post-R1pre。
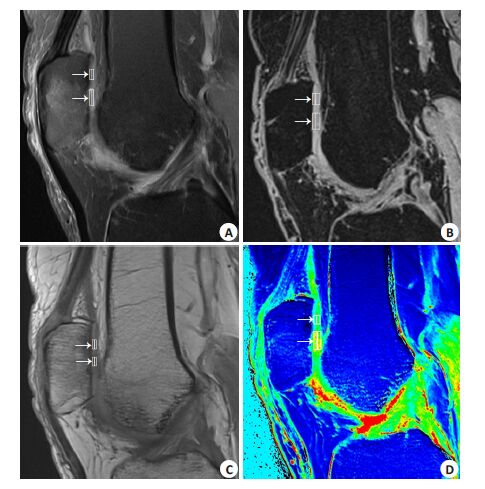
|
图 1 同一个患者髌软骨MACI术后3月的FS-PDWI图像(A)、3D-VIBE图像 (B)、T1 map解剖图(C)、打药前的T1 map伪彩图(D) Figure 1 FS-PDWI image (A), 3D-VIBE image (B), T1 anatomical image (C) and pre-contrast T1 map (D) between reparative and normal patellar cartilage of a patient 3 months after MACI. Arrows present reparative and normal cartilage. |
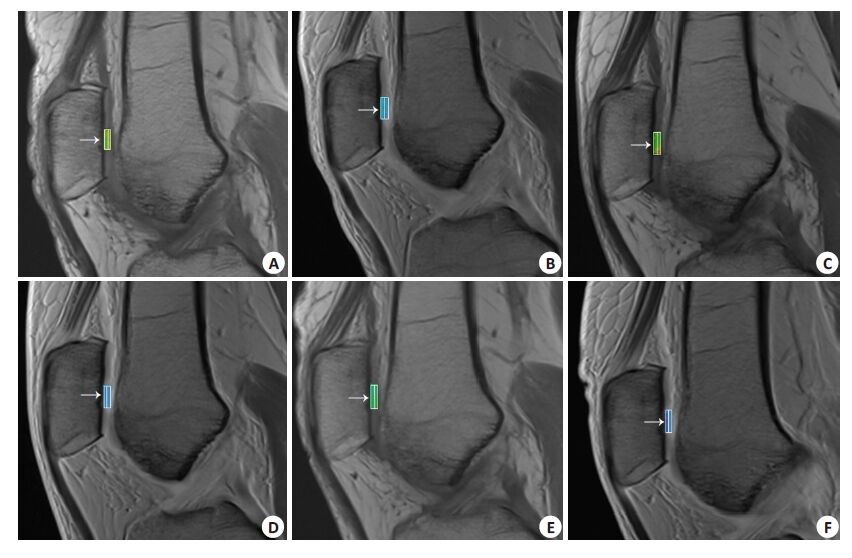
|
图 2 同一个患者髌软骨MACI术后3 (A、B)、6 (C、D)、12 (E、F)月打药前后的T1 map图 Figure 2 Pre-contrast T1 and post-contrast T1 map of one patient at 3 months (A, B), 6 months (C, D) and 12 months (E, F) after MACI. A, C, E: Pre-contrast T1 map; B, D, F: Post-contrast T1 map.) Arrows indicate the area of reparative cartilage. |
采用SPSS16.0软件进行统计分析,用均数±标准差描述计量资料。各时间点移植软骨与正常软骨的全层及深浅层△R1值的比较采用配对t检验;纵向比较软骨移植区各时间点间深浅层△R1值差异采用单因素方差分析。P<0.05时差异具有统计学意义。
2 结果MACI术后各时间点移植软骨全层△R1值均高于正常对照区,差异具有统计学意义(P<0.05,表 1)。 MACI术后各时间点移植软骨和正常对照区软骨深浅层△R1值差异均具有统计学意义,表现为△R1值由深层到浅层逐渐增高(P<0.05,表 1)。
MACI术后各时间点间移植软骨深浅层△R1值纵向评估发现,随时间延长,移植软骨深浅层△R1值逐渐下降,趋近于正常软骨(图 3)。术后3个月与6个月软骨移植区△R1差异不具有统计学意义(P>0.05)。术后3 个月与12个月、6个月与12个月软骨移植区△R1差异具有统计学意义(P<0.05,表 1)。
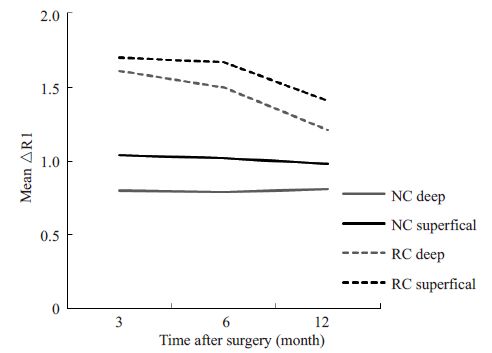
|
图 3 MACI术后移植软骨与正常软骨△R1值深浅层的纵向比较 Figure 3 Longitudinal Evaluation of the zonal △R1 values between repair cartilage and normal cartilage after MACI. |
| 表 1 MACI术后各时间点移植软骨与正常软骨△R1值的全层和深浅层比较 Table 1 Mean global and zonal (deep and superficial) △R1 values for reparative cartilage (RC) and normal cartilage (NC) at 3, 6, and 12 months after MACI |
关节软骨由于缺乏血管、淋巴、和神经,一旦损伤, 自我修复能力非常有限。传统手术方法如关节腔清理术,微骨折术、钻孔术等术式,术后检查显示修复的软骨多为纤维软骨,临床效果随时间的延长而降低[10-11]。 MACI 是采用取自患者非承重区自体的关节软骨,在体外分离出软骨细胞,培养扩增后接种在Ⅰ/Ⅲ型胶原膜上。移植前修剪成与缺损部位相应的形状,用生物蛋白胶将胶原膜粘贴在关节软骨缺损处[7]。MACI术易形成透明样软骨,具有较好的远期临床效果。临床上评估MACI术后移植软骨的金标准是关节镜下组织活检,然而关节镜检查是有创检查,不能被大多数患者接受。 MRI已经被证明可以评估关节软骨的生化组成,其中dGEMRIC技术可以间接评估关节软骨GAG的含量及分布特征,原理为:GAG含有大量带负电荷的羧基和硫酸酯基团,构成软骨固定电荷的主要组成成分。而Gd-DTPA2-也相应地带负电荷,在静脉注射并给予充分时间后高浓度的Gd-DTPA2-存在于相应GAG含量少的软骨基质中。根据相关断面解剖研究证实,GAG并不是均匀分布的,而是具有深浅层的分布特点[4-5, 12]。因此由Gd-DTPA2-浓度决定的T1 值可以特异性,间接地反应软骨组织糖GAG 的含量及分布特征[6, 13-14]。 Watanabe等[15]在用dGEMRIC技术评估软骨移植区的GAG含量时发现,GAG含量与△R1值显著负相关。因此本项研究将采用△R1值评估GAG分布及变化规律。
本研究发现MACI术后3、6月移植软骨△R1值明显高于正常软骨,表明移植软骨的GAG含量低于正常软骨。随着时间延长,至术后12月,移植软骨△R1值较前明显下降,表明移植软骨GAG含量呈逐渐的增多趋势, 提示移植软骨处在成熟的过程;但是术后12月移植软骨△R1值较正常软骨仍较高,说明GAG含量及移植软骨成熟度要恢复至正常水平需要更长时间。Gills A[16] 在对ACI术后移植软骨GAG含量变化的研究中也发现ACI术后6月内随访组的移植软骨GAG含量明显低于正常软骨,但是术后12个月随访的移植软骨GAG含量与正常软骨相似,这与本项研究12月份及Watanabe[15] 的研究结果不一致,Watanabe在ACI术后平均22.7月(13~38 个月)随访中发现,移植软骨含量低于正常软骨,认为Gills A等只是扫描了打药后的T1 map图,因而高估了GAG的含量。相关的组织学及临床资料已经证明移植软骨的成熟是一个长期的过程,GAG含量的增多及移植软骨的重构需要至少1年以上的时间[17]。
之前关于关节软骨△R1值深浅层变化的研究,相对较少。Nieminen等[6]研究发现正常透明软骨GAG分布并不均匀,具有空间分布的特点,表现为GAG含量从深层到浅层减少。在本项研究中,我们可以看到各时间点正常软骨△R1值从深层到浅层增加,间接地反映了GAG含量从深层到浅层逐渐减少。至于移植软骨区的△R1值深浅层变化,本项研究各时间点移植软骨深层△R1值均小于浅层,差异具有统计学意义。而Pinker 等[9]于术后1 年随访发现移植软骨深层△R1 值较浅层小,但是深浅层变化无统计学意义,与本研究结果有差异,针对异同点分析原因可能为:(1)Newman等[18]研究发现移植物在术后2到4周内主要为合成软骨基质,2 到6月内移植物修复进入修复最终阶段,合成更多的透明软骨。由于2个月后移植物中就有透明软骨形成,因此可以解释MACI术后3个月后各时间点移植软骨深层△R1值小于浅层(2)而Briggs等[19]在研究ACI术后1 年移植软骨的组织学特征,发现其中6例为透明软骨,2 例为透明和纤维软骨混合物,说明移植软骨的恢复成熟度可不一,这可能是导致两项研究移植软骨深浅层△ R1值差异有无统计学意义的原因。
本研究的局限性首先是随访时间短,缺乏MACI术后12月后的移植软骨△R1值数据,其次是样本量少,尤其需要扩充样本量来验证移植软骨△R1值的深浅层变化可以反映移植软骨的恢复成熟度,最后是缺乏组织病理依据,由于患者拒绝关节镜检,因此后期补充动物实验,弥补本实验的不足。
综上,MACI术后各时间点移植软骨△R1值高于正常软骨,并随时间延长,移植软骨△R1值呈逐渐下降的趋势,同时移植软骨△R1值表现为从深层到浅层逐渐增高,提示移植软骨处在重塑并成熟的过程。 dGEMRIC技术可以通过测量△R1值的变化,间接反映移植软骨GAG的空间变化,因此dGEMRIC技术可以提供移植软骨的生化信息,对于评估MACI术后软骨修复过程具有可行性,同时由于较合适的扫描时间能够被临床所接受。
| [1] | Marlovits S, Zeller P, Singer P, et al. Cartilage repair: generations of autologous chondrocyte transplantation[J]. Eur J Radiol,2006, 57 (1) : 24-31. DOI: 10.1016/j.ejrad.2005.08.009. |
| [2] | Marcacci M, Berruto M, Brocchetta D, et al. Articular cartilage engineering with Hyalograft C: 3-year clinical results[J]. Clin Orthop Relat Res,2005 (435) : 96-105. |
| [3] | Minas T, Chiu R. Autologous chondrocyte implantation[J]. Am J Knee Surg,2000, 13 (1) : 41-50. |
| [4] | Bashir A, Gray ML, Boutin RD, et al. Glycosaminoglycan in articular cartilage: in vivo assessment with delayed Gd(DTPA) (2-)-enhanced Mr imaging[J]. Radiology,1997, 205 (2) : 551-8. DOI: 10.1148/radiology.205.2.9356644. |
| [5] | Bashir A, Gray ML, Hartke J, et al. Nondestructive imaging of human cartilage glycosaminoglycan concentration by MRI[J]. Magn Reson Med,1999, 41 (5) : 857-65. DOI: 10.1002/(ISSN)1522-2594. |
| [6] | Nieminen MT, Rieppo J, Silvennoinen J, et al. Spatial assessment of articular cartilage proteoglycans with Gd-DTPA-enhanced T1 imaging[J]. Magn Reson Med,2002, 48 (4) : 640-8. DOI: 10.1002/mrm.10273. |
| [7] | 张君, 徐贤, 李雪, 等. 基质诱导的自体软骨移植术后3T磁共振T2mapping成像对移植软骨的分层定量评价[J]. 南方医科大学学报,2015, 35 (1) : 141-5. |
| [8] | Burstein D, Velyvis J, Scott KT, et al. Protocol issues for delayed Gd (DTPA) (2-)-enhanced MRI (dGEMRIC) for clinical evaluation of articular cartilage[J]. Magn Reson Med,2001, 45 (1) : 36-41. DOI: 10.1002/(ISSN)1522-2594. |
| [9] | Pinker K, Szomolanyi P, Welsch GC, et al. Longitudinal evaluation of cartilage composition of matrix-associated autologous chondrocyte transplants with 3-T delayed gadolinium-enhanced MRI of cartilage[J]. AJR Am J Roentgenol,2008, 191 (5) : 1391-6. DOI: 10.2214/AJR.07.3930. |
| [10] | 钟心, 张仲文, 王宏, 等. MRI随访观察膝关节基质诱导的自体软骨细胞移植术后2年[J]. 中国医学影像技术,2012, 28 (6) : 1199-203. |
| [11] | 张仲文, 侯世科, 杨造成, 等. 基质诱导的自体软骨细胞移植术修复膝关节软骨缺损10例术后2年的随访[J]. 中华关节外科杂志:电子版,2010, 4 (6) : 734-41. |
| [12] | Huber M, Trattnig S, Lintner F. Anatomy, biochemistry, and physiology of articular cartilage[J]. Invest Radiol,2000, 35 (10) : 573-80. DOI: 10.1097/00004424-200010000-00003. |
| [13] | Trattnig S, Mlynárik V, Breitenseher M, et al. MRI visualization of proteoglycan depletion in articular cartilage via intravenous administration of Gd-DTPA[J]. Magn Reson Imaging,1999, 17 (4) : 577-83. DOI: 10.1016/S0730-725X(98)00215-X. |
| [14] | Petersen EF, Fishbein KW, Laouar L, et al. Ex vivo magnetic resonance microscopy of an osteochondral transfer[J]. J Magn Reson Imaging,2003, 17 (5) : 603-8. DOI: 10.1002/(ISSN)1522-2586. |
| [15] | Watanabe A, Wada Y, Obata T, et al. Delayed gadolinium-enhanced Mr to determine glycosaminoglycan concentration in reparative cartilage after autologous chondrocyte implantation: preliminary results[J]. Radiology,2006, 239 (1) : 201-8. DOI: 10.1148/radiol.2383050173. |
| [16] | Gillis A, Bashir A, Mckeon B, et al. Magnetic resonance imaging of relative glycosaminoglycan distribution in patients with autologous chondrocyte transplants[J]. Invest Radiol,2001, 36 (12) : 743-8. DOI: 10.1097/00004424-200112000-00010. |
| [17] | Tins BJ, Mccall IW, Takahashi T, et al. Autologous chondrocyte implantation in knee joint: Mr imaging and histologic features at 1-year follow-up[J]. Radiology,2005, 234 (2) : 501-8. DOI: 10.1148/radiol.2342031970. |
| [18] | Newman AP. Articular cartilage repair[J]. Am J Sports Med,1998, 26 (2) : 309-24. |
| [19] | Briggs TW, Mahroof S, David LA, et al. Histological evaluation of chondral defects after autologous chondrocyte implantation of the knee[J]. J Bone Joint Surg Br,2003, 85 (7) : 1077-83. DOI: 10.1302/0301-620X.85B7.13672. |
 2015, Vol. 35
2015, Vol. 35

