2. 北京军区第264 医院内分泌科,山西 太原 030000 ;
3. 解放军309医院肿瘤科,北京 100091 ;
4. 解放军总医院肿瘤科, 北京 100853 ;
5. 解放军61213部队,山西 临汾 041000
2. Department ofEndocrinology, 264 Hospital of Beijing Military Command, Taiyuan 030000, China ;
3. Department of Medical Oncology, 309 Hospital of PLA, Beijing 100091, China ;
4. Department of Medical Oncology, General Hospital of PLA, Beijing 100853, China ;
5. No.61213 Troop of PLA, Linfeng 041000, China
Bcl-6蛋白和bcl-2蛋白同属于B淋巴细胞瘤蛋白家族,研究证明该家族基因主要参与细胞的凋亡过程,其中包括促进细胞凋亡的一组基因和抑制细胞凋亡的一组基因,bcl-6与bcl-2基因功能相似,在细胞的生理过程中发挥抑制凋亡的作用[2];不仅如此,bcl-6是一种转录抑制因子[3],其通过调控多种靶基因表达参与调控细胞的活化[4]、分化[5]和增殖[6]等过程;同时还参与细胞周期调控[7]及DNA损伤修复[8]。
近期研究发现,bcl-6基因除了与多种淋巴瘤密切相关外还与多种实体肿瘤的发生、发展密切相关,如乳腺癌[9-10]、多形性胶质母细胞瘤[11]、结肠癌[12]和胆囊癌[13]等。由于bcl-6在肿瘤发生发展中的作用被认识,其调控机制也成为研究中的热点。研究发现bcl-6表达不但受到转录因子[14]和细胞因子的调控[15],同时也受到miRNA的转录后调控,例如:miRNA-127[6]。但是现在发现的靶向bcl-6的miRNA还比较少,其调控网络有待于进一步研究充实。在miRNA 研究中目的基因的3'UTR区报告质粒和表达载体必不可少。本实验中,我们通过基因克隆技术构建bcl-6基因的野生型3'UTR区报告质粒和bcl-6基因的表达载体,为下一步筛选新的直接靶向bcl-6的miRNA奠定实验基础。
1 材料和方法 1.1 材料人胚肾293T 细胞、人肝细胞癌HepG2 细胞、pcDNA3.0-miR-127 质粒、空载体pcDNA3.0-FLAG和pcDNA3.0-Luc由解放军总医院肿瘤内科保存,大肠杆菌感受态DH5α购自康为世纪生物科技有限公司。Prime STAR HS DNA Polymerase、限制性核酸内切酶(EcoRⅠ、XbaⅠ、KpnⅠ、XhoⅠ)、T4连接酶购自TaKaRa公司;真核细胞质粒小量提取试剂盒、荧光素酶报告基因底物为Promega公司产品;PCR产物琼脂糖凝胶回收试剂盒采购自北京天根生物科技有限公司;转染试剂VigoFect 购自威格拉斯生物技术有限公司;兔抗人bcl-6 单克隆抗体、兔抗人Cyclin D1 单克隆抗体购自Abcam公司;兔抗人GAPDH单克隆抗体、辣根过氧化物酶偶联的山羊抗兔IgG购自Santa Cruz公司;辣根过氧化物酶偶联的抗FLAG 抗体购自Sigma 公司;miR-127 inhibitor 为Qiagen公司产品。测序由北京博迈德技术有限公司完成。引物合成来自北京赛百盛生物技术有限公司。其余化学试剂为国产分析纯产品。
1.2 方法 1.2.1 bcl-6 3'UTR区及其表达载体重组质粒的构建查询TARGET(www.targetscan.org)和PUBMED(www.pubmed.com)分别获得bcl-6 3'UTR 区序列和bcl-6 基因CDS区序列,设计并合成引物如下:bcl-6 3'UTR区:(上游)5'-CGGAATTCAGCATGGAGTGTTGATGCTTTCGTCTCCA-3';(下游)5'-GCTCTAGACCAGTTTGACTTTTCAACATTTTATTCTTATA-3'。bcl-6 表达载体:(上游)5'-GGGGTACCATGGCCTCGCCGGCTGACAGCTGTATC-3';(下游)5'-CCGCTCGAGTCAGCAGGCTTTGGGGAGCTCCGGAG-3',突变体bcl-63'UTR 区:(上游):5'-GACTCGAAGTGTCTGCCTGCAGATACAAAATCGAGCCT-3';(下游):5'-AGGCTCGATTTTGTATCTGCAGGCAGACACTTCGAGTC-3',下划线为酶切位点,加粗斜体为bcl-6 3'UTR突变位点(miR-127结合位点)。分别以乳腺基因组和乳腺文库为模板,应用PCR扩增上述两种目的片段,具体条件为:95 ℃ 5 min 预解螺旋,95 ℃ 30 s,60 ℃ 30 s,72 ℃3 min,共32个循环,72 ℃ 7 min 延伸完毕。所得产物行琼脂糖凝胶电泳,切下带有目的片段的琼脂糖,应用胶回收试剂盒回收PCR产物后进行双酶切,同时酶切载体,将酶切好的目的片段与载体16 ℃链接6 h,转化感受态DH5α,37 ℃培养14 h形成菌落,挑取一定数量菌落行菌液PCR鉴定,阳性者提取质粒酶切鉴定,酶切后阳性克隆测序鉴定。
1.2.2 哺乳动物细胞的转染细胞培养应用含有10%胎牛血清的DMEM培养基。报告基因活性检测试验:将细胞以1×106/mL浓度接种于24孔板中,转染前1 h换新鲜培养基,将0.5 μL脂质体Vigofect与25 μL生理盐水混合,同时将质粒按照pcDNA3.0-Luc 或Wild-typebcl-6-3'UTR 或Mutated bcl-6-3'UTR 报告基因质粒0.25 μg,miR-127 1 μg,pRL-TK 0.1 μg 的比例混合于25 μL生理盐水中,室温放置5 min后将两者混合后室温放置15 min,加入24 孔板中,每组设3 个副孔。37 ℃、5% CO2条件下培养24 h 后收细胞进行荧光素酶活性检测。细胞周期试验:采用2次转染方法进行回复实验,具体转染分组如下:
第1组:miR-control+pcDNA3.0-FLAG;
第2组:miR-127+pcDNA3.0-FLAG;
第3组:miR-127+pcDNA3.0-FLAG-bcl-6。
将HepG2细胞以5×106/mL密度接种于6 cm皿中,24 h后进行转染,转染前1 h换新鲜培养基,将miR-1275 μg 混合于200 μL 生理盐水中,同时将4 μL 脂质体Vigofect混合于200 μL生理盐水中,室温放置5 min后将两者混合后室温再放置15 min,加入6 cm皿。培养24 h 后进行回复实验转染,转染方法同前,转染5 μgpcDNA3.0-FLAG-bcl-6 于miR-127 过表达细胞,继续培养24 h后收细胞一半进行流式细胞周期检测,一般行Western blot 检测相关蛋白表达。MiR-127敲低实验转染方法参考过表达转染方法。
1.2.3 流式细胞周期检测收集细胞,1500 r/min 离心10 min,吸弃上清,用含有3%胎牛血清的PBS洗1次,用含上述PBS 30%,乙醇70%混合液-20 ℃固定过夜。取-20 ℃固定的细胞3000 r/min离心1 min,弃上清,再用含有3%胎牛血清的PBS洗细胞两次,弃上清,加入含有RNaseA 浓度为1 mg/mL 的PBS 0.2 mL,37 ℃水浴30min,再加入0.3mLPI置暗处染色,20min后上机检测。
1.2.4 Western blot检测转染后48 h收细胞,加入适量RIPA裂解液冰浴裂解细胞30 min,混合等量的SDS缓冲液,煮沸15 min后进行SDS-PAGE检测。将蛋白半干电转于纤维素膜上,用5%脱脂奶粉室温封闭1 h;加入兔抗人bcl-6抗体(1∶500)、兔抗人Cyclin D1抗体(1∶250)和兔抗人GAPDH抗体(1∶1000),室温平衡摇床轻摇1 h;TBST洗膜3次,加入辣根过氧化物酶偶联的山羊抗兔IgG(1∶2000),室温轻摇1 h;TBST洗膜3次,化学发光法显色后压片显影。
1.2.5 荧光素酶报告基因活性检测转染后48 h 弃24孔板中的培养基,PBS洗1次,加入100 μL 报告基因裂解液(RLB),室温轻摇1 h,收取细胞裂解产物与EP管中,震荡10 min,4 ℃ 12 000 r/min离心10 min。取20 μL裂解液上清与等量的荧光素酶报告基因底物混合,应用荧光测定仪检测荧光素酶活性。
1.2.6 CCK-8法细胞生长检测将2次转染后的HepG2细胞以2×104/mL细胞数接种于96孔板中,每个孔加入100 μL细胞悬液并设置3个复孔,常规培养。分别于贴壁后、24、48、72、96 h,取一块96孔板,在接种孔中加入10 μL CCK-8 试剂;37 ℃、5% CO2常规培养1 h,测定A450值;以测量时间点为横坐标,A值为纵坐标绘制生长曲线。
2 结果 2.1 bcl-6 3'UTR区报告质粒及其表达载体重组质粒的构建应用基因克隆技术以乳腺基因组为模板,PCR扩增bcl-6 3'UTR区和CDS编码区序列,琼脂糖电泳分别观察到大小在1100 bp和2100 bp左右的目的片段(图 1A),两目的片段回收后分别用EcoRⅠ和XbaⅠ、KpnⅠ和XhoⅠ双酶切后插入各自载体,转化后挑取菌落行菌液PCR,阳性克隆提质粒酶切鉴定,结果显示均可切出大小相符的目的片段(图 1B),测序后显示插入片段为目的片段且构象正确(结果略)。
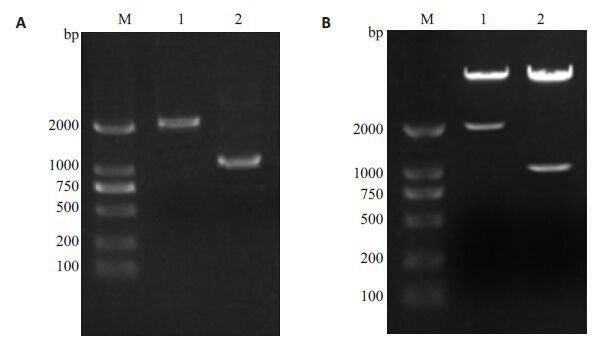
|
图 1 Bcl-6 3'UTR区报告质粒及其表达载体重组质粒的构建 Figure 1 Construction of bcl-6 3'UTR region reporter plasmid and expression vector. M:DNA marker(BM 2000); 1: bcl-6 CDS region; 2: Wild-type bcl-6 3'UTR region. A:PCR products; B: Enzyme digestion. |
应用重组PCR 技术,以构建好的野生型bcl-63'UTR质粒为模板,以野生型上游引物和突变体下游引物、野生型下游引物和突变体上游引物PCR分别扩增含有突变位点的上下游片段,纯化后以这两个片段为模板用野生型引物PCR扩增含有突变位点的突变体bcl-63'UTR区,琼脂糖电泳回收可观察到大小在1100 bp左右的目的片段(图 2A),目的片段回收后用EcoRⅠ和XbaⅠ双酶切后插入各自载体,转化后挑取菌落行菌液PCR,阳性克隆提质粒酶切鉴定(图 2B),测序显示突变成功(结果略)。
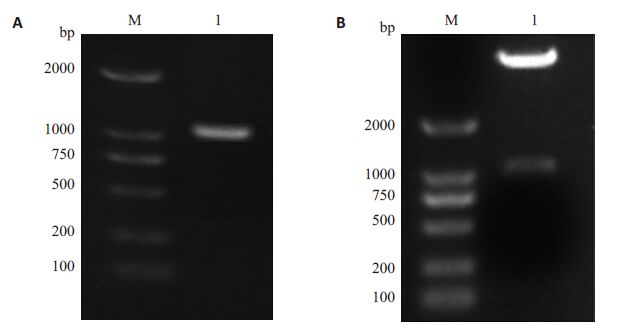
|
图 2 突变体bcl-6 3'UTR区报告质粒的构建 Figure 2 Construction of mutated bcl-6 3'UTR region reporter plasmid. M: DNA marker(BM 2000); 1: Mutated bcl-6 3'UTR region. A: PCR product; B: Enzyme digestion. |
分别将pcDNA3.0-Luc、野生型bcl-6 3'UTR 和突变体bcl-6 3'UTR 质粒转染入HEK293T 细胞,37 ℃5% CO2 全湿度培养48 h。收取细胞,行荧光素酶报告基因活性检测,结果显示三者的相对荧光素酶活性值分别为1.11±0.108、1.20±0.165、1.15±0.095,具有相似的荧光素酶活性。将pcDNA3.0-FLAG和pcDNA3.0-FLAGbcl-6转染入HEK293T细胞,37 ℃ 5% CO2 全湿度培养24 h,收细胞行Western blot检测,结果显示:应用FLAG抗体在80 000 左右的位置可以看到明显条带,符合bcl-6的大小(图 3A)。说明质粒表达正常。
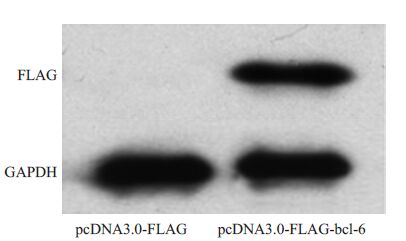
|
图 3 重组质粒表达的鉴定 Figure 3 Expression of bcl-6 protein in HEK293T cellstransfected with the recombinant plasmids detected byWestern blotting. |
将miR-127 表达载体分别和野生型(WT)bcl-63'UTR区或突变体(Mut)bcl-6 3'UTR区报告基因质粒共转人胚肾HEK293T细胞及肝细胞癌HepG2细胞,48 h后收细胞进行荧光素酶活性测定,结果显示:在两种细胞中miR-127均可以明显降低bcl-6 3'UTR区报告基因的活性水平超过50%,对空载体pcNDA3.0-Luc及突变体bcl-6 3'UTR 区报告基因的活性并没有明显的降低(图 4)。说明bcl-6是miR-127的直接靶基因,这与文献报道相一致。
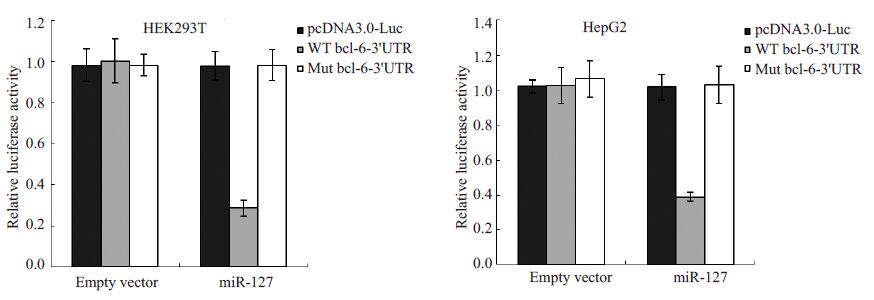
|
图 4 miR-127对bcl-6 3'UTR区报告基因活性的影响 Figure 4 Effect of miR-127 on bcl-6 3 'UTR region reporter plasmid. |
用两次转染的方法分别将miR-127和bcl-6转染入HepG2细胞相应分组,bcl-6转染后24 h收细胞,一部分固定进行流式细胞周期检测,另一部分进行Westernblot检测相关蛋白表达水平,结果显示:相比对照组转染miR-127后可以引起细胞的G0/G1期阻滞,同时转染miR-127和bcl-6后miR-127引起G0/G1期阻滞消失(图 5A)。同时Western blot检测发现miR-127可以明显抑制bcl-6表达及Cyclin D1的表达,回复bcl-6蛋白表达后,Cyclin D1的蛋白水平也得到了恢复(图 5C)。相反我们发现敲低miR-127 可以抑制G0/G1其阻滞且升高bcl-6 表达及Cyclin D1 的表达(图 5B,5D)。说明:miR-127 可以降低bcl-6 的表达进而抑制Cyclin D1 的蛋白水平,从而表现出细胞周期G0/G1期阻滞;bcl-6表达载体可以回复miR-127 引起的bcl-6 蛋白水平的降低,具有生物学活性。
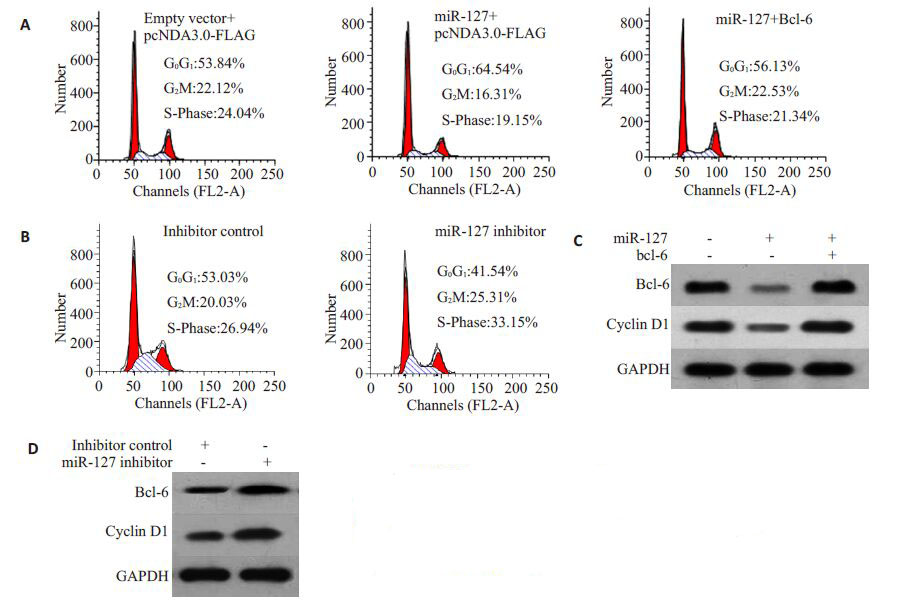
|
图 5 miR-127对细胞周期的影响及bcl-6对miR-127的拮抗作用 Figure 5 Bcl-6 antagonized the effect of miR-127 on cell cycle in HepG2 cells.A,B: Flow cytometry; C,D: Expression of bcl-6 and Cyclin D1 detectedby Western blotting. A,C: Overexpression of miR-127 and the effect ofbcl-6; C,D: Knockdown of miR-127 and the effect of bcl-6. |
采用二次转染的方式将HepG2 分成3 组:Emptyvector+pcDNA3.0-FLAG、miR-127+pcDNA3.0-FLAG、miR-127+bcl-6。将细胞分别接种于96孔板中,每组设置3个副孔,分别在贴壁后、24、48、72、96 h取一块96孔板,在每个孔中加入10 μL CCK-8溶液,37 ℃ 5% CO2全湿度培养1 h后测定A450值并绘制生长曲线。结果显示:miR-127可以明显抑制HepG2细胞生长,回复bcl-6表达水平后细胞的生长速度也得到回复。miR-127过表达组与其他两组之间具有统计学意义(P<0.05,图 6A)。抑制miR-127 表达则促进细胞的生长(图 6B)。这一结果提示:bcl-6 可以拮抗miR-127 引起的抑制细胞生长的作用。
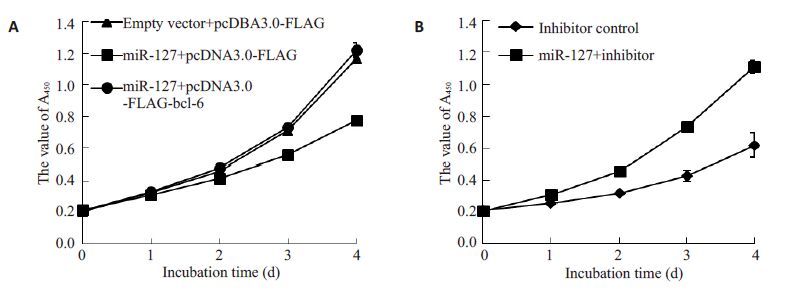
|
图 6 miR-127对细胞生长的影响 Figure 6 Growth curves of HepG2 cells with miR-127 overexpression (A) and knockdown (B) andtransfected with bcl-6 vectors. |
bcl-6是Baron等[16]研究B细胞非霍奇金淋巴瘤基因组重组的时候发现和命名的。bcl-6主要表达于生发中心的B细胞和CD4+的T细胞,与生发中心的形成及维持密切相关,研究发现,bcl-6可以抑制T细胞向Th2细胞分化[17],通过与转录因子STAT3相互作用抑制B细胞分化必须膜分子的表达,进而达到抑制B细胞分化的目的[18],同时bcl-6还通过抑制P53基因的促凋亡作用进一步达到维持生发中心的作用[19]。由于bcl-6原癌基因的特性,其表达受到严格的调控,当出现染色体异位及点突变都会引起bcl-6 启动子的异常激活[20],从而使bcl-6表达异常增加,引起机体产生癌变。不仅仅在淋巴瘤中检测出bcl-6的异常表达,其还参与多种实体性肿瘤中的发生发展。因此bcl-6成为了药物研究的新靶点,bcl-6表达的调控机制和调控分子被渐渐发现。
miRNA已经成为生物体不可或缺的调控手段,与多种疾病的发生有重要的关系。Saito等[21]首先发现两种染色质修饰药物可以引起癌症细胞miR-127表达的升高进而引起bcl-6的降低,后期的研究也进一步证实,bcl-6 为miR-127 的直接靶基因[6, 22]。Wu 等[23]发现miR-339-5p以bcl-6为靶基因,进而抑制乳腺癌细胞的生长和转移。这仅仅是以bcl-6为靶基因的miRNA研究的开始。
在miRNA研究中,目的基因3'UTR区报告质粒的构建及荧光素酶活性检测是判定miRNA作用靶基因的直接证据,我们在实验中成功构建了bcl-6 基因的3'UTR区报告质粒,与miR-127共转发现活性明显受到抑制,这与前期研究报道相一致,为后期进一步筛选以bcl-6为直接靶点的miRNA奠定了实验基础。回复实验的目的是为了在敲低实验中防止出现脱靶效应,在抑制基因表达实验中被用来证实该siRNA的特异性。由于miRNA与siRNA同样是以降低基因表达而发挥其功能,所以回复实验是不可或缺的。我们构建了bcl-6CDS序列表达载体,研究发现其可以逆转miR-127引起的细胞周期的改变及细胞生长的改变,这说明bcl-6质粒具有生物学活性。为后期检测筛选的miRNA功能试验奠定良好的实验基础
| [1] | 耿万友, 侯睿, 孙树民, 等. 原癌基因bcl-6研究进展[J]. 动物医学进 展,2013, 4 (3) : 110-3. |
| [2] | Baron BW, Hyjek E, Gladstone B, et al. PDCD2, a protein whose expression is repressed by BCL6, induces apoptosis in human cells by activation of the caspase cascade[J]. Blood Cells Mol Dis,2010, 45 (2) : 169-75. DOI: 10.1016/j.bcmd.2010.04.007. |
| [3] | Crotty S, Johnston RJ, Schoenberger SP. Effectors and memories: bcl-6 and Blimp-1 in T and B lymphocyte differentiation[J]. Nat Immunol,2010, 11 (2) : 114-20. DOI: 10.1038/ni.1837. |
| [4] | Sawant DV, Wu H, Yao W, et al. The transcriptional repressor Bcl6 controls the stability of regulatory T cells by intrinsic and extrinsic pathways[J]. Immunology,2015, 145 (1) : 11-23. DOI: 10.1111/imm.12393. |
| [5] | Mathew R, Mao AP, Chiang AH, et al. A negative feedback loop mediated by the Bcl6-cullin 3 complex limits Tfh cell differentiation[J]. J Exp Med,2014, 211 (6) : 1137-51. DOI: 10.1084/jem.20132267. |
| [6] | Chen J, Wang M, Guo M, et al. miR-127 regulates cell proliferation and senescence by targeting BCL6[J]. PLoS One,2013, 8 (11) : e80266. DOI: 10.1371/journal.pone.0080266. |
| [7] | Phan RT, Saito M, Basso K, et al. BCL6 interacts with the transcription factor Miz-1 to suppress the cyclin-dependent kinase inhibitor p21 and cell cycle arrest in germinal center B cells[J]. Nat Immunol,2005, 6 (10) : 1054-60. DOI: 10.1038/ni1245. |
| [8] | Ranuncolo SM, Polo JM, Melnick A. BCL6 represses CHEK1 and suppresses DNA damage pathways in normal and malignant B-cells[J]. Blood Cells Mol Dis,2008, 41 (1) : 95-9. DOI: 10.1016/j.bcmd.2008.02.003. |
| [9] | Wu Q, Liu X, Yan H, et al. B-cell lymphoma 6 protein stimulates oncogenicity of human breast cancer cells[J]. BMC Cancer,2014, 14 : 418. DOI: 10.1186/1471-2407-14-418. |
| [10] | Walker SR, Liu S, Xiang M, et al. The transcriptional modulator BCL6 as a molecular target for breast cancer therapy[J]. Oncogene,2015, 34 (9) : 1073-82. DOI: 10.1038/onc.2014.61. |
| [11] | Ruggieri S, Tamma R, Marzullo A, et al. Translocation of the proto-oncogene bcl-6 in human glioblastoma multiforme[J]. Cancer Lett,2014, 353 (1) : 41-51. DOI: 10.1016/j.canlet.2014.06.017. |
| [12] | Sena P, Mariani F, Benincasa M, et al. Morphological and quantitative analysis of BCL6 expression in human colorectal carcinogenesis[J]. Oncol Rep,2014, 31 (1) : 103-10. |
| [13] | Liang PI, Li CF, Chen LT, et al. BCL6 overexpression is associated with decreased p19 ARF expression and confers an Independent prognosticator in gallbladder carcinoma[J]. Tumour Biol,2014, 35 (2) : 1417-26. DOI: 10.1007/s13277-013-1195-z. |
| [14] | Tunyaplin C, Shaffer AL, Angelin-Duclos CD, et al. Direct repression of prdm1 by bcl-6 inhibits plasmacytic differentiation[J]. J Immunol,2004, 173 (2) : 1158-65. DOI: 10.4049/jimmunol.173.2.1158. |
| [15] | Feng C, Jin J, Zou Q, et al. Interleukin-21 inhibits humoral response to an HIV DNA vaccine by enhancing bcl-6 and Pax-5 expression[J]. Viral Immunol,2012, 25 (2) : 131-40. DOI: 10.1089/vim.2011.0073. |
| [16] | Baron BW, Nucifora G, Mccabe N, et al. Identification of the gene associated with the recurring chromosomal translocations t(3; 14) (q27; q32) and t(3; 22) (q27; q11) in B-cell lymphomas[J]. Proc Natl Acad Sci USA,1993, 90 (11) : 5262-6. DOI: 10.1073/pnas.90.11.5262. |
| [17] | Kusam S, Toney LM, Sato H, et al. Inhibition of Th2 differentiation and GATA-3 expression by BCL-6[J]. J Immunol,2003, 170 (5) : 2435-41. DOI: 10.4049/jimmunol.170.5.2435. |
| [18] | Diehl SA, Schmidlin H, Nagasawa M, et al. IL-6 triggers IL-21 production by human CD4 + T cells to drive STAT3-dependent plasma cell differentiation in B cells[J]. Immunol Cell Biol,2012, 90 (8) : 802-11. DOI: 10.1038/icb.2012.17. |
| [19] | Ranuncolo SM, Wang L, Polo JM, et al. BCL6-mediated attenuation of DNA damage sensing triggers growth arrest and senescence through a p53-dependent pathway in a cell context-dependent manner[J]. J Biol Chem,2008, 283 (33) : 22565-72. DOI: 10.1074/jbc.M803490200. |
| [20] | Artiga MJ, Sáez AI, Romero C, et al. A short mutational hot spot in the first intron of BCL-6 is associated with increased BCL-6 expression and with longer overall survival in large B-cell lymphomas[J]. Am J Pathol,2002, 160 (4) : 1371-80. DOI: 10.1016/S0002-9440(10)62564-3. |
| [21] | Saito Y, Liang G, Egger G, et al. Specific activation of microRNA- 127 with downregulation of the proto-oncogene BCL6 by chromatin-modifying drugs in human cancer cells[J]. Cancer Cell,2006, 9 (6) : 435-43. DOI: 10.1016/j.ccr.2006.04.020. |
| [22] | Zhao X, Duan Z, Liu X, et al. MicroRNA-127 is downregulated by Tudor-SN protein and contributes to metastasis and proliferation in breast cancer cell line MDA-MB-231[J]. Anat Rec (Hoboken),2013, 296 (12) : 1842-9. DOI: 10.1002/ar.v296.12. |
| [23] | Wu ZS, Wu Q, Wang CQ, et al. MiR-339-5p inhibits breast cancer cell migration and invasion in vitro and May be a potential biomarker for breast cancer prognosis[J]. BMC Cancer,2010, 10 : 542. DOI: 10.1186/1471-2407-10-542. |
 2015, Vol. 35
2015, Vol. 35

