肝细胞氧化应激是指.OH、H2O2 等活性氧族(reactive oxygen species,ROS)产生过多或/和内源性抗氧化能力降低,氧化系统和抗氧化系统平衡紊乱,而致肝细胞损伤的病理过程[1]。研究显示,氧化应激通过产生过量ROS等,造成肝脏脂质过氧化损伤,DNA氧化损伤和蛋白质表达异常,参与病毒性肝炎、非酒精性/酒精性肝炎、药物性肝病等多种肝脏疾病的发病机制[2-4]。这些肝病具有发病率高,病程长,难医治,反复发作的特点。而合成抗氧化剂如二丁基羟基甲苯(BHT)等成本较高、毒性较大,临床应用严重受限。临床上常用维生素C、维生素E等还原性物质进行抗氧化治疗,但近年发现这些化学药物在清除过量有害自由基的同时亦会影响NO、H2O2等多种自由基作为信号分子的正常功能。因此,寻找有效低毒价廉的抗氧化剂,对氧化性肝损伤有重要临床意义。
三黄茵赤方由茵陈蒿汤(茵陈蒿、大黄、栀子)减栀子加姜黄、黄芪、赤芍组成,此方含有大黄素、姜黄素、总黄酮等化学成分,初步药理实验表明,此方对肝脏氧化性损伤甚至肝衰竭有明显的保护作用[5-6]。本课题组前期研究体内实验发现[7],三黄茵赤方通过减少动物内MDA含量,抑制AST、ALT释放,保护D-氨基半乳糖(D-GalN)联合脂多糖(LPS)损伤的小鼠肝衰竭。现以体外细胞实验为出发点,进一步探究三黄茵赤方含药血清通过抗氧化应激来实现H2O2所致LO2细胞DNA氧化损伤的保护效应。
1 材料与方法 1.1 药物和试剂大黄、姜黄、黄芪、茵陈蒿、赤芍均购自南方医院(广州白云山星群药业股份有限公司生产,生产批号12010307)。人胚肝细胞系LO2(LO2细胞)引自中山大学实验中心。胰蛋白酶、改良型RPMI 1640培养基、胎牛血清为Gibco公司产品。CCK-8试剂盒购于同仁化学研究所。过氧化氢(H2O2)、DCFH-DA 购自美国sigma公司。SOD、CAT、GSH-PX测定试剂盒均购于南京建成生物工程研究所。人8-羟基脱氧鸟苷(8-OHdG)酶联免疫分析试剂盒购自美国R & D公司。低熔点琼脂糖(LMA)FMC分装,正常熔点琼脂糖(NMA)、肌苷酸钠、二甲基亚砜Spanish分装,Triton-X Genview分装。
1.2 主要仪器日本尼康Eoipse Ti-s 荧光倒置显微镜及分析软件;Thermo全波段酶标仪;二氧化碳培养箱;细胞超净台;美国BD公司的流式细胞仪;JY-SPCT型水平电泳槽。
1.3 动物SD雄性大鼠30只,体质量(240±20)g,由南方医科大学动物中心提供,(合格证号:44002100003232)。饲养环境:温度(22±2)℃,湿度(60±5)%。适应性饲养3 d。
1.4 方法 1.4.1 制备三黄茵赤方含药血清各药按一定剂量称取240 g生药,采用合煎形式,第1遍煎煮加8倍水,第2遍加5倍水,水沸后再煎煮30 min,合并两次煎煮液,60 ℃烘干箱浓缩至1.56 g/mL原液浓度,冷藏保存。大鼠30只,随机分为3组,10只/组,分别为正常对照组、三黄茵赤方组(25 g生药/kg)和维生素E组(250 mg/kg)。灌胃给药,正常对照组给以等体积生理盐水,其它各组分别给予相应剂量药物,2 次/d,2 mL/次,连续3 d。末次给药后1~2 h内,无菌条件下腹主动脉采血,3000 r/min,离心15 min,分离血清。经56 ℃、30 min灭活处理后,用0.22 μm孔径的无菌滤器除菌,分装,于-80 ℃冰箱中保存备用。临用时,正常血清和含药血清均用不含血清的改良型RPMI 1640培养基稀释。
1.4.2 LO2细胞的培养LO2细胞按常规方法复苏后,置37 ℃、5% CO2培养箱里,用含10% FBS和1%双抗的改良型RPMI 1640 培养液培养。待细胞长满至瓶底85%左右时,用含0.2% EDTA的0.25%胰蛋白液消化,收集消化液,1000 r/min,离心3min,弃上清,用培养液将细胞沉淀调为细胞密度为1×106,再接种至各培养瓶中继续培养,待用。
1.4.3 H2O2损伤模型的确立取生长良好的LO2 肝细胞,以4×104/mL 细胞悬液接种于96 孔培养板中,置37 ℃、5%CO2培养箱里培养过夜后,弃旧液。用RPMI1640培养基稀释正常血清,调浓度为15%的正常血清工作液,以100 μL/孔加入96孔培养板中培养24 h,弃旧液,分别加入用RPMI 1640培养基稀释成7组不同浓度的H2O2工作液(100、200、400、600、800、1000、1200 μmol/L),再加正常对照组,共8组,5孔/组。H2O2工作液分别作用细胞3 h 后,用RPMI 1640 培养基洗2 次,然后每孔加入10 μL CCK-8溶液继续培养2 h,用酶标仪于波长450 nm处测定各孔吸光度A值,计算细胞活力=(A实验组/A对照组)×100%,以筛选出H2O2最合适的浓度。
1.4.4 CCK-8法检测LO2细胞存活率将培养在96孔板中的LO2 细胞随机分为6 组:① 正常对照组(Control);②H2O2模型组(H2O2);③5%三黄茵赤方含药血清组(5%S);④10%三黄茵赤方含药血清组(10%S);⑤15%三黄茵赤方含药血清组(15%S);⑥阳性对照组(vitE)。所有组别以15%大鼠正常血清为基础,不足者以正常血清补齐。即细胞接种24 h后,①②组加入终浓度为15%大鼠正常血清,③组加入终浓度为5% SF,10%大鼠正常血清,④组加入终浓度为10% SF,5%大鼠正常血清,⑤组加入终浓度为15% SF,⑥组加入终浓度为10% vitE,5%大鼠正常血清,继续培养24 h。除正常对照组外,其余各组均给800 μmol/L H2O2作用3 h。用CCK-8法检测各孔吸光度A值,计算细胞存活率=(A实验组/A对照组)×100%。
1.4.5 倒置显微镜观察LO2 细胞形态取对数生长期LO2细胞,以1×106/mL细胞悬液接种于6孔培养板中,细胞分组、处理见方法1.4.4,利用倒置显微镜观察LO2细胞形态.
1.4.6 SOD、CAT、GSH-PX 活性测定取对数生长期LO2细胞,以1×106/mL细胞悬液接种于6孔培养板中,细胞分组、处理见方法1.4.4,收集各组细胞,采用液氮反复冻融法破碎细胞,用BCA试剂盒测定各组细胞蛋白浓度。SOD、CAT、GSH-PX活性测定均按照试剂盒说明书进行。
1.4.7 ROS清除能力的测定取对数生长期LO2细胞,以1×106/mL细胞悬液接种于6孔培养板中,细胞分组见方法1.4.4,以不同浓度的SF和10%维生素E预处理细胞24 h,PBS 洗涤细胞2 次,装载以1∶1000 稀释的DCFH-DA,37 ℃避光孵育25 min。PBS 洗细胞3 次后,加入含有800 μmol/L H2O2的无血清RPMI 1640培养基继续避光孵育30 min后,直接吹打收集细胞离心,去上清,用D-Hanks液悬浮细胞于流式管中,立即用流式细胞仪检测。
1.4.8 8-OHdG含量检测取对数生长期LO2 细胞,以1×106/mL细胞悬液接种于6孔培养板中,细胞分组、处理见方法1.4.4,将收集起来的细胞用液氮反复冻融3次以彻底破碎细胞,12 000 r/min,4 ℃,离心30 min,取上清,分装,-80 ℃保存备用。按照8-OHdG试剂盒说明书进行后面操作。显色深浅和样品中8-OHdG呈负相关。
1.4.9 彗星实验取对数生长期LO2细胞,以1×106/mL细胞悬液接种于6孔培养板中,细胞分组、处理见方法1.4.4。步骤:(1)制板:第一层胶的制备,将已预热56 ℃的120 μL 0.8% NMA滴到的磨砂载玻片上,4 ℃,10 min凝固,制备第二层胶,取10 μL含1×103细胞的PBS和90 μL 0.6% LNM混匀,铺到第一层胶上,4 ℃,10 min凝固;(2)裂解:细胞裂解液裂解1 h;(3)解旋:载玻片置于碱性电泳缓冲液,解旋20 min;(4)电泳:25 V,300 mA,10 min;(5)中和与染色:载玻片放于Tris-HCl 液中和15 min,再滴加50 μL 30 μg/mL的溴化乙锭(EB)溶液,避光染色20 min;⑥荧光显微镜下观察并拍照。利用CASP软件对彗星图像进行分析。
1.5 统计学处理应用SPSS 19.0软件,所有数据均以均数±标准差表示,P<0.05表示差异有统计学意义。对各组数据先进行方差齐性检验,若方差齐,采用Tukey检验;若方差不齐,采用Dunnetts T3检验。
2 结果 2.1 诱导LO2细胞损伤所需H2O2浓度的确定CCK-8检测结果显示,H2O2浓度与LO2细胞存活率成负相关。当H2O2浓度为200 μmol/L时,细胞存活率较正常对照组显著下降,为86%±2.24%(P<0.01)。H2O2浓度为800 mol/L时,细胞存活率为51.4%±3.21%(P<0.01)。当H2O2浓度达到1200 μmol/L 时,细胞存活率仅为18%±4.74%(P<0.01)。因此,后续实验以800 μmol/L H2O2为造模剂,进一步探讨三黄茵赤方含药血清的肝保护作用(图 1)。
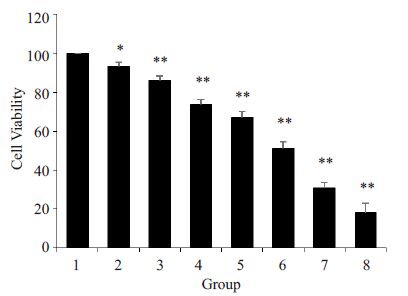
|
图 1 H2O2对LO2细胞存活率的影响 Figure 1 Effects of H2O2 on the cell viability of LO2 cell (n=5). 1: Control group; 2: 100 μmol/L; 3: 200 μmol/L; 4: 400μmol/L; 5: 600 μmol/L; 6: 800 μmol/L; 7: 1000 μmol/L; 8:1200 μmol/L. *P<0.05 and **P<0.01 vs 1. |
CCK-8检测结果显示,不同浓度的三黄茵赤方含药血清和维生素E均能提高H2O2导致的LO2细胞存活率下降。其中15%S 的保护效应最明显(P<0.01),而10%S与vitE组的作用相当(P>0.05,图 2)。
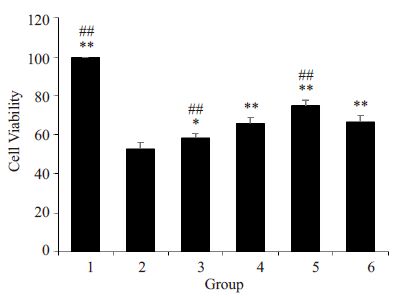
|
图 2 三黄茵赤方含药血清对H2O2损伤LO2细胞存活率的影响 Figure 2 Effects ofSHYCF on the cell viability ofH2O2-damaged LO2 cell (n=5). 1: Control group; 2:H2O2 model group; 3: 5%S group; 4: 10% S group; 5:15% S group; 6: VitE group. *P<0.05 and **P<0.01 vsH2O2 model group. ##P<0.01 vs VitE group. |
由图 3可见,正常对照组细胞大小均匀,细胞间排列紧凑有序,模型组细胞皱缩或肿大,形状变圆或扁圆,细胞间隙扩大,贴壁细胞数量与密度减少。10% S组、15% S组与维生素E组细胞形态接近正常组,以15% S组效果最明显,但细胞数量与密度相对减少。
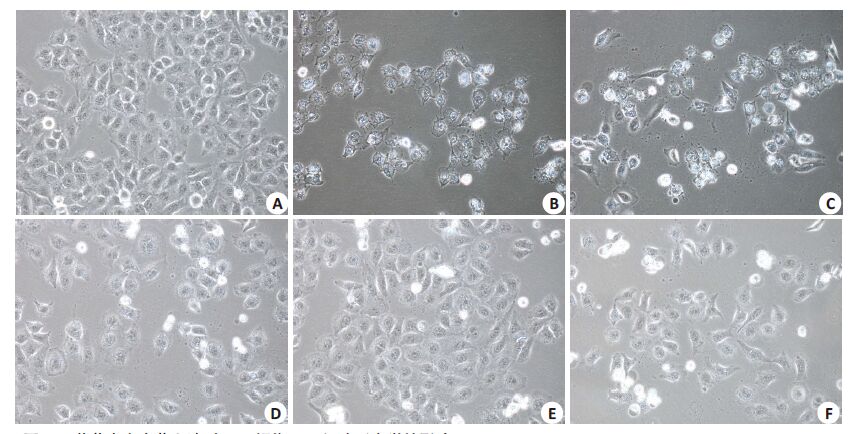
|
图 3 三黄茵赤方含药血清对H2O2损伤LO2细胞形态学的影响 Figure 3 Effects of SHYCF on the morphological features of H2O2-damaged LO2 cells (Original magnification: ×200). A:Control group; B: H2O2 model group; C: 5% S group; D: 10%S group; E: 15% S group; F: VitE group. |
与正常对照组相比,H2O2 模型组SOD、CAT、GSH-PX活性明显降低(P<0.01)。与模型组相比,10%S组、15%S组与维生素E组SOD、CAT、GSH-PX活性明显增高(P<0.01),其中15% S组酶活性增高最明显(图 4)。
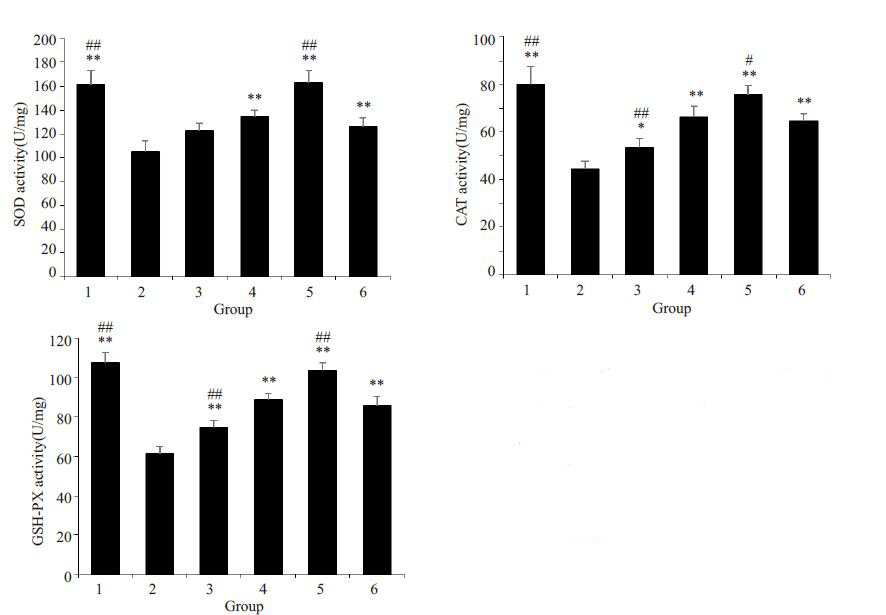
|
图 4 三黄茵赤方含药血清对H2O2损伤LO2细胞SOD、CAT、GSH-PX活性的影响 Figure 4 Effects ofSHYCF on the SOD,CAT andGSH-PX activity of H2O2-damaged LO2 cell (n=5). 1: Control group; 2: H2O2 model group; 3: 5%S group; 4: 10% S group; 5: 15% S group; 6: VitEgroup. *P<0.05 and **P<0.01 vs H2O2 modelgroup. #P<0.05 and ##P<0.01 vs VitE group. |
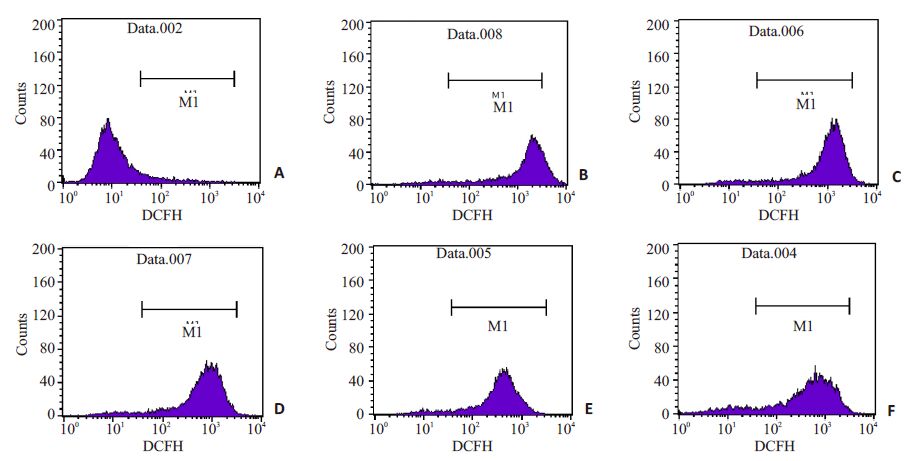
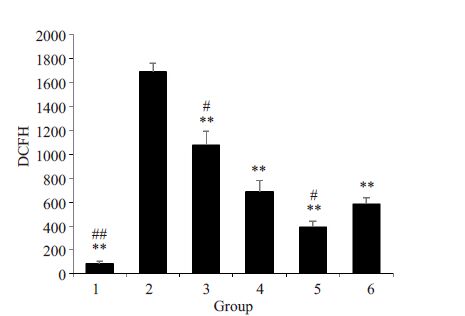
流式仪直方图分析DCF荧光强度,其与细胞内活性氧水平成正比(图 5)。由图 6可见,与模型组比,三黄茵赤方含药血清能浓度依赖性地抑制H2O2导致的ROS含量增加,差异具有统计学意义(P<0.01)。而10% S组与维生素E组对ROS清除能力的比较,差异无统计学意义(P<0.05)。
|
图 5 三黄茵赤方含药血清对H2O2损伤LO2细胞ROS清除能力的影响 Figure 5 Effects of SHYCF on the intracellular ROS scavenging activity of H2O2-damaged LO2 cell. A: Control group; B:H2O2 model group; C: 5% S group; D: 10% S group; E: 15% S group; F: VitE group. |
|
图 6 三黄茵赤方含药血清对H2O2损伤LO2细胞ROS清除能力的影响 Figure 6 Effects ofSHYCF on the intracellular ROSscavenging activity of H2O2-damaged LO2 cell (n=4) .1: Control group; 2: H2O2 model group; 3: 5% Sgroup; 4: 10% S group; 5: 15% S group; 6: VitE group.**P<0.01 vs H2O2model group. #P<0.05 vs VitE group. |
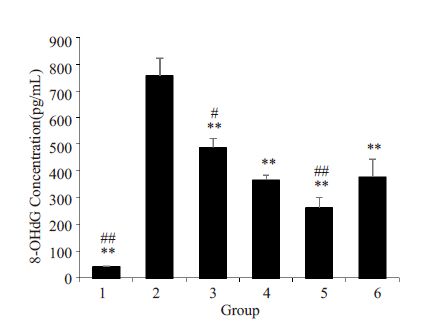
与正常对照组相比,模型组细胞内8-OHdG含量明显增加,差异有统计学意义(P<0.01)。与模型组比较,各给药组细胞内8-OHdG浓度均显著降低。与维生素E组相比,15% S组的作用效果较之明显,而10% S组和维生素E组的作用相当,8-OHdG含量差异无统计学意义(P>0.05,图 7)。
|
图 7 三黄茵赤方含药血清对H2O2 损伤LO2 细胞8-OHdG含量的影响 Figure 7 Effects ofSHYCF on the 8-OHdG content ofH2O2-damaged LO2 cell (n=4). 1: Control group; 2: H2O2model group; 3: 5% S; 4: 10% S; 5: 15% S; 6: VitE group.**P<0.01 vs H2O2 model group. #P<0.05 and ##P<0.01 vsVitE group. |
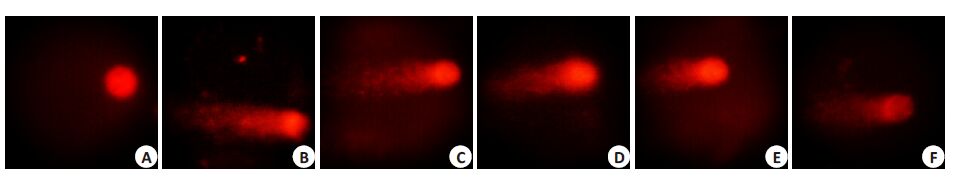
实验结果显示,LO2 细胞在镜下只见完整的细胞核,DNA荧光图像为红色圆球形,而H2O2模型组可见明显彗星样拖尾现象。各给药组也出现彗星现象,但较模型组尾长短,拖尾率低(图 8)。由表 1可见,与模型组比较,三黄茵赤方含药血清低、中、高浓度组及维生素E组细胞拖尾率降低(P<0.01),尾长、尾矩、Olive尾矩也显著减小(P<0.01)。其中15% S组与维生素E组差异无统计学意义。
|
图 8 三黄茵赤方含药血清对H2O2损伤LO2细胞彗星实验结果 Figure 8 Effects of SHYCF on Comet assay of H2O2-damaged LO2 cell. A: Control group; B: H2O2 model group; C: 5%S group; D: 10%Sgroup; E: 15%S group; F: VitE group. |
| 表 1 三黄茵赤方含药血清对H2O2诱导LO2细胞DNA损伤检测 Table 1 Effects of SHYCF on the LO2 cells with DNAdamage (Mean±SD, n=50) |
本实验三黄茵赤方含药血清是依据药物在体内代谢的半衰期和达峰时间[8-9]规律获得,能较好反映三黄茵赤方在体内的真实药理效应,更接近体内试验。另外,为避免大鼠正常血清对细胞的影响,本实验所有组别均以15%空白大鼠血清为基础,使实验结果更具参考意义。
当氧化或烷化物进入细胞时,会诱导产生大量ROS。若ROS得不到及时清除,ROS的中间产物自由基可直接作用于核酸,引起碱基的修饰和DNA链断裂,造成细胞DNA氧化损伤[10-11]。彗星实验结果显示,H2O2模型组可见明显彗星样拖尾现象,各给药组也出现彗星现象,但较H2O2模型组尾长短,拖尾率低,提示三黄茵赤方能有效减少LO2 细胞DNA损伤情况。8-OHdG是DNA氧化损伤和细胞内氧化应激的敏感性生物学标志,在DNA氧化损伤的产生和发展中起到了重要作用[12-13]。有研究表明[14],一定浓度铬(Cr-VI)可诱导细胞DNA氧化损伤,使8-OHdG含量增加,细胞凋亡增加,存活率下降。而细胞氧化损伤的保护性因素,而维生素C等下调可增加体内8-OHdG 含量。本实验显示,与正常对照组比较,H2O2模型组8-OHdG含量显著增加,而给予三黄茵赤方含药血清和维生素E的组中8-OHdG含量显著降低,细胞存活率也有所提高,提示三黄茵赤方含药血清对细胞DNA氧化损伤有一定的保护作用。
机体内存在一套完整的抗氧化酶防疫系统,主要包括SOD、CAT、GSH-PX 等,能有效地清除机体内产生的ROS,在维持机体氧化状态动态平衡中起重要作用[15]。当LO2细胞受到外来H2O2损伤后,发生氧化应激,引起氧化和抗氧化作用失衡,细胞内ROS产量急剧增加,大量的自由基消耗机体内抗氧化酶,导致抗氧化酶的活性降低[16]。从本实验中可以得出,用H2O2处理细胞后,细胞内SOD、CAT、GSH-PX平均活力明显降低,且ROS含量明显增加。而各浓度三黄茵赤方含药血清组和维生素E组中,3种抗氧化酶的活力均有所增加,清除ROS的能力有所增强,维持细胞氧化-抗氧化状态的平衡,从而减轻细胞的损伤甚至凋亡。
总之,三黄茵赤方含药血清预保护能明显抑制H2O2导致的LO2细胞活力下降,能增强细胞内抗氧化酶(SOD、CAT、GSH-PX)的活性,能有效清除ROS累积,减少ROS对细胞DNA氧化损伤,使细胞内8-OHdG含量下降。因此,三黄茵赤方含药血清可能是通过清除自由基而发挥直接抗氧化作用,或通过调节细胞内源性抗氧化系统,来发挥其细胞保护效应的。
| [1] | Cortes-Rojo C, Rodriguez-Orozco AR. Importance of oxidative damage on the electron transport chain for the rational use of Mitochondria-Targeted antioxidants[J]. Mini Rev Med Chem,2011, 11 (7) : 625-32. DOI: 10.2174/138955711795906879. |
| [2] | Souli A, Sebai H, Chehimi L, et al. Hepatoprotective effect of carob against acute ethanol-induced oxidative stress in rat[J]. Toxicol Ind Health,2015, 31 (9) : 802-10. DOI: 10.1177/0748233713475506. |
| [3] | Yu SJ, Bae S, Kang JS, et al. Hepatoprotective effect of vitamin C on lithocholic acid-induced cholestatic liver injury in Gulo(-/-) mice[J]. Eur J Pharmacol,2015, 762 : 247-55. DOI: 10.1016/j.ejphar.2015.06.008. |
| [4] | Tang W, Jiang Y. Role of Nef2 in chronic liver disease[J]. World J Gastroenterol,2015, 20 (36) : 13079-87. |
| [5] | 杨运高, 刘亚伟, 华何与, 等. 三黄茵赤汤对急性肝衰竭大鼠肝脏损害 及凋亡效应酶caspase3的影响[J]. 南方医科大学学报,2010, 30 (11) : 2443-5. |
| [6] | 向晖, 潘晓丽, 谢运飞, 等. 3种大黄素金属配合物的抗氧化活性研究[J]. 中国实验方剂学杂志,2013, 19 (14) : 236-9. |
| [7] | 马文校, 杨运高, 刁建新, 等. 三黄茵赤汤防治大鼠急性肝衰竭的机制[J]. 南方医科大学学报,2014, 4 (4) : 482-6. |
| [8] | 何娟, 曹文富, 王海兰, 等. 川芎含药血清对大鼠肝星状细胞大麻素受 体1相关信号通路的影响[J]. 中成药,2015, 37 (7) : 1397-401. |
| [9] | 刘秀明. 减味寿胎丸提取工艺及其有效成分的药动学和血清药理学 研究[D]. 广州: 广州中医药大学, 2014: 1-108. |
| [10] | Rinna1 A, Magdolenova1 Z, Hudecova1 A, et al. Effect of Silver nanoparticles on mitogen-activated protein kinases activation:role of reactive Oxygen species and implication in DNA damage[J]. Mutagenesis,2015, 30 (1) : 59-66. DOI: 10.1093/mutage/geu057. |
| [11] | Cadet J, Douki T, Ravanat JL, et al. Measurement of oxidatively generated base damage in cellular DNA[J]. Mutat Res,2011, 711 : 3-12. DOI: 10.1016/j.mrfmmm.2011.02.004. |
| [12] | Kubo N, Morita M, Nakashima Y, et al. Oxidative DNA damage in human esophageal cancer: clinicopathological analysis of 8-hydroxydeoxyguanosine and its repair enzyme[J]. Diseas Esophagus,2014, 27 (3) : 285-93. DOI: 10.1111/dote.2014.27.issue-3. |
| [13] | Tabur S, Aksoy SN, Korkmaz H, et al. Investigation of the role of 8-OHdG and oxidative stress in papillary thyroid carcinoma[J]. Tumor Biol,2015, 36 (4) : 2667-74. DOI: 10.1007/s13277-014-2889-6. |
| [14] | 李鹏, 钟才高, 王安, 等. hOGG1基因在Cr(Ⅵ)诱导线粒体DNA氧 化损伤中的作用[J]. 卫生研究,2012, 41 (3) : 385-9. |
| [15] | Oka S, Ohno M, Tsuchimoto D, et al. Two distinct pathways of cell death triggered by oxidative damage to nuclear and mitochondrial DNAs[J]. EMBO J,2008, 27 (2) : 421-32. DOI: 10.1038/sj.emboj.7601975. |
| [16] | 刘海云, 崔艳茹, 伍庆华, 等. 菟丝子总黄酮对过氧化氢损伤的血管内 皮细胞的保护作用[J]. 中国实验方剂学杂志,2013, 19 (18) : 215-8. |
 2015, Vol. 35
2015, Vol. 35

