2. 四川省成都市锦江区妇幼保健院生殖医学中心,四川 成都 610016 ;
3. 南方医科大学遗传教研室,广东 广州 510515
2. Center for Reproductive Medicine, Chengdu Jingjiang Hospital for Maternal and Child Health Care, Chengdu 610016, China ;
3. Department of Obstetrics and Gynecology, Nanfang Hospital, Southern Medical University, Guangzhou 51051, China
目前,全球大约有10%~15%的育龄夫妇因各种不孕因素而无法生育[1]。1/3的不孕夫妇是由男方因素导致,这其中50%的不育男性存在精子形态异常这一问题。有许多研究[2-3]认为,精子形态是反映精子质量的一个重要指标,精子形态异常是导致男性不育的重要原因之一。自从1992年ICSI(卵母细胞浆内单精子注射技术)首次在人类获得成功妊娠以来,许多精液质量差,甚至无精子症的患者都通过ICSI技术获得了满意的妊娠结局。然而,在低倍显微镜下(×400)挑选的看似正常的活动精子仍可能存在一些细微形态结构的异常(比如精子头部的小空泡、精子中心体形态异常、线粒体形态异常等),这些异常的精子可能通过显微注射技术,突破自然屏障的选择作用使卵母细胞受精,从而影响胚胎的早期分裂发育潜能以及后期的临床结局[2, 4]。
为了克服低分辨率对精子形态判断的影响,2002年以色列研究者Bartoov 等[5]引入了MSOME(活精子细胞器形态学检测)技术,同时将MSOME放大系统与传统ICSI技术结合起来发展形成IMSI[6](精子形态选择性胞浆内单精子注射)技术。这一技术将在更高放大倍数(×6600-×13 000)下对精子进行动态的、实时的、精确的观察,发现许多在传统ICSI放大倍数下(×400)无法观察到的精子细微形态结构的异常,有研究[7-11]指出这些细微的形态结构异常与精子的内部生理功能异常存在密切联系,如精子头部空泡可能与高DNA碎片率[7-9]、高染色体非整倍体发生率[10]、线粒体功能异常[11]等相关。曾有学者指出[12-13]利用MSOME放大系统对精子挑选后再进行显微注射可以显著提高胚胎质量,以及第3天优胚率。也有一些研究者[14-16]曾指出IMSI技术能显著提高患者的临床妊娠率。然而这些研究大多数都是针对反复ICSI治疗周期失败的患者进行的,并未对患者按照他们的精液情况进行分类统计。
在ICSI治疗周期中,不同来源的精子对卵母细胞正常受精、胚胎质量会有一定影响[17-18]。睾丸来源的精子需要在附睾中进一步发育(精子质膜的通透性改变、精子核的成熟以及顶体外膜抗原分布的改变)才能达到成熟。然而对于一些无精子症患者,只能从睾丸中获取精子,这种睾丸来源的精子可能在外部形态结构以及内部功能方面都存在缺陷,从而影响ICSI周期中的卵母细胞受精、胚胎质量以及胚胎发育潜能[19-20]。对于畸精子症患者,他们精液中精子的异常形态率高,传统ICSI技术下挑选的精子可能存在超微结构的异常,而且这些细微结构异常的精子在严重畸精子症患者的精液中所占比例更大,常规ICSI低倍镜下挑选到他们的几率更高[7]。因此,我们将精子放大系统(MSOME)运用于睾丸精子以及畸精子症患者精液标本的挑选,通过这一技术是否能够提高挑选到内部生理功能正常精子的可能性,从而提高治疗周期中卵母细胞受精率、胚胎质量以及胚胎发育潜能?这是我们所关心的问题。
为了探讨这一问题,本文分别将梗阻性无精子症患者和畸精子症患者分为ICSI组和IMSI组。梗阻性无精子症患者中,将IMSI组患者经睾丸穿刺术获得的精子在放大倍数为6000的显微镜下进行形态选择后行显微注射治疗;ICSI组患者穿刺获得的精子在常规低倍镜下(×400)挑选后注射入卵母细胞。畸形精子症患者射出的精液进行同样分组处理。最后分别对比两类患者中IMSI组和ICSI组的实验室结局以及临床结局。
1 对象与方法 1.1 研究对象2013年1月~2014年11月,在本中心接受辅助生殖治疗的173例梗阻性无精子症患者(均采用TESA术获取精子)。同时间段内在本中心接受辅助生殖治疗的125例畸精子症患者。纳入标准为:(1)单纯男方因素(梗阻性无精子症、严重畸形精子症),男女双方染色体核型正常,男方不存在Y染色体微缺失情况;(2)女方为原发性不孕,年龄<38岁,基础窦卵泡数(AFC>10),取卵日获得的MⅡ卵数>6,月经周期规律,基础激素水平正常(月经第2 天FSH<10 U/L),身体质量指数(BMI<29),排除多囊卵巢综合征、子宫肌瘤、子宫内膜异位症等因素;(3)均为第1次激动剂长方案控制性促排卵治疗。
根据受精方式不同分为IMSI组和ICSI组。具体分组如下:其中梗阻性无精子症患者IMSI组(n=82),男方年龄为33.37±5.82 岁;ICSI 组(n=91)男方年龄为30.90±5.1岁。畸精子症患者中IMSI组(n=44),男方年龄为33.2±5.56 岁;ICSI 组(n=71),男方年龄为33.04±6.09岁。两组患者的配偶年龄、不孕年限、临床用药无明显差别。
1.2 方法 1.2.1 卵母细胞的采集与处理所有患者均使用常规长方案促排卵:黄体中期予GnRHa 0.05 mg(达必佳,FERRING,Swiss)肌注,14 d后rFSH 150~300 U(果纳芬,Merck,Germany)对卵巢进行刺激,B超监测卵泡生长发育状况,待卵泡直径大于18 mm后,给予基因重组人绒毛膜促性腺激素(rHCG,艾泽,Merck,德国)250 mg肌注,36 h后在B超介导下经阴道穿刺取卵。将获得的卵母细胞于透明质酸酶(Hyaluronidase,80 U/ml,Sage,USA)中消化去除颗粒细胞后,置于含Vitrolife序贯培养液(G-IVF,Vitrolife,Swedish)的培养皿中放置37 ℃、6% CO2的培养箱(Thermo Scientific Forma 3110,USA)培养备用。
1.2.2 精子准备梗阻性无精子症患者的精子准备:采用睾丸细针抽吸术[2]获取睾丸组织,加入含10%替代血清白蛋白(SPS,Sage,3010-12)的缓冲培养液(mHTF,Sage,1023)中研磨,经洗涤后获得睾丸精子。
畸精子症患者的精子准备:患者取精前禁欲3~7 d,取卵日当天采用手淫法取精。精子采用梯度离心法进行洗涤,将洗涤好的精液加入精子缓冲液(spermrinse,Vitrolife,Swedish)中混匀后放入37 ℃、6% CO2的培养箱(Thermo Scientific Forma 3110,USA)中备用。
1.2.3 显微注射流程常规ICSI:按常规方法在400 倍显微镜(NIKON TE2000-U,日本)下挑选形态相对正常的精子(挑选要求:精子顶体完整、形态正常;精子头部外部形态完好无损;精子颈部形态正常或颈部液滴较小;精子尾部形态正常且无断缺;尽量挑选前行精子;如果死精子较多时可选微动精子或尾部弯曲的精子),用显微操作仪(NIKON NARISHIGE NT-88-V3,日本)将精子制动后行卵细胞胞质内微微注射。IMSI:用含10%替代血清白蛋白(SPS,Sage,3010-12)的缓冲培养液(mHTF,Sage,1023)于玻璃底的平皿(Delta TD ish,USA)中做数个5 μL液滴,在其中一个液滴中加入精子,无菌石蜡油(Oil,Sage,4008)覆盖。用精子放大系统(OC-TAX Cyto Screen®,德国)于6000倍的显微镜视野下根据精子的外部形态以及精子头部的空泡情况(图 1),挑选头部不含空泡,外部形态正常的精子,精子制动后行卵细胞胞质内显微注射。
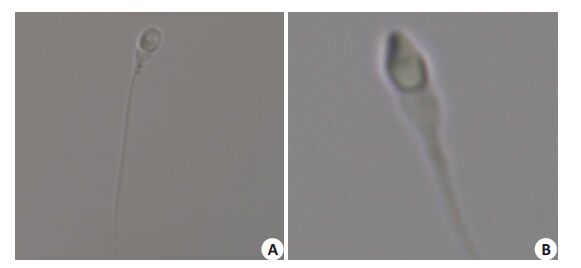
|
图 1 MSOME形态精子 Figure 1 Motile sperm organellar morphology examination (Originalmagnification: ×6000). A: Sperm with abnormal morphology; B: Sperm withnormal morphology |
显微注射后的卵子均置于序贯培养液(卵裂期胚胎用G-1/囊胚用G-2,Vitrolife,Swedish)中,在37 ℃ 、6% CO2 的培养箱(ThermoScientific Forma 3110,USA)中培养。显微注射16~20 h后观察受精情况,出现两原核为正常受精。胚胎的评估采用本实验室常规评分法(D3胚胎采用WIH[6]评分法,囊胚采用Gardner[7]评分法)对胚胎进行评分。
1.2.5 胚胎移植与妊娠结果判断选择优质胚胎或囊胚1~2个在B超下移植,移植后常规黄体酮每天肌注60 mg,共14 d,移植后14 d,查血β-HCG>10 U/mL 为妊娠阳性,继续黄体支持2周,移植4周后超声检查示子宫腔内出现孕囊及胎心搏动即确定为临床妊娠,随访3个月。
1.3 统计学分析实验结果采用SPSS 21.0软件进行统计学分析,计量资料用均数±标准差,采用单向方差分析,计数资料百分率采用R×C表卡方检验,以P<0.05为有统计学意义。
2 结果 2.1 患者的基础临床资料比较梗阻性无精子症患者在基础临床资料方面的比较,如:男方年龄、女方年龄、不孕年限、女方的基础FSH、E2值、基础窦卵泡数、Gn用量、获卵数比较均无显著性差异(P>0.05,表 1);畸精子症患者在基础临床资料方面的比较,如:男方年龄、女方年龄、不孕年限、女方的基础FSH、女方基础E2值、基础窦卵泡数、Gn用量、获卵数比较均无显著性差异(P>0.05,表 2),男方精液参数(精子浓度、前向运动精子、正常精子百分比无显著性差异(P>0.05,表 3)。
| 表 1 梗阻性无精子症患者基础临床资料比较 Table 1 Comparison of clinical characteristics of the obstructive azoospermic patients |
| 表 2 畸精子症患者基础临床资料比较 Table 2 Comparison of the clinical characteristics of the teratozoospermia |
| 表 3 畸精子症患者精液参数比较 Table 3 Comparison of the seminal parameter of the teratozoospermia |
梗阻性无精子症患者常规ICSI组与IMSI组实验室结局:MⅡ卵率、卵裂率、D3优胚率、可用囊胚率无显著性差异(P>0.05),正常受精率IMSI组显著高于ICSI组(P<0.05),临床结局:种植率、临床妊娠率、流产率未见显著性差异(P>0.05,表 4);畸精子症患者常规ICSI组与IMSI组实验室结局:MⅡ卵率、卵裂率、D3优胚率无显著性差异(P>0.05),正常受精率、可用囊胚率方面IMSI组显著高于ICSI组(P<0.05),临床结局:种植率、临床妊娠率、流产率无显著性差异(P>0.05,表 5)。
| 表 4 梗阻性无精子症患者使用常规ICSI与IMSI受精后助孕结局数据的比较 Table 4 Comparison of the outcomes between conventional ICSI and IMSI of the obstructive azoospermic patients[n (%)] |
| 表 5 畸精子症患者使用常规ICSI与IMSI受精后助孕结局数据的比较 Table 5 Comparison of the outcomes between conventional ICSI and IMSI for teratozoospermia[n (%)] |
近十年来,许多学者致力于挑选精子技术的研究,试图通过更高倍数的放大系统观察精子的细微结构,从而挑选出最优质的精子进行显微注射,提高患者的助孕结局,其中影响最广泛的为精子形态选择性胞浆内单精子注射(IMSI)技术,IMSI 技术在更高放大倍数(×6600~×13 000)下对精子进行实时、精确的观察,挑选有活力、细微形态结构正常的精子注射入卵母细胞。然而,对于这一技术是否能够改善梗阻性无精子症患者以6600~×13 000)下对精子进行实时、精确的观察,挑选有活力、细微形态结构正常的精子注射入卵母细胞。然而,对于这一技术是否能够改善梗阻性无精子症患者以及严重畸精子症患者的助孕结局是本文讨论的重点。
本研究中回顾性分析了同一时间段内173对因男方梗阻性无精子症和125例因畸精子症来我中心治疗的不孕夫妇。其中173对梗阻性无精子症患者中有82对夫妇进行IMSI 治疗,91 对夫妇行传统ICSI 治疗。125例畸精子症患者中有44对夫妇接受了IMSI治疗,71 对夫妇接受传统ICSI 治疗。分别比较两类患者的IMSI组和ICSI组的正常受精率、卵裂率、D3优胚率、囊胚形成率、种植率、临床妊娠率。最终,无精子症患者及畸精子症患者中,IMSI 组的正常受精率(77% vs84.3%);(68% vs 75.5%)均显著高于ICSI 组。曾有许多研究[7-11]证实精子细微结构异常与其内部生理功能异常存在密切联系:Garolla[7]、Franco[8]指出精子头部空泡与精子高的DNA碎片率紧密相关;同时也有研究[7]指出MSOME放大系统下形态正常的精子染色体异常发生率显著低于形态异常的精子,
且有更完善的线粒体功能。在一项研究中指出,MSOME放大系统下含有大空泡的精子染色体非整倍体发生率显著高于正常精子[10]。Hazout等[11]认为精子空泡的形成可能与精子成熟过程中介导染色质重塑的分子的异常缺陷有关。这些研究都提示我们未经过放大系统挑选过的精子,内部可能存在一定的生理功能异常,当这些异常的精子被挑选进行显微注射后,可能会影响卵母细胞的受精以及后续的胚胎发育潜能。
来自精子的父源性遗传物质从受精开始即发挥作用,并一直持续到囊胚形成阶段[21],在发育的早期阶段,精子可能会通过中心体的功能影响受精过程[22],Ugajin等[23]在一项对高倍镜下(×6000)精子中段形态与助孕结局的研究中指出:放大系统观察下精子中段形态与精子中心体的功能密切相关,中段形态正常精子的中心体功能显著优于形态异常的精子,异常的中心体功能会影响精星体的形成从而影响卵母细胞受精乃至胚胎发育过程。因此,我们推测:可能在本中心应用放大系统对精子挑选的过程中淘汰了中段形态异常的精子,从而提高了所挑选精子中中心体功能正常精子的比例,将这些放大系统下挑选的精子注射入卵母细胞后能获得较传统ICSI高的精星体形成率,从而提高了最终的正常受精率。对于畸精子症患者,应用IMSI技术除了提高正常受精率,在囊胚形成率(54.6% vs 67.9%)上也较传统ICSI组有显著性提高。这一结果与Vanderzwalmen等[24]的研究结果相似,在放大6600倍的显微镜下观察精子头部的空泡,依据空泡的情况将精子分为4组,将头部无空泡或头部只有1~2个小空泡的精子(A、B组)与精子头部有2个以上的小空泡或者有大空泡的精子(C、D组)分别注射入卵母细胞后,第三天的优胚率在A、B组显著高于C、D组;A、B组的囊胚形成率高达61.4%,其中优质囊胚占37.5%。因此,他指出精子中空泡的大小及数量会严重影响胚胎发育至囊胚阶段的潜力。因此,我们推测经过放大系统挑选过的精子,其内部的遗传物质状态更加稳定,为胚胎早期分裂发育阶段提供所需的重要基因。来自精子的父源性物质从胚胎受精便开始产生作用,人类受精卵mRNA的转录从4~8细胞阶段开始,这也标志着父方基因开始表达,如果精子本身存在缺陷,可能会影响父方基因的表达,从而导致胚胎在4~8细胞阶段以及后续阶段的发育缓滞,这种作用被称为后期父源性影响[25]。DNA链的断裂会影响卵裂球细胞基因组的复制以及表达过程,破坏细胞的稳定性;染色体非整倍体会在分裂过程中被细胞纺锤体监控位点识别,使分裂停滞[25-26]等。这些机制都可能影响胚胎的质量、发育潜能以及囊胚的形成。本研究中将畸精子症患者的精液标本在IMSI放大系统下观察,最终挑选出头部不含空泡以及其他细微形态结构正常的精子,大大降低了传统ICSI中挑选到形态异常精子的风险,挑选到的细微形态结构正常的精子可能含有更稳定的父源性遗传物质,从而使胚胎能够稳定发育到囊胚阶段。
精子形态被认为与自然受孕或辅助生殖结局均有很密切联系,精子细微形态结构异常(精子头部空泡、精子中段形态异常。
| [1] | Jequier AM. Clinical andrology--still a major problem in the treatment of infertility[J]. Hum Reprod,2004, 19 (6) : 1245-9. DOI: 10.1093/humrep/deh269. |
| [2] | De Vos A, Van De Velde H, Joris H, et al. Influence of individual sperm morphology on fertilization, embryo morphology, and pregnancy outcome of intracytoplasmic sperm injection[J]. Fertil Steril,2003, 79 (1) : 42-8. DOI: 10.1016/S0015-0282(02)04571-5. |
| [3] | Bartoov B, Eltes F, Pansky M, et al. Improved diagnosis of male fertility potential via a combination of quantitative ultramorphology and routine semen analyses[J]. Hum Reprod,1994, 9 (11) : 2069-75. |
| [4] | Abu Hassan Abu D, Franken DR, Hoffman B, et al. Accurate sperm morphology assessment predicts sperm function[J]. Andrologia,2012, 44 (Suppl 1) : 571-7. |
| [5] | Bartoov B, Berkovitz A, Eltes F. Selection of spermatozoa with normal nuclei to improve the pregnancy rate with intracytoplasmic sperm injection[J]. N Engl J Med,2001, 345 (14) : 1067-8. DOI: 10.1056/NEJM200110043451416. |
| [6] | Bartoov B, Berkovitz A, Eltes F, et al. Real-time fine morphology of motile human sperm cells is associated with IVF-ICSI outcome[J]. J Androl,2002, 23 (1) : 1-8. DOI: 10.1002/jand.2002.23.issue-1. |
| [7] | Garolla A, Fortini D, Menegazzo M, et al. High-power microscopy for selecting spermatozoa for ICSI by physiological status[J]. Reprod Biomed Online,2008, 17 (5) : 610-6. DOI: 10.1016/S1472-6483(10)60307-0. |
| [8] | Franco JG, Mauri AL, Petersen CG, et al. Large nuclear vacuoles are indicative of abnormal chromatin packaging in human spermatozoa[J]. Int J Androl,2012, 35 (1) : 46-51. DOI: 10.1111/ija.2012.35.issue-1. |
| [9] | Hammoud I, Boitrelle F, Ferfouri F, et al. Selection of normal spermatozoa with a vacuole-free head(x6300)improves selection of spermatozoa with intact DNA in patients with high sperm DNA fragmentation rates[J]. Andrologia,2013, 45 (3) : 163-70. DOI: 10.1111/and.2013.45.issue-3. |
| [10] | Perdrix A, Saïdi R, Ménard JF, et al. Relationship between conventional sperm parameters and motile sperm organelle morphology examination(MSOME)[J]. Int J Androl,2012, 35 (4) : 491-8. DOI: 10.1111/ija.2012.35.issue-4. |
| [11] | Hazout A, Dumont-Hassan M, Junca AM, et al. High-magnification ICSI overcomes paternal effect resistant to conventional ICSI[J]. Reprod Biomed Online,2006, 12 (1) : 19-25. DOI: 10.1016/S1472-6483(10)60975-3. |
| [12] | Bartoov B, Berkovitz A, Eltes F, et al. Pregnancy rates are higher with intracytoplasmic morphologically selected sperm injection than with conventional intracytoplasmic injection[J]. Fertil Steril,2003, 80 (6) : 1413-9. DOI: 10.1016/j.fertnstert.2003.05.016. |
| [13] | Wilding M, Coppola G, di Matteo L, et al. Intracytoplasmic injection of morphologically selected spermatozoa(IMSI)improves outcome after assisted reproduction by deselecting physiologically poor quality spermatozoa[J]. J Assist Reprod Genet,2011, 28 (3) : 253-62. DOI: 10.1007/s10815-010-9505-5. |
| [14] | Knez K, Tomazevic T, Zorn B, et al. Intracytoplasmic morphologically selected sperm injection improves development and quality of preimplantation embryos in teratozoospermia patients[J]. Reprod Biomed Online,2012, 25 (2) : 168-79. DOI: 10.1016/j.rbmo.2012.03.011. |
| [15] | Kim HJ, Yoon HJ, Jang JM, et al. Comparison between intracytoplasmic sperm injection and intracytoplasmic morphologically selected sperm injection in oligo-asthenoteratozoospermia patients[J]. Clin Exp Reprod Med,2014, 41 (1) : 9-14. DOI: 10.5653/cerm.2014.41.1.9. |
| [16] | Setti AS, Figueira Rde C, Braga DP, et al. Intracytoplasmic morphologically selected sperm injection benefits for patients with oligoasthenozoospermia according to the 2010 World Health Organization reference values[J]. Fertil Steril,2011, 95 (8) : 2711-4. DOI: 10.1016/j.fertnstert.2011.03.003. |
| [17] | Hameed N, Ozturk O. Testicular versus epididymal spermatozoa in intracytoplasmic sperm injection treatment cycles[J]. J Ayub Med Coll Abbottabad,2012, 22 (4) : 159-63. |
| [18] | Amirjannati N, Heidari-Vala H, Akhondi MA, et al. Comparison of intracytoplasmic sperm injection outcomes between spermatozoa retrieved from testicular biopsy and from ejaculation in cryptozoospermic men[J]. Andrologia,2012, 44 (Suppl 1) : 704-9. |
| [19] | Lewin A, Reubinoff B, Porat-Katz A, et al. Testicular fine needle aspiration: the alternative method for sperm retrieval in non-obstructive azoospermia[J]. Hum Reprod,1999, 14 (7) : 1785-90. DOI: 10.1093/humrep/14.7.1785. |
| [20] | Semi?o-Francisco L-, Braga DP, Figueira Rde C, et al. Assisted reproductive technology outcomes in azoospermic men: 10 years of experience with surgical sperm retrieval[J]. Aging Male,2010, 13 (1) : 44-50. DOI: 10.3109/13685530903342203. |
| [21] | Mauri AL, Petersen CG, Oliveira JB, et al. Comparison of day 2 embryo quality after conventional ICSI versus intracytoplasmic morphologically selected sperm injection (IMSI) using sibling oocytes[J]. Eur J Obstet Gynecol Reprod Biol,2010, 150 (1) : 42-6. DOI: 10.1016/j.ejogrb.2010.01.004. |
| [22] | Fenwick J, Platteau P, Murdoch AP, et al. Time from insemination to first cleavage predicts developmental competence of human preimplantation embryos in vitro[J]. Hum Reprod,2002, 17 (2) : 407-12. DOI: 10.1093/humrep/17.2.407. |
| [23] | Ugajin T, Terada Y, Hasegawa H, et al. The shape of the sperm midpiece in intracytoplasmic morphologically selected sperm injection relates sperm centrosomal function[J]. J Assist Reprod Genet,2010, 27 (2/3) : 75-81. |
| [24] | Vanderzwalmen P, Hiemer A, Rubner P, et al. Blastocyst development after sperm selection at high magnification is associated with size and number of nuclear vacuoles[J]. Reprod Biomed Online,2008, 17 (5) : 617-27. DOI: 10.1016/S1472-6483(10)60308-2. |
| [25] | Simon L, Murphy K, Shamsi MB, et al. Paternal influence of sperm DNA integrity on early embryonic development[J]. Hum Reprod,2014, 29 (11) : 2402-12. DOI: 10.1093/humrep/deu228. |
| [26] | Ambartsumyan G, Clark AT. Aneuploidy and early human embryo development[J]. Hum Mol Genet,2008, 17 (R1) : R10-5. |
 2015, Vol. 35
2015, Vol. 35

