2. 南方医科大学南方医院检验科,广东 广州 510515
2. Department of Laboratory Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
宇航员在航天飞行后会出现红细胞计数和血红蛋白含量减少的航天贫血症状,这不仅影响航天员的工作质量也对其身体造成严重的影响[1]。研究发现微重力影响红细胞生成是其重要原因之一,但其发生的具体机制不清[2-3]。研究证实转录因子GATA-1、GATA-2、Ets-1参与细胞红系分化的调控[4-5]。GATA-1、GATA-2 基因主要分布在红系、巨核系和T淋巴细胞中,是红细胞发育成熟所必需的基础造血因子,Ets-1基因含有高度保守的DNA结合结构域,是细胞红系分化的重要启动子[6]。细胞骨架是由微丝、微管、中间纤维组成的普遍存在于真核细胞中的骨架纤维,F-actin、β-Tubulin和Vimentin是主要的细胞骨架蛋白,对重力变化高度敏感。细胞可以通过细胞骨架系统将重力变化的刺激传递到细胞核,调控相关基因表达变化进而影响细胞的分化、信号转导等生命活动[7-8]。
近年来文献报道微重力对多种细胞的分化有影响[9-10],但对造血细胞分化转录因子及细胞骨架的影响尚未见报道。氯高铁血红素分子中含有高价铁卟啉IX,其与血红素结构相似。研究证实Hemin可作为红系细胞分化诱导剂,诱导红系祖细胞、人红白血病K562细胞内血红蛋白的合成[11]。本实验以K562细胞作为研究对象,氯高铁血红素为诱导剂,观察模拟微重力对K562 细胞红系分化的影响,同时检测GATA-1、GATA-2、Ets-1 mRNA及F-actin、β-Tubulin和Vimentin蛋白的变化,探讨模拟微重力对红系分化影响的可能机制。
1 材料与方法 1.1 主要试剂RPMI 1640 培养基、胎牛血清(Fetalbovineserum,FBS)均购自美国HyClone 公司,β-Tubulin(9F3)、Vimentin(D21H3)和GAPDH 抗兔抗体均购自美国Cell Signaling Technology公司,HRP标记的羊抗兔二抗购自美国Abcam公司,F-actin抗体和罗丹明标记的羊抗兔二抗购自北京Bioss公司,PrimeScripTMRT-PCR和SYBR® TaqTM II 试剂盒购自Takara,DAPI 购自Invitrogen,Hemin购自Sigma。
1.2 细胞培养人红白血病K562 细胞由南方医科大学检验系实验室保存。细胞接种于10% FBS的RPMI 1640 培养基,5% CO2、37 ℃适当湿度的细胞培养箱中培养。取对数生长期细胞用于实验。
1.3 微重力处理细胞应用美国国家航空航天局(NASA)研发的第4代旋转细胞培养系统(RCCS-4)模拟微重力,将细胞悬液注入RCCS-4容器中,转速调至10~12 r/min,使细胞保持均匀悬浮状即处于微重力状态。
1.4 联苯胺染色实验分4组:模拟微重力培养组(SMG组),Hemin(40 μmol/L)诱导组,模拟微重力下Hemin 诱导组(Hemin+SMG组),普通培养组(NG组,作为对照)。收集各组细胞离心去上清,加入0.25 mL PBS重悬,滴加7 μL联苯胺溶液和0.5 μL 30%双氧水混匀,室温下避光反应2 min,再滴加0.5 μL 5%亚铁氰化钾溶液室温反应10~15 min,将染好的细胞悬液滴1滴在载玻片上,加盖玻片在倒置显微下观察,染为蓝色者为阳性细胞(内含血红蛋白),未上色者为阴性细胞,每组计数500 个细胞,计算阳性细胞比率(%),重复3次。
1.5 qRT-PCR实验使用TRIzol 裂解各组细胞,提取总RNA。参照Takara 逆转录试剂盒配置20 μL 反应液,EppendorfPCR 仪扩增:37 ℃、15 min,85 ℃,5 s,逆转录合成cDNA。采用SYBR®Premix Ex TaqTM II 试剂盒,ABI7500 Fast荧光定量PCR仪进行扩增,条件为95 ℃、30 s,1个循环;95 ℃、3 s,60 ℃、30 s,40个循环。
1.6 免疫荧光染色收集各组细胞后用PBS洗3次,每次2 min,取20~30 μL滴至玻片上,加4%多聚甲醛固定20 min,PBS 洗3 次,每次2 min,0.5% Triton X-100 破膜10 min,PBS洗3次,每次2 min,5% BSA室温封闭1 h,滴加100 μL一抗溶液(以1∶100 分别稀释的F-actin、β-Tubulin、Vimentin),4 ℃湿盒孵育过夜,PBS洗3次,每次2 min,罗丹明标记的荧光二抗(1∶100)室温避光孵育1 h,PBS洗3次,每次2 min,DAPI染细胞核5 min,缓冲甘油封片。荧光显微镜(日本,Olympus IX71)下曝光相同时间,CCD摄像获得电子图片。
1.7 免疫印迹分析细胞骨架收集各组细胞后用PBS洗涤2次,加入适量RIPA强裂解液和相关磷酸酶、蛋白酶抑制剂,冰浴30 min,提取总蛋白,4 ℃温和振荡15 min,12 000 r/min 离心15 min取上清,BCA法测定蛋白浓度。10% SDS-聚丙烯酰胺凝胶电泳,湿转至PVDF膜,3% BSA封闭,分别加入一抗(1∶1000)4 ℃孵育过夜,TBST 洗膜3 次,5 min/次,加入HRP标记二抗(1∶2000)室温孵育l h,洗膜后加ECL发光液曝光,Kodak全光谱多功能成像系统检测并保存结果,Quantity One软件扫描所得条带,计算目的蛋白与GAPDH的灰度比值。
1.8 统计分析采用SPSS 20.0软件进行统计分析,t检验用于两个独立组的比较,单因素方差分析用于多组间比较,计量资料以均数±标准差表示,P<0.05为有统计学差异。
2 结果 2.1 模拟微重力对K562细胞红系分化的影响不同条件处理K562细胞48 h后行联苯胺染色,结果显示Hemin组细胞染色阳性率为(26.73±4.60)%,与NG组(0.87±0.42)%相比明显升高,具有显著性差异(P<0.001);Hemin+SMG组细胞染色阳性率(14.73±3.00)%显著低于Hemin 组,差异有统计学意义(P=0.001)。模拟微重力抑制K562细胞红系分化效果(图 1)。
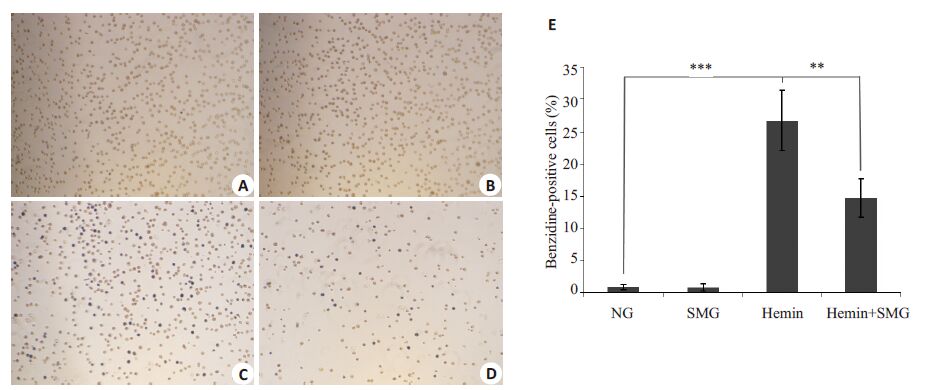
|
图 1 K562细胞联苯胺染色 Figure 1 Benzidine staining ofK562 cells under inverted microscope (Original magnification: ×100). A: normal gravity (NG); B:simulated microgravity (SMG); C: Hemin; D: Hemin and simulated microgravity. E: Data statistics of A,B,C and D. **P<0.01,***P<0.001. |
用qRT-PCR检测培养48 h内K562细胞转录因子GATA-1、GATA-2、Ets-1 的基因表达水平,结果显示Hemin 处理后,GATA-1 基因表达水平在12 h 后升高(P<0.05,图 2),GATA-2 基因表达水平在12 h 后降低(P<0.05,图 3),Ets-1 基因表达水平在6 h即出现明显降低(P<0.05,图 4);模拟微重力处理后,GATA-1 基因表达水平在24 h明显降低(P<0.05,图 2),GATA-2基因表达水平在12 h后升高(P<0.05,图 3),Ets-1基因表达水平在24 h 后出现明显升高(P<0.05,图 4);模拟微重力和Hemin共同处理组与Hemin组比较,GATA-1基因表达水平在24 h后降低(P<0.05,图 2),GATA-2基因表达水平无明显改变(图 3),Ets-1 基因表达水平在24 h后出现升高(P<0.05,图 4)。
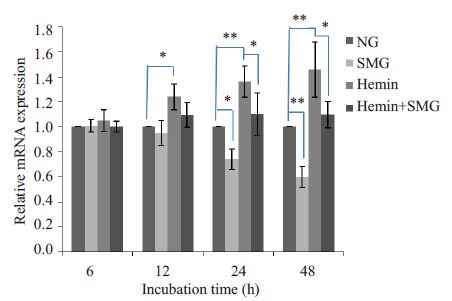
|
图 2 实时荧光定量PCR检测GATA-1 mRNA表达情况 Figure 2 Relative GATA-1 mRNA expression detected byreal-time quantitative PCR in K562 cells. *P<0.05,**P<0.01,***P<0.001. |
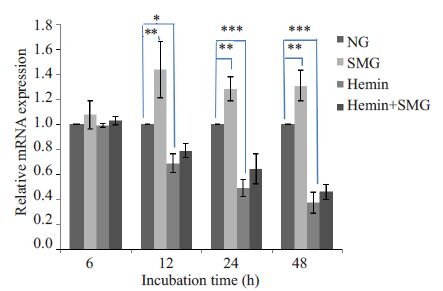
|
图 3 实时荧光定量PCR检测GATA-2 mRNA表达情况 Figure 3 Relative GATA-2 mRNA expression detected byreal-time quantitative PCR in K562 cells. *P<0.05,**P<0.01,***P<0.001. |
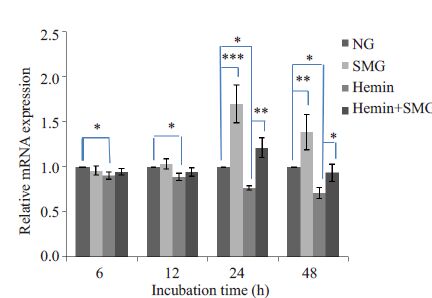
|
图 4 实时荧光定量PCR检测Ets-1 mRNA表达情况 Figure 4 Relative Ets-1 mRNA expression detected byreal-time quantitative PCR in K562 cells. *P<0.05,**P<0.01,***P<0.001 |
用qRT-PCR检测培养48 h内K562细胞细胞骨架的基因表达水平,结果显示模拟微重力处理K562细胞12、24 h F-actin 和Vimentin mRNA表达量较NG组明显下降,48 h 无明显变化(图 5A、C),12 h 后β-TubulinmRNA表达量较NG组明显下降(图 5B)。
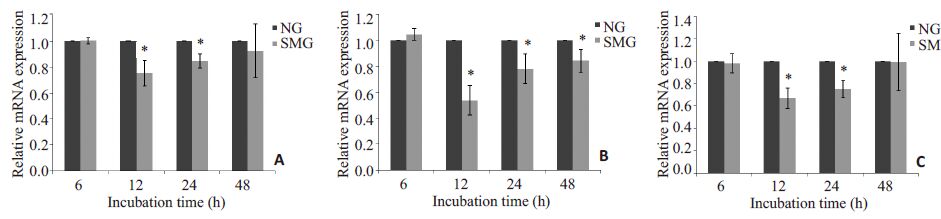
|
图 5 实时荧光定量PCR检测细胞骨架mRNA表达情况 Figure 5 Relative mRNA expressions of cytoskeletal filaments detected by real-time quantitative PCR in K562 cells. A: F-actin; B:β-Tubulin; C: Vimentin. *P<0.05 vs normal gravity |
红色荧光显示细胞骨架,蓝色荧光显示细胞核,可见模拟微重力处理K562 细胞后F-actin、β-Tubulin、Vimentin的荧光强度均低于NG组(图 6)。

|
图 6 模拟微重力下K562细胞细胞骨架的改变 Figure 6 Changes in the cytoskeletons of K562 cells exposed to simulated microgravity (Originalmagnification: ×200). A: F-actin; B: β-Tubulin; C: Vimentin. |
模拟微重力处理K562 细胞12 h 后,F-actin、β-Tubulin、Vimentin蛋白表达水平降低(P<0.05,图 7)。
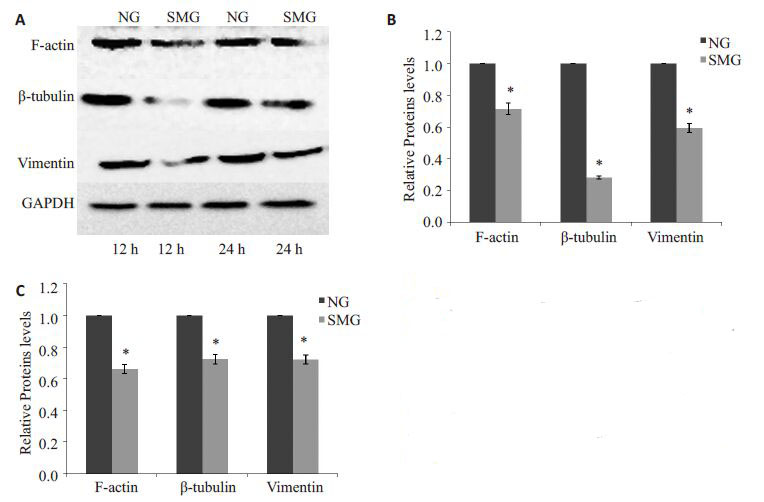
|
图 7 模拟微重力作用后K562 细胞F-actin、β-Tubulin和Vimentin蛋白表达水平变化 Figure 7 Expression F-actin,β-tubulin andvimentin in K562 cells exposed to simulatedmicrogravity. A: Bands of Western blotting; B:Relative expressions of F-actin,β-tubulin andvimentin at 12 h; C: Relative expressions ofF-actin,β-tubulin and vimentin at 24 h. *P<0.05 vs normal gravity. |
早期航天医学家是通过对飞行人员血液学指标的观察来研究航天性贫血症的发生原因[12]。近年来研究已转向体外实验以更深入的探讨失重影响红细胞生成的分子生物学机制。K562 细胞株具有多向分化的潜能,已经被广泛地应用于红系分化研究模型中[13]。Hemin是常见的细胞分化诱导剂,可以诱导造血干/祖细胞内血红蛋白合成。我们的实验结果显示Hemin处理后的K562 细胞联苯胺染色阳性率明显增高,提示Hemin能诱导K562细胞红系分化,与以往研究结果一致;模拟微重力下Hemin处理的K562细胞联苯胺染色阳性率显著低于Hemin处理组,提示模拟微重力能抑制Hemin诱导K562细胞红系分化。
红细胞是由造血干/祖细胞不断增殖、逐渐分化而来,这个过程需要多种转录因子共同调控完成[14]。本研究显示Hemin作用K562 细胞后,GATA-1 基因表达水平发生上调、GATA-2、Ets-1 基因表达水平发生下调。GATA-1是造血系统特有的转录因子,在原始细胞红系分化初始,转录因子GATA-1的远端启动子即被激活,GATA-1 基因表达上调,进而启动细胞向红系分化[15]。转录因子GATA-2的主要作用是维持未成熟造血细胞的数量,过表达GATA-2会抑制原始细胞向红系分化,促进其向巨核系分化[16-17]。转录因子Ets-1在红系分化过程中起负向调控作用,其表达下调促进细胞红系分化,同时Ets-1还可以通过上调GATA-2的表达抑制细胞红系分化[5-6]。因此,Hemin处理K562细胞后通过调控细胞内转录因子GATA-1、GATA-2、Ets-1的表达水平促进细胞红系分化。而模拟微重力作用K562细胞后,细胞内GATA-2基因表达水平在12h,GATA-1、Ets-1基因表达水平在24 h后分别出现与Hemin作用相反的结果,提示模拟微重力能负向调控K562细胞内红系分化相关转录因子表达水平。之后我们比较了模拟微重力下Hemin处理的K562细胞与单纯Hemin处理的K562细胞,发现模拟微重力能下调Hemin诱导K562细胞红系分化中GATA-1基因表达水平,上调Ets-1基因表达水平。由此推测,模拟微重力环境下K562细胞内转录因子GATA-1、GATA-2、Ets-1表达的改变是其红系分化受抑的原因之一。
细胞骨架是贯穿于细胞核和细胞质的蛋白网架体系,微丝主要以F-actin多聚体的形式存在,参与细胞分化、信号转导等活动的进行;微管正常时以β二聚体即β-Tubulin形式存在,具有维持细胞分化、辅助细胞内蛋白运输的功能;中间纤维是由核纤层蛋白聚合而成的,Vimentin为其主要组分,它可与核基质相互作用调节细胞内基因表达影响细胞分化[18-20]。模拟微重力下人体内皮细胞、成骨细胞、肿瘤细胞等多种细胞的细胞骨架可以发生解聚、重排等改变,从而影响细胞的分化、迁移、凋亡等功能[9]。研究表明细胞分化发生改变与细胞骨架的改变有关[21-22],因此我们决定研究模拟微重力对造血细胞细胞骨架F-actin、β-Tubulin 和Vimentin 的影响。在模拟微重力处理K562细胞24 h后,行免疫荧光染色观察到细胞骨架F-actin、β-Tubulin 和Vimentin 的荧光强度减弱。之后我们对细胞骨架F-actin、β-Tubulin 和Vimentin 的基因和蛋白表达情况进行分析,发现模拟微重力处理K562 细胞12 h 后细胞骨架F-actin、β-Tubulin 和Vimentin的mRNA和蛋白表达水平均明显下降,微丝、微管解聚,中间纤维断裂,细胞骨架发生破坏。处理48 h后F-actin和Vimentin表达量未见差异变化可能与细胞反馈调节及适应性改变相关,尽管模拟微重力处理48 h后F-actin和Vimentin的基因表达未见明显改变,但β-Tubulin表达仍下调,细胞骨架结构不能维持。细胞骨架结构的变化会导致下游Ras/MAPK、PI3K/Akt等信号通路发生改变,影响转录因子及增殖、分化相关基因的表达25。由此推测,模拟微重力环境下K562细胞细胞骨架破坏可能是影响细胞红系分化的相关机制。鉴于细胞骨架结构变化可以影响转录因子表达[23],因此,我们猜测模拟微重力下对重力高度敏感的细胞骨架发生破坏,影响转录因子GATA-1、GATA-2、Ets-1的表达可能是K562细胞红系分化受抑的相关机制,但这还需要进一步的验证蛋白间相互作用来证明。既往国内外对微重力影响造血细胞的研究报道较少,我们的研究初步阐明了微重力抑制造血细胞分化的可能原因,为航天性贫血症的进一步研究提供理论依据。
| [1] | Rizzo AM, Corsetto PA, Montorfano G, et al. Effects of long-term space flight on erythrocytes and oxidative stress of rodents[J]. PLoS One,2012, 7 (3) : e32361. DOI: 10.1371/journal.pone.0032361. |
| [2] | Domaratskaya EI, Michurina TV, Bueverova EI, et al. Studies on clonogenic hemopoietic cells of vertebrate in space: problems and perspectives[J]. Adv Space Res,2002, 30 (4) : 771-6. DOI: 10.1016/S0273-1177(02)00394-0. |
| [3] | Plett PA, Abonour R, Frankovitz SM, et al. Impact of modeledmicrogravity on migration, differentiation, and cell cycle control of primitive human hematopoietic progenitor cells[J]. Exp Hematol,2004, 32 (8) : 773-81. DOI: 10.1016/j.exphem.2004.03.014. |
| [4] | Duncan MT, Shin S, Wu JJ, et al. Dynamic transcription factor activity profiles reveal key regulatory interactions during megakaryocytic and erythroid differentiation[J]. Biotechnol Bioeng,2014, 111 (10) : 2082-94. DOI: 10.1002/bit.25262. |
| [5] | Lulli V, Romania P, Morsilli O, et al. Overexpression of Ets-1 in human hematopoietic progenitor cells blocks erythroid and promotes megakaryocytic differentiation[J]. Cell Death Differ,2006, 13 (7) : 1064-74. DOI: 10.1038/sj.cdd.4401811. |
| [6] | Marziali G, Perrotti E, Ilari R, et al. Role of Ets-1 in erythroid differentiation[J]. Blood Cells Mol Dis,2003, 29 (3) : 553-61. |
| [7] | Wang N, Butler JP, Ingber DE. Mechanotransduction across the cell surface and through the cytoskeleton[J]. Science,1993, 260 (5111) : 1124-7. DOI: 10.1126/science.7684161. |
| [8] | Stein GS, Van Wijnen AJ, Stein JL, et al. Implications for interrelationships between nuclear architecture and control of gene expression under microgravity conditions[J]. FASEB J,1999, 13 (Suppl) : S157-66. |
| [9] | Aleshcheva G, Sahana J, Ma X, et al. Changes in morphology, gene expression and protein content in chondrocytes cultured on a random positioning machine[J]. PLoS One,2013, 8 (11) : e79057. DOI: 10.1371/journal.pone.0079057. |
| [10] | Meyers VE, Zayzafoon M, Douglas JT, et al. RhoA and cytoskeletal disruption mediate reduced osteoblastogenesis and enhanced adipogenesis of human mesenchymal stem cells in modeled microgravity[J]. J Bone Miner Res,2005, 20 (10) : 1858-66. DOI: 10.1359/JBMR.050611. |
| [11] | Nakajima O, Iwasaki S, Hashimoto Y. Hemin-induced erythroid differentiation of human myeloleukemia K562 cell line and its modification by bioresponse modifiers[J]. Cell Mol Biol (Noisy-le-grand),1997, 43 (1) : 115-34. |
| [12] | Alfrey CP, Rice L, Udden MM, et al. Neocytolysis: physiological down-regulator of red-cell mass[J]. Lancet,1997, 349 (962) : 1389-90. |
| [13] | Zuo G, Guan T, Chen D, et al. Total saponins of Panax ginseng induces K562 cell differentiation by promoting internalization of the erythropoietin receptor[J]. Am J Chin Med,2009, 37 (4) : 747-57. DOI: 10.1142/S0192415X09007211. |
| [14] | Akashi K, He X, Chen J, et al. Transcriptional accessibility for genes of multiple tissues and hematopoietic lineages is hierarchically controlled during early hematopoiesis[J]. Blood,2003, 101 (2) : 383-9. DOI: 10.1182/blood-2002-06-1780. |
| [15] | Vannucchi AM, Linari S, Lin CS, et al. Increased expression of the distal,but not of the proximal,Gata1 transcripts during differentiation of primary erythroid cells[J]. J Cell Physiol,1999, 180 (3) : 390-401. DOI: 10.1002/(ISSN)1097-4652. |
| [16] | Ikonomi P, Rivera CE, Riordan M, et al. Overexpression of GATA-2 inhibits erythroid and promotes megakaryocyte differentiation[J]. Exp Hematol,2000, 28 (12) : 1423-31. DOI: 10.1016/S0301-472X(00)00553-1. |
| [17] | Ohneda K, Yamamoto M. Roles of hematopoietic transcription factors GATA-1 and GATA-2 in the development of red blood cell lineage[J]. Acta Haematol,2002, 108 (4) : 237-45. DOI: 10.1159/000065660. |
| [18] | Kooijman M, Bloemendal M, Traub P, et al. Fluorescence study of the nucleic acid binding site of vimentin[J]. FEBS Lett,1992, 302 (2) : 177-80. DOI: 10.1016/0014-5793(92)80434-I. |
| [19] | Stricker J, Falzone T, Gardel ML. Mechanics of the F-actin cytoskeleton[J]. J Biomech,2010, 43 (1) : 9-14. DOI: 10.1016/j.jbiomech.2009.09.003. |
| [20] | Fletcher DA, Mullins D. Cell mechanics and the cytoskeleton[J]. Nature,2010, 463 (7280) : 485-92. DOI: 10.1038/nature08908. |
| [21] | Hosu BG, Mullen SF, Critser JK, et al. Reversible disassembly of the actin cytoskeleton improves the survival rate and developmental competence of cryopreserved mouse oocytes[J]. PLoS One,2008, 3 (7) : e2787. DOI: 10.1371/journal.pone.0002787. |
| [22] | Mcbeath R, Pirone DM, Nelson CM, et al. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment[J]. Dev Cell,2004, 6 (4) : 483-95. DOI: 10.1016/S1534-5807(04)00075-9. |
| [23] | Takahashi K, Arjunan SN, Tomita M. Space in systems biology of signaling pathways--towards intracellular molecular crowding in silico[J]. FEBS Lett,2005, 579 (8) : 1783-8. DOI: 10.1016/j.febslet.2005.01.072. |
 2015, Vol. 35
2015, Vol. 35

