2. 昆明医科大学第二附属医院,检验科,云南 昆明 650101
2. Department of Clinical Laboratory, Second Affiliated Hospital of Kunming Medical University, Kunming 650101, China
特发性间质性肺纤维化是弥漫性间质性肺病中的常见类型,是一组由不同病因引起的肺破坏性疾病,主要表现为弥漫性肺泡炎、肺泡单位结构紊乱和肺纤维化,最终导致肺脏结构和功能的严重破坏,目前其发病机制尚未完全阐明,仍未找到有效的治疗方案[1-2]。IL-27 属于IL-12 家族,主要由激活的DC 细胞产生,IL-27 由p28 和EBI3 两个亚基组成,IL-27 在许多细胞功能和疾病中其重要作用[3-6]。IL-27受体也是1个异二聚体,由WSX 1 和gpl30 两个亚基组成。WSX-1 具有Ⅰ型细胞因子受体的典型特征,含有1个细胞因子受体同源(CRH)亚基,2 对保守的半胱氨酸残基,1 个WGEWS特征基序和3个与Ⅲ型纤连蛋白同源的亚基[7]。WSX-1的一些酪氨酸残基非常保守,它们给含有SH2亚基的蛋白(如磷酸化的STATs)提供了结合位点,另外WSX-1还含有可以与JAKs通路相连接的MPB1基序[8]。gpl30是IL-27和其他多种细胞因子(如IL-6、IL-11等)信号转导的重要分子[9]。
已有研究表明,TGF-β1能诱导肺纤维化[10]。本研究的前期工作也证明IL-27可以抑制肺成纤维细胞的增殖转化。然而关于IL-27受体与肺纤维化的作用关系研究尚未清楚,研究报道也非常少。本文旨在研究IL-27受体(WSX-1)对肺纤维细胞增殖与转化的作用,以及IL-27与IL-27受体相互作用对肺纤维细胞增殖的影响。
1 材料与方法 1.1 材料SPF 级(6~8 周)雄性C57/BL6 小鼠1 只,体质量18~22 g,昆明医学院动物实验中心提供。重组小鼠IL-27 因子(peproptech 公司);DMEM/F12 培养基、0.25%EDTA胰蛋白酶、胎牛血清(美国,Invitrogen);总RNA提取试剂盒(TAKARA公司);荧光定量PCR试剂盒(北京康为世纪生物公司);引物(上海生工合成部)。Vimentin 抗体,Ⅰ、Ⅲ胶原蛋白,a-SMA 和b-actin一抗购自美国proteintech公司,IL-27Ra(WSX-1)/pCDNA3.1载体由上海捷瑞公司提供。
1.2 方法 1.2.1 肺成纤维细胞的培养和鉴定取小鼠肺组织,用手术剪剪成约1 mm×1 mm×1 mm大小的组织块,贴附于25 cm2培养瓶表面,加入一定量含10%胎牛血清的DMEM/F12培养基覆盖组织块。贴壁12 h后,加入5 mL培养基培养原代成纤维细胞生长至融合状态后,加入0.25%胰蛋白酶消化液,加入含10%胎牛血清的DMEM/F12 培养基,吹打重悬细胞,按照1∶3 比例传代。传至第3代的细胞,用Vimentin单克隆抗体进行鉴定,激光共聚焦显微镜下观察。
1.2.2 实验分组根据前期实验选择TGF-β1 的浓度40 ng/mL,IL-27浓度为100 ng/mL,培养肺成纤维细胞48 h,将正式实验分为6个组:正常组,TGF-β1组,IL-27组,IL-27受体组,IL-27+IL-27受体组,TGF-β1+IL-27+IL-27受体组;IL-27受体处理组用lipofactemine2000转染试剂将IL-27Ra(WSX-1)/pCDNA3.1 重组质粒转染细胞48 h。
1.2.3 MTT法检测肺成纤维细胞增殖成纤维细胞接种于96 孔板中,5×103/孔,37 ℃、5% CO2培养箱中培养24 h,更换新鲜培养基后,按照不同分组处理细胞。设置调零孔,对照孔,每组设置3复孔。继续培养48 h。离心弃去上清,加入含500 mg/mL MTT的DMEM/F12培养基。继续培养4 h。离心弃上清,用150 mL DMSO溶解甲攒,待充分溶解后,用酶标仪检测各孔570 nm吸光度。
1.2.4 实时荧光定量PCR检测a-SMA、Ⅰ和Ⅲ型胶原(col Ⅰ、col Ⅲ)mRNA的表达采用Trizol试剂法提取各组不同处理的肺成纤维细胞RNA,逆转录为互补脱氧核糖核酸(cDNA),以此为模板行荧光定量PCR扩增,将引物稀释至10 mmol/L;设计96孔板上样顺序,每个样品做3 个重复,用水为模板作阴性对照。实验在RealTime PCR扩增仪(ABI Prism 7300HT)上进行,上下轻轻颠倒混匀试剂,然后用离心机轻微离心收集后使用。Real-time 反应体系,按照如下顺序混合试剂:Maxima® SYBR Green/ROX qPCR Master Mix(2×):12.5 mL;PCR Forward Primer(10 mmol/L):0.4 mL;PCR Reverse Primer(10 mmol/L):0.4 mL;TemplateDNA:≤500 ng;Water,nuclease-free:to 25 mL;Totalvolume:25 mL;混匀液体,将96 孔板膜覆盖在板上。Real-time 反应两步法PCR 扩增程序:Stage 1.Initialdenaturation:95 ℃ 10 min;Stage 2. Denaturation:95 ℃15 s;Annealing/Extension:60 ℃ 60 s,40 cycles。衡量结果的参数主要是观察熔解曲线和扩增曲线,用软件DataAssist™ v3.0 Software(ABI)以2-ΔΔCt方法来对结果进行分析。ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。引物如下:ColⅠ正义链5'-GGGTGAGACAGGCGAACAAG-3',反义链5'-AACCAGCAGAGCCAGGGG-3';ColⅢ正义链5'-TGCCCACAGCCTTCTACACC-3',反义链5'-GCCACCCATTCCTCCCAC-3';a-SMA 正义链5'-CTCTGTCTGGATCGGTGGC-3',反义链5'-CTTCGTCGTATTCCTGTTTGC-3'。
1.2.5 Western blotting 检测α-SMA、Ⅰ和Ⅲ型胶原蛋白表达加入预冷细胞裂解液,冰上裂解30 min,4 ℃、12 000 r/min离心5 min,取上清,Bradford法测定蛋白浓度。计算含30 mg总蛋白的溶液体积作为上样量,进行SDS-PAGE电泳后,转至PVDF膜上。转膜结束后,5%脱脂奶粉室温封闭1 h。a-SMA、Ⅰ和Ⅲ型胶原的1抗室温孵育2 h后4 ℃过夜,HRP标记的二抗室温孵育1 h 后,加显色液发光,显影定影。将胶片扫描后用Image J图像分析软件进行各条带灰度值测定,与内参照b-actin的比值作为半定量比较的依据。
1.2.6 免疫荧光检测a-SMA蛋白的表达成纤维细胞接种于6 孔板中,5×105/孔,37 ℃、5% CO2培养箱中培养24 h,更换新鲜培养基后,按照不同分组处理细胞,处理48 h后进行免疫荧光检测。每孔加入2 mL 4%多聚甲醛,室温固定细胞30 min;PBS 洗3 次;a-SMA 的1 抗4 ℃孵育过夜;加入绿色荧光标记的荧光二抗,室温孵育1 h;PBS洗3次后,在荧光显微镜下观察。
1.3 统计学处理采用SPSS 13.0统计分析软件,实验结果以均数±标准差表示,采用单因素方差分析one-way ANOVA对各组进行比较分析,以P<0.05为差异有统计学意义。
2 结果 2.1 IL-27与IL-27受体相互作用对肺成纤维细胞增殖的作用48h后在显微镜下观察肺成纤维细胞的生长状况并进行MTT检测(图 1)。光镜下细胞状态和MTT检测结果发现,IL-27组和IL-27受体组的细胞生长受到了抑制;TGF-β1组明显促进了细胞增殖;IL-27+IL-27受体共同作用组中,与IL-27组或IL-27受体组相比,并没有抑制细胞生长反而促进了细胞增殖,但不及TGF-β1 组增殖快。TGF-β1+IL-27+IL-27受体组细胞增殖与TGF-β1组相似。
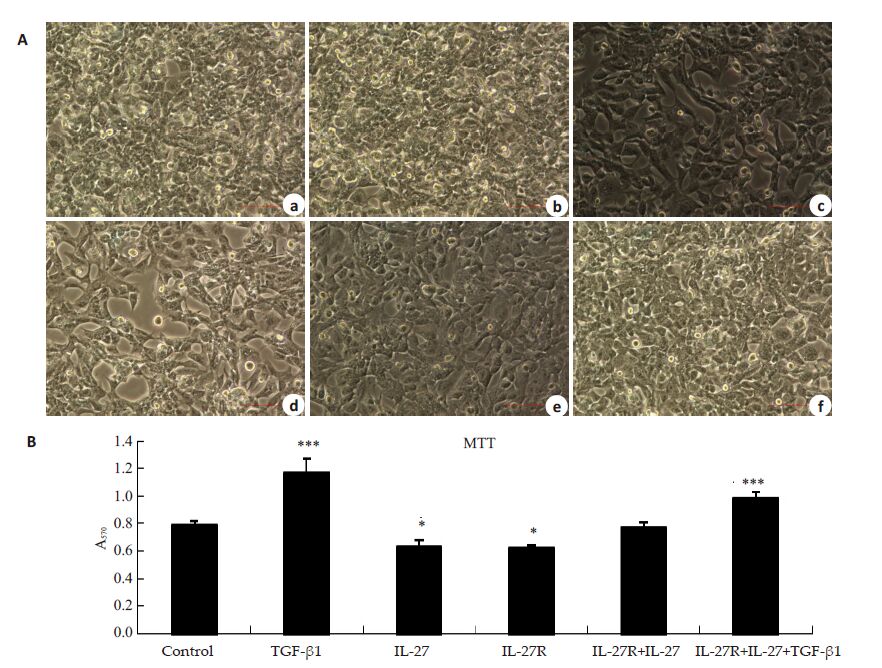
|
图 1 不同处理对肺成纤维细胞的增殖作用 Figure 1 Effect of different treatments on the proliferation of the lung fibroblasts. A: Microscopic observation of thepulmonary fibroblasts (Original magnification: × 200). B: Cell proliferation in different groups analyzed by MTTassay. *P<0.05,**P<0.01,***P<0.001 vs control. |
实时荧光定量PCR 结果显示,与正常组相比,TGF-β1 组a-SMAmRNA 出现明显上调、IL-27 组和IL-27 受体组a-SMAmRNA出现明显下降,而IL-27+IL-27受体组却没有明显变化,TGF-β1+IL-27+IL-27受体组表达明显增加。Western blotting 检测的a-SMA、蛋白表达趋势相同。a-SMA 的免疫荧光检测结果与mRNA和蛋白水平趋势相同(图 2)。
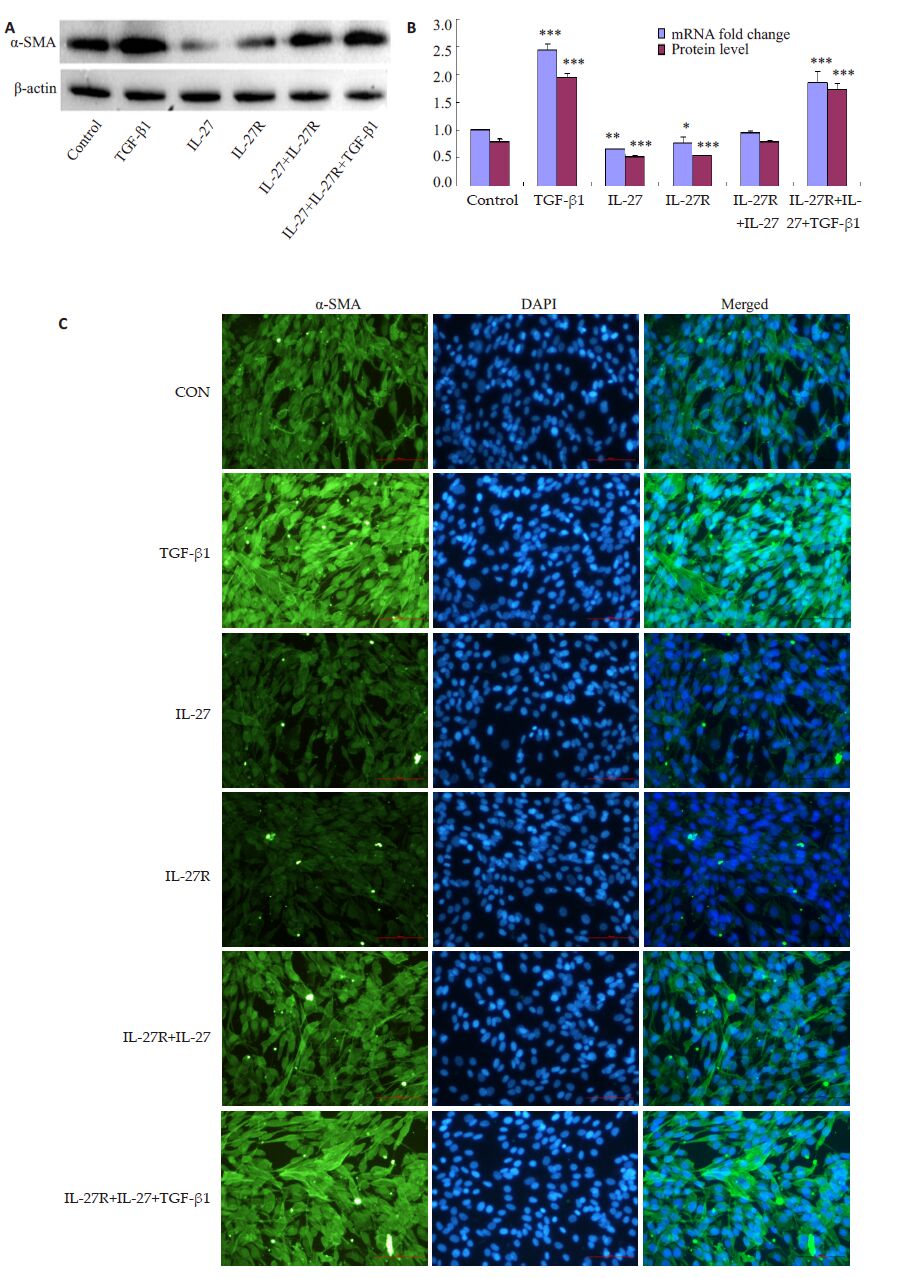
|
图 2 不同处理组中肺成纤维细胞转化作用 Figure 2 Effect of different treatments on transformation of the in lung fibroblasts. A: Western blotting for α-SMA;B: Quantitative analysis of expression of α-SMA mRNA and protein; C: Fluorescence micrographs of α-SMAexpression (Green indicates the protein of interest,and blue indicates the cell nuclei). *P<0.05,**P<0.01,***P<0.001 vs control group. |
TGF-β1 组与正常组比较,Ⅰ和Ⅲ型胶原蛋白mRNA出现明显上调,IL-27 组和IL-27 受体组Ⅰ和Ⅲ型胶原蛋白mRNA出现明显下降,而IL-27+IL-27受体组却没有明显变化,TGF-β1+IL-27+IL-27受体组表达明显增加。Western blotting检测的Ⅰ和Ⅲ型胶原蛋白蛋白表达趋势相同(图 3)。
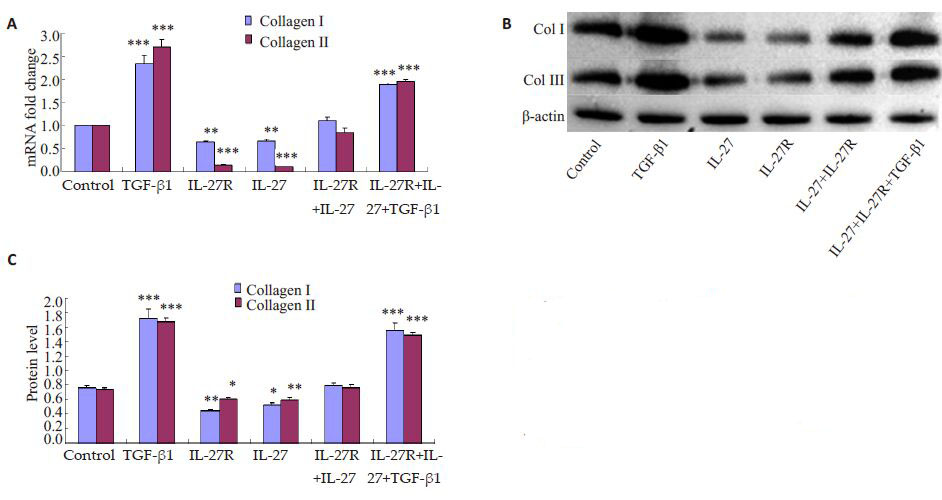
|
图 3 不同处理组中肺成纤维细胞胶原合成的作用 Figure 3 Effects of different treatments on collagensynthesis in mouse lung fibroblasts. A: Real-time PCRanalysis for collagen I and III; B: Western blotting forcollagen I and III; C: Quantitative analysis ofexpressions of collagen I and III. *P<0.05,**P<0.01,***P<0.001 vs control group. |
本研究通过检测TGF-β1、IL-27、IL-27受体对肺成纤维细胞增殖、转化和胶原蛋白的合成作用,结果发现TGF-β1具有促进小鼠肺纤维化形成中肺成纤维细胞的增殖、转化和胶原的合成作用,而IL-27、IL-27受体都具有抑制小鼠肺纤维化形成中肺成纤维细胞的增殖、转化和胶原的合成作用,但是IL-27和IL-27受体共同处理时却对肺成纤维细胞的增殖转化没有影响。这一研究结果提示了IL-27受体的可能在抑制肺纤维化形成中起到重要作用,并且IL-27和IL-27受体的中和作用也可能在某些疾病的治疗靶点。
肺成纤维细胞是肺纤维化过程中至关重要的细胞之一,其异常增殖形成肺成纤维细胞灶并分泌大量细胞外基质是肺纤维化过程中关键事件和肺纤维化进展的重要原因。由于肺成纤维细胞在肺纤维化研究中的重要作用,因此关于肺成纤维细胞增殖、转化、胶原合成作用的机制需要更深层次的研究。
IL-27 受体是1 个异二聚体,由WSX-1 和gpl30 两个亚基组成。IL-27 可以在缺少gp130 的情况下与WSX-1结合,因此WSX-1的Fc融合蛋白可以用来中和IL-27,但是可溶性的gpl30在没有WSX-1的情况下却没有中和功能[11-13]。IL-27/WSX-1与许多疾病有关。有研究表明,在炎症早期IL-27可以诱导许多炎性细胞因子[14]。在WSX-1-/-小鼠和正常小鼠利用葡聚糖硫酸钠(DSS)诱导结肠炎模型,研究发现[15],WSX-1-/-小鼠的结肠炎症状要比正常小鼠严重,提示IL27/WSX-1信号通路在炎症性肠病的发生发展过程中发挥一定作用。WSX-1-/-小鼠和正常小鼠诱导哮喘的研究发现[16],与正常小鼠相比WSX-1-/-小鼠出现更加明显的呼吸道反应,提示IL27/WSX-1信号通路可以通过Th2细胞分泌的细胞因子来减轻哮喘发病时的呼吸道反应和肺部炎症。WSX-1-/-小鼠在感染结核杆菌后TNF、IL-12p40水平升高,CD4 T细胞活化INF-g生成增加,以便增强巨噬细胞清除细菌的功能,在感染的组织中细菌负荷减少,提示WSX-1小鼠在结核菌感染后引起Thl型免疫反应不是必需的,但伴随发生慢性炎症反应增强导致WSX-1-/-小鼠死亡率增加[17]。WSX-1-/-小鼠感染克氏锥虫时,T细胞反应过度,IL-4、IL-6、TNF和IFN-g等炎症因子增多[18-19]。
本研究发现当IL-27与IL-27受体(WSX-1)都存在的情况,它们各自应该产生的对肺成纤维细胞增殖的抑制作用不存在了,对细胞的增殖没有任何影响。这可能是由于外源性的IL-27与IL-27受体的生物学功能被中和了。IL-27受体的这些反应为某些疾病提供了治疗靶点。肺纤维化的发生机制非常复杂,有许多细胞反应参与了其中。本文从成纤维细胞的角度,探讨了IL-27及其受体(WSX-1)在肺纤维化形成中的可能的机制,为阐明肺纤维化的发病机制和防治肺纤维化提供新的依据和思路。
| [1] | Agostini C, Siviero M, Semenzato G. Immune effector cells in idiopathic pulmonary fibrosis[J]. Curr Opin Pulm Med,1997, 3 (5) : 348-55. DOI: 10.1097/00063198-199709000-00006. |
| [2] | 潘有禄, 黄文海, 沈正荣, 等. 肺纤维化发生机制及治疗研究进展[J]. 中国药学杂志,2012 (23) : 1873-6. |
| [3] | Pflanz S, Timans JC, Cheung J, et al. IL-27, a heterodimericcytokine composed of EBI3 and p28 protein, induces proliferation of naive CD4+ T cells[J]. Immunity,2002, 16 (6) : 779-90. DOI: 10.1016/S1074-7613(02)00324-2. |
| [4] | Jankowski M, Kopiński P, Goc A. Interleukin-27: biological properties and clinical application[J]. Arch Immunol Ther Exp (Warsz),2010, 58 (6) : 417-25. DOI: 10.1007/s00005-010-0098-6. |
| [5] | Batten M, Ghilardi N. The biology and therapeutic potential of interleukin 27[J]. J Mol Med (Berl),2007, 85 (7) : 661-72. DOI: 10.1007/s00109-007-0164-7. |
| [6] | Wirtz S, Becker C, Fantini MC, et al. EBV-induced gene 3 transcription is induced by TLR signaling in primary dendritic cells via NF-kappa B activation[J]. J Immunol,2005, 174 (5) : 2814-24. DOI: 10.4049/jimmunol.174.5.2814. |
| [7] | Sprecher CA, Grant FJ, Baumgartner JW, et al. Cloning and characterization of a novel class I cytokine receptor[J]. Biochem Biophys Res Commun,1998, 246 (1) : 82-90. DOI: 10.1006/bbrc.1998.8576. |
| [8] | Villarino AV, Huang E, Hunter CA. Understanding the pro- and anti-inflammatory properties of IL-27[J]. J Immunol,2004, 173 (2) : 715-20. DOI: 10.4049/jimmunol.173.2.715. |
| [9] | Chen Q, Ghilardi N, Wang H, et al. Development of Th1-type immune responses requires the type I cytokine receptor TCCR[J]. Nature,2000, 407 (6806) : 916-20. DOI: 10.1038/35038103. |
| [10] | Gu H, Mickler EA, Cummings OW, et al. Crosstalk between TGF-β 1 and complement activation augments epithelial injury in pulmonary fibrosis[J]. FASEB J,2014, 28 (10) : 4223-34. DOI: 10.1096/fj.13-247650. |
| [11] | Pflanz S, Hibbert L, Mattson J, et al. WSX-1 and glycoprotein 130 constitute a signal-transducing receptor for IL-27[J]. J Immunol,2004, 172 (4) : 2225-31. DOI: 10.4049/jimmunol.172.4.2225. |
| [12] | Wirtz SJ, Tubbe I, Birkenbach MR, et al. Protection from lethalseptic peritonitis by neutralizing the biological function of Interleukin-27[J]. Gastroenterology,2006, 130 (4, 2) : A49. |
| [13] | Lucas S, Ghilardi N, Li J, et al. IL-27 regulates IL-12 responsiveness of naive CD4 + T cells through Stat1-dependent and -independent mechanisms[J]. Proc Natl Acad Sci USA,2003, 100 (25) : 15047-52. DOI: 10.1073/pnas.2536517100. |
| [14] | Wong HR, Cvijanovich NZ, Hall M, et al. Interleukin-27 is a novel candidate diagnostic biomarker for bacterial infection in critically ill children[J]. Critical Care,2012, 16 (5) : R213. DOI: 10.1186/cc11847. |
| [15] | Honda K, Nakamura K, Matsui N, et al. T helper 1-inducing property of IL-27/WSX-1 signaling is required for the induction of experimental colitis[J]. Inflamm Bowel Dis,2005, 11 (12) : 1044-52. DOI: 10.1097/01.MIB.0000191611.05466.1f. |
| [16] | Miyazaki Y, Inoue H, Matsumura M, et al. Exacerbation of experimental allergic asthma by augmented Th2 responses in WSX-1-deficient mice[J]. J Immunol,2005, 175 (4) : 2401-7. DOI: 10.4049/jimmunol.175.4.2401. |
| [17] | H?lscher C, H?lscher A, Rückerl D, et al. The IL-27 receptor chain WSX-1 differentially regulates antibacterial immunity and survival during experimental tuberculosis[J]. J Immunol,2005, 174 (6) : 3534-44. DOI: 10.4049/jimmunol.174.6.3534. |
| [18] | Hamano S, Kunisuke Himeno, Yoshiyuki Miyazaki, et al. WSX-1 is required for resistance to Trypanosoma cruzi infection by regulation of proinflammatory cytokine production[J]. Immunity,2003, 19 (5) : 657-67. DOI: 10.1016/S1074-7613(03)00298-X. |
| [19] | Carl JW, Bai XF. IL27: its roles in the induction and inhibition of inflammation[J]. Int J Clin Exp Pathol,2008 (1) : 17-23. |
 2015, Vol. 35
2015, Vol. 35

