胃癌是全球常见的恶性肿瘤之一,目前的治疗效果仍不尽如人意,特别是进展期胃癌患者,5年生存率仅30%[1],因此我们需要寻找更加有效的胃癌治疗手段。细胞自噬是将其内部受损老化的细胞器、错误折叠的蛋白质以及侵入其内的病原体进行降解,从而维持细胞内环境的稳定的过程[2]。目前研究发现自噬在胃癌的发生、发展及抵抗化疗过程中起着重要的作用[3-4]。调节细胞自噬水平有望成为胃癌治疗的新方法。
巴弗洛霉素A1(BAF-A1),是一种囊泡型H+-ATP酶抑制剂,能够抑制自噬体与溶酶体结合而抑制自噬过程[5]。在结肠癌的研究中发现BAF-A1能有效抑制肿瘤细胞增殖、促进其凋亡[6]并增强其对化疗的敏感性[7]。但其在胃癌中是否存在类似作用尚不清楚,本研究通过应用BAF-A1抑制胃癌MGC-803细胞的自噬,观察其自噬水平变化,以及对胃癌细胞增殖能力、侵袭能力、细胞凋亡水平和对奥沙利铂敏感性的影响,并进一步探讨其可能机制。
1 材料与方法 1.1 材料BAF-A1、奥沙利铂(oxaliplatin,OXA,Sigma 公司),抗Bcl-2、抗Bax、抗微管相关蛋白1 的轻链3Ⅱ(LC3-Ⅱ)、抗P62 抗体(CST 公司),抗β-actin 抗体(Santa Cruz公司)。
1.2 方法 1.2.1 细胞培养人胃癌MGC-803细胞由福建医科大学消化道恶性肿瘤教育部重点实验室赠送。用含10%胎牛血清、双抗(100 U/mL 青霉素及0.1 mg/mL 链霉素)DMEM培养基,置于37 ℃、体积分数为5%二氧化碳饱和湿度温箱中培养。
1.2.2 实验分组根据前期实验结果,我们确定OXA浓度为90 μmol/L,BAF-A1浓度为100 nmol/L,药物干预时间为24 h。我们将胃癌细胞分为4 个组:Control 组(DMEM完全培养基培养);BAF组(以含100 nmol/LBAF-A1 的DMEM完全培养基培养);OXA组(以含90 μmol/L OXA的DMEM完全培养基培养)和O+B组(以含有100 nmol/L BAF-A1 + 90 μmol/L OXA 的DMEM完全培养基培养)。
1.2.3 MTT法检测细胞活力选择取对数生长期细胞调整细胞密度为40 000个/mL,接种100 μL于96孔板,同步化24 h,药物干预24 h后加入15 μL MTT(3 g/L),37 ℃培养箱中孵育4 h,加入DMSO 200 μL溶解,震荡混匀,用酶标仪于490 nm波长条件下测定吸光度。
1.2.4 平板克隆形成实验检测克隆形成能力取对数生长期细胞,同步化24 h,药物干预24 h,胰酶消化,将各组100 个细胞接种于6 孔板中,以10%胎牛血清的DMEM培养基继续培养,待6孔板中出现肉眼可见的克隆时,终止实验,10%福尔马林固定后吉姆萨染色计数克隆数,计算克隆形成率。
1.2.5 Transwell法检测胃癌细胞侵袭和迁移能力取对数生长期细胞,无血清培养基饥饿24 h后,调整细胞密度为2.5×105/mL,取200 μL加入预先加入包被Matrigel胶的Transwell小室上室,加入相应药物,下室加入750 μLDMEM完全培养基,置于37 ℃培养箱中培养24 h,常规固定,结晶紫染色,在倒置显微镜下观察、拍照。迁移实验步骤同侵袭实验,但是Transwell小室上室不加基质胶,细胞密度为1.0×106/mL,培养基FBS浓度为5%。
1.2.6 Elisa检测核小体表达情况取对数生长期细胞,同步化24 h,药物干预24 h,核小体提取试剂盒提取核小体,BCA法蛋白定量,按Elisa试剂公司推荐步骤进行实验,450 nm酶标仪检测吸光度,建立标准曲线后,计算各组核小体表达量。
1.2.7 扫描电镜检测自噬体、自噬溶酶体形成情况取对数生长期细胞,同步化24 h后,药物干预24 h,胰酶消化收集细胞,固定,0.1 mmol/L,1%醋酸铀块染,梯度丙酮脱水,包埋,切片,常规染色,透射电镜观察,对选定视野采用20 000倍摄片。
1.2.8 免疫组织化学检测LC3Ⅱ表达取对数生长期细胞,同步24 h后,药物干预24 h,常规固定,按DAB试剂公司推荐步骤染色,封片,显微镜下观察。使用Image-Pro Plus图像分析软件计算各组LC3Ⅱ平均光密度。
1.2.9 Western blot检测自噬(Beclin1、P62)及凋亡相关蛋白(Bcl-2、Bax)表达取对数生长期细胞,同步化24 h后,药物干预相应时间,提取细胞总蛋白,BCA法蛋白定量,加等体积5×SDS上样缓冲液,沸水煮5 min,电泳,转膜,封闭2 h,一抗4 ℃孵育过夜,二抗37 ℃孵育2 h,ECL法显色曝光。使用ImageJ图像分析软件测算各组各个蛋白灰度后与相应β-actin灰度相比得出蛋白相对表达量。
1.3 统计学方法采用SPSS 19.0统计学软件对实验数据进行统计学分析。各实验均重复3次,计量数据用均数±标准差表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 BAF-A1抑制胃癌MGC-803细胞增殖药物处理24 h后,BAF组增殖能力100%显著低于Control组[(77.40±2.70)%,P<0.01],O+B组细胞增殖能力(45.32±3.05)%显著低于OXA组[(56.90±2.91)%,P<0.01]。
2.2 BAF-A1抑制胃癌MGC-803细胞克隆形成能力药物处理24 h 后,BAF 组克隆形成率(58.33±4.73)%显著低于Control组[(98.33±2.08)%,P<0.01],O+B组克隆形成率(23.33±3.51)%显著低于OXA组[(45.00±5.00)%,P<0.01]。
2.3 BAF-A1抑制胃癌MGC-803细胞侵袭能力药物处理24 h 后,迁移实验中BAF 组(253.3 ±14.3个/视野)迁移细胞数显著少于Control组(301.67±11.15个/视野,P<0.01),O+B组(171.0±10.2个/视野)迁移细胞数显著少于OXA 组(212.0±10.6 个/视野,P<0.01,图 1)。侵袭实验中BAF 组侵袭细胞数(194.0±12.5 个/视野)显著少于Control 组(236.67±12.58 个/视野,P<0.01),O+B组侵袭细胞数(93.7±12.1个/视野)显著少于OXA组(144.0±12.5个/视野,P<0.01,图 2)。
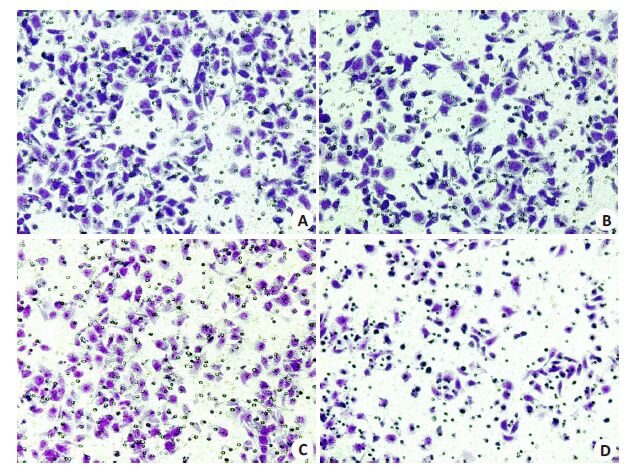
|
图 1 不同药物处理对胃癌MGC-803细胞迁移能力的影响 Figure 1 Effect of different treatments on cell migration ability of MGC-803 cells (Original magnification: ×400). A: Control group; B: BAF group; C: OXA group; D: O+B group. |
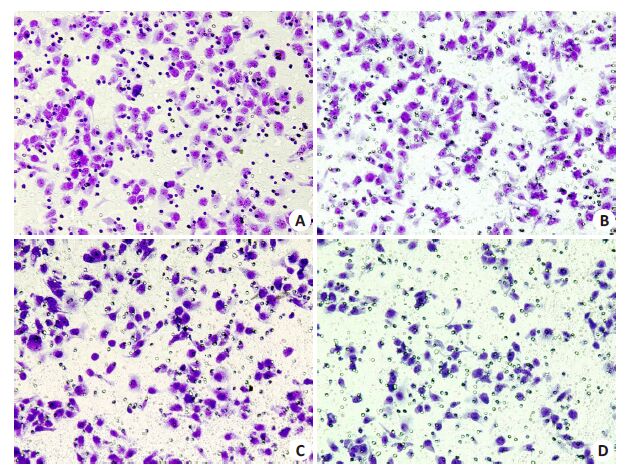
|
图 2 不同药物处理对胃癌MGC-803细胞侵袭能力的影响 Figure 2 Effect of different treatments on invasiveness of MGC-803 cells (Original magnification: ×400). A: Control group; B: BAF group; C: OXA group; D: O+B group |
药物处理24 h后,核小体表达量BAF组(588.19±43.27 pg/mL)显著高于Control组(65.24±13.33 pg/mL,P<0.01),O+B 组(1083.60±104.15 pg/mL)显著高于OXA组(831.52±60.98 pg/mL,P<0.01)。
2.5 BAF-A1能抑制胃癌MGC-803细胞正常水平的自噬,并且能够抑制OXA诱导的细胞自噬扫描电镜见Control组(图 3A)仅见到少量的自噬体产生,未见到自噬溶酶体,BAF组(图 3B)见到大量自噬体堆积,未见到大量自噬溶酶体产生,OXA组(图 3C)见到大量自噬体并可见大量自噬溶酶体,O+B组(图 3D)见到大量自噬体,未见到大量自噬溶酶体。
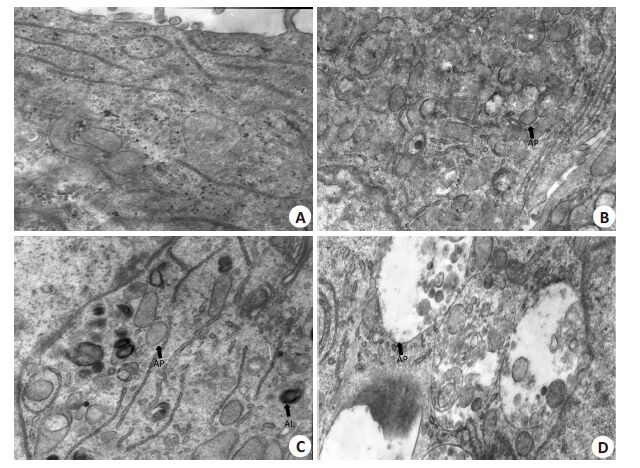
|
图 3 不同药物处理对胃癌MGC-803细胞自噬体及自噬溶酶体形成的影响 Figure 3 Effect of different treatments on formation of autophaggosomes and autolysosomes in MGC-803 cells (Original magnification: ×20 000). A: Control group; B: BAF group; C: OXA group; D: O+B group, AP: Autophaggosomes, AL: Autolysosomes |
免疫组化见LC3Ⅱ平均光密度BAF组(9866.67±321.46)显著高于Control 组(923.33±68.07,P<0.01),O+B组(12433.33±513.16)显著高于OXA组(6633.33±351.19,P<0.01,图 4)。
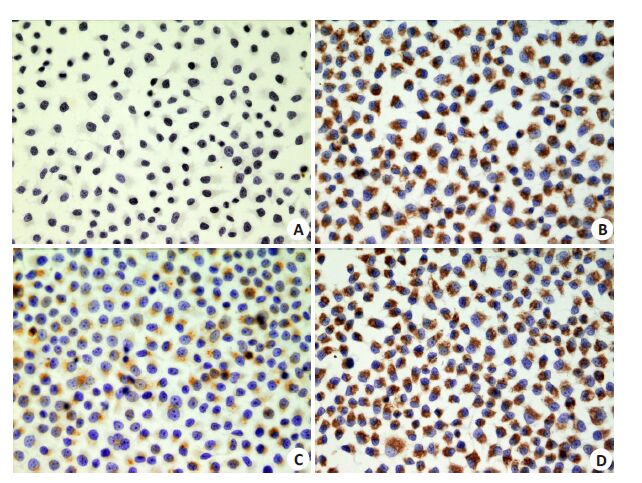
|
图 4 不同药物处理对胃癌MGC-803细胞LC3Ⅱ表达的影响 Figure 4 Expression of LC3-II in MGC-803 cells in different groups (Original magnification: ×400). A: Control group; B: BAF group; C: OXA group; D: O+B group |
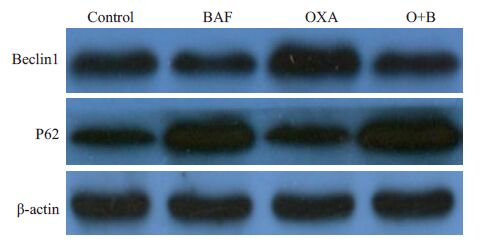
Western blot结果显示Beclin1相对表达量BAF组(0.77±0.04)显著低于Control 组(1.04±0.08,P<0.01),O+B组(1.52±0.08)显著低于OXA组(1.82±0.14,P<0.01)。P62 相对表达量BAF组(1.77±0.11)显著高于Control 组(0.89±0.03,P<0.01),O+B组(2.05±0.09)显著高于OXA组(1.09±0.15,P<0.01,图 5)。
|
图 5 不同药物处理对胃癌MGC-803细胞自噬相关蛋白 表达的影响 Figure 5 Expression of autophagy-associated proteins in MGC-803 cells in different groups |
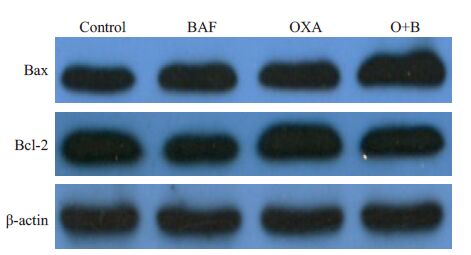
Western blot结果显示抗凋亡蛋白Bcl-2相对表达量BAF组(0.78±0.04)显著低于Control组(0.89±0.03,P<0.01),O+B组(0.93±0.04)显著低于OXA组(1.30±0.03,P<0.01)。促凋亡蛋白Bax 相对表达量BAF 组(1.05±0.06)显著高于Control 组(0.60±0.08,P<0.01),O+B组(1.63±0.12)显著高于OXA组(1.22±0.11,P<0.01,图 6)。
|
图 6 不同药物处理对胃癌MGC-803细胞凋亡相关蛋白 表达的影响 Figure 6 Expression of apoptosis-related proteins in MGC-803 cells with different treatments |
细胞自噬在胃癌的发生、发展及抵抗化疗过程中均起着重要的作用[3-4]。细胞自噬是一种细胞内成分自我降解的过程,自噬体包绕细胞质和受损细胞器后闭合形成具有双层膜结构的完整自噬体,随后其与溶酶体融合,形成自噬溶酶体,自噬溶酶体内成分被溶酶体内酶系统降解后形成小分子物质供细胞重新合成所需细胞组分。
Beclin1、LC3-Ⅱ、P62是自噬常见观察指标,Beclin1主要通过与Ⅲ型磷脂肌醇-3-激酶形成复合物调节其他自噬相关蛋白在自噬前体中的定位从而控制自噬的进程,Beclin1的表达量在一定程度上可以反应自噬水平的高低[8-9]。LC3 在细胞有两种存在形式,即LC3-Ⅰ和LC3-Ⅱ,LC3-Ⅰ经过泛素化蛋白酶系统的加工修饰并与自噬体膜表面的磷脂酰乙醇胺(PE)结合形成LC3-Ⅱ[10],因此LC3-Ⅱ在细胞内的表达量与自噬泡的数量密切相关[11]。P62由原癌基因C-Myc编码,位于细胞核内,自噬发生时,P62与泛素化的蛋白质在细胞质中结合,随后与定位于自噬内膜中的LC3-Ⅱ形成复合体,最后与LC3-Ⅱ一起在自噬溶酶体内被降解[12],因此P62表达量的变化也能反映自噬水平的改变[13]。
本课题组前期实验发现自噬相关蛋白LC3Ⅱ及Beclin1相对表达量越高提示胃癌恶性度越高[3],说明高自噬水平与胃癌侵袭转移能力有关。本实验发现BAF组与Control组相比自噬溶酶体显著减少,自噬体大量堆积,LC3Ⅱ大量堆积,Beclin1相对表达量减少而P62相对表达量增多,综合分析说明自噬水平显著降低,此时细胞同时细胞增殖活力及克隆形成能力降低,核小体表达量升高,Bcl-2表达量降低,Bax表达量升高,说明细胞增殖抑制,凋亡水平升高。说明BAF-A1通过抑制自噬能够抑制胃癌MGC-803 细胞增殖侵袭,促进凋亡。这与Michel[14]在前列腺癌,Wu等[6]在结肠癌中的研究结果类似。
Xu 等[15]研究者发现奥沙利铂作用于胃癌细胞一段时间后,胃癌细胞通过提高自噬水平可以增强其对奥沙利铂的抵抗能力。本实验中我们观察到O+B 组与OXA组相比自噬体大量堆积,自噬溶酶体减少,LC3Ⅱ大量堆积,Beclin1相对表达量减少,P62相对表达量增多,这说明BAF-A1能够抑制奥沙利铂诱导的保护性自噬,此时O+B组增殖能力显著下降,克隆形成能力降低,侵袭转移能力降低,核小体表达量升高,Bcl-2表达量降低,Bax表达量升高,说明BAF-A1能够增强奥沙利铂的药物敏感性。Ito[16]在脑胶质瘤的研究中也有类似的发现。
值得注意的是,我们观察到BAF组及O+B组自噬相关蛋白LC3Ⅱ、P62均高于OXA组,虽然在正常情况下LC3Ⅱ与自噬呈正相关,P62与自噬呈负相关,但是此时我们不能认为自噬水平BAF 组和O+B 组高于OXA组,因为LC3-Ⅱ表达于自噬体的内、外膜上,而P62与自噬体内膜上的LC3-Ⅱ相互结合,在自噬体与溶酶体结合以后内膜上的LC3-Ⅱ、P62被降解,自噬晚期抑制剂BAF-A1抑制了自噬体与溶酶体的结合,从而抑制了自噬体内膜的LC3-Ⅱ、P62被降解,使它们大量堆积,但是此时自噬过程是被抑制的,这与Klionsky,Kanamori等[13, 18]研究者的研究相类似,电镜结果也印证了这一结果,由此可见不能单独以蛋白的表达水平来评估自噬水平,而应该综合多个指标进行评估。
本实验发现BAF-A1可以通过降低正常水平的自噬而抑制胃癌MGC-803细胞的增殖,促进其凋亡降低其恶性程度,同时可以通过抑制保护性自噬而提高胃癌细胞对奥沙利铂的敏感性,减少化疗抵抗的产生,这一发现值得进一步在体内实验中验证并探讨其临床应用的可能性。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin,2011, 61 (2) : 69-90. DOI: 10.3322/caac.v61:2. |
| [2] | 郭倩倩, 刘志燕, 姜丽丽, 等. 营养缺乏对人肺癌细胞自噬的诱导作用[J]. 南方医科大学学报,2014, 34 (5) : 627-30. |
| [3] | 李良庆, 潘敦, 林振孟. 自噬相关基因Beclin1和微管相关蛋白轻链3 在胃癌组织中的表达及临床意义[J]. 中华实验外科杂志,2014, 31 (3) : 508-10. |
| [4] | Zhang HQ, He B, Fang N, et al. Autophagy inhibition sensitizes cisplatin cytotoxicity in human gastric cancer cell line SGC7901[J]. Asian Pac J Cancer Prev,2013, 14 (8) : 4685-8. DOI: 10.7314/APJCP.2013.14.8.4685. |
| [5] | Yamamoto A, Tagawa Y, Yoshimori T, et al. Bafilomycin a1 prevents maturation of autophagic vacuoles by inhibiting fusion between autophagosomes and lysosomes in rat hepatoma cell line, H-4-II-E cells[J]. Cell Struct Funct,1998, 23 (1) : 33-42. DOI: 10.1247/csf.23.33. |
| [6] | Wu YC, Wu WK, Li Y, et al. Inhibition of macroautophagy by bafilomycin A1 lowers proliferation and induces apoptosis in colon cancer cells[J]. Biochem Biophys Res Commun,2009, 382 (2) : 451-6. DOI: 10.1016/j.bbrc.2009.03.051. |
| [7] | Greene LM, Nolan DP, Regan-Komito D, et al. Inhibition of late-stage autophagy synergistically enhances pyrrolo-1, 5- benzoxazepine-6-induced apoptotic cell death in human colon cancer cells[J]. Int J Oncol,2013, 43 (3) : 927-35. |
| [8] | Luo S, Rubinsztein DC. Apoptosis blocks Beclin 1-dependent autophagosome synthesis: an effect rescued by Bcl-xL[J]. Cell Death Differ,2010, 17 (2) : 268-77. DOI: 10.1038/cdd.2009.121. |
| [9] | Scarlatti F, Maffei R, Beau I, et al. Role of non-canonical Beclin 1-independent autophagy in cell death induced by resveratrol in human breast cancer cells[J]. Cell Death Differ,2008, 15 (8) : 1318-29. DOI: 10.1038/cdd.2008.51. |
| [10] | Mizushima N. Methods for monitoring autophagy[J]. Int J Biochem Cell Biol,2004, 36 (12) : 2491-502. DOI: 10.1016/j.biocel.2004.02.005. |
| [11] | Tanida I, Ueno T, Kominami E. LC3 conjugation system in mammalian autophagy[J]. Int J Biochem Cell Biol,2004, 36 (12) : 2503-18. DOI: 10.1016/j.biocel.2004.05.009. |
| [12] | Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J]. J Biol Chem,2007, 282 (33) : 24131-45. DOI: 10.1074/jbc.M702824200. |
| [13] | Klionsky DJ, Abeliovich H, Agostinis P, et al. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J]. Autophagy,2008, 4 (2) : 151-75. DOI: 10.4161/auto.5338. |
| [14] | Michel V, Licon-Munoz Y, Trujillo K, et al. Inhibitors of vacuolar ATPase proton pumps inhibit human prostate cancer cell invasion and prostate-specific antigen expression and secretion[J]. Int J Cancer,2013, 132 (2) : E1-10. DOI: 10.1002/ijc.27811. |
| [15] | Xu L, Qu XJ, Liu YP, et al. Protective autophagy antagonizes oxaliplatin-induced apoptosis in gastric cancer cells[J]. Chin J Cancer,2011, 30 (7) : 490-6. |
| [16] | Ito H, Daido S, Kanzawa T, et al. Radiation-induced autophagy is associated with LC3 and its inhibition sensitizes malignant glioma cells[J]. Int J Oncol,2005, 26 (5) : 1401-10. |
| [17] | Li Y, Zhang J, Ma H, et al. Protective role of autophagy in matrineinduced gastric cancer cell death[J]. Int J Oncol,2013, 42 (4) : 1417-26. |
| [18] | Kanamori H, Takemura G, Goto K, et al. Autophagy limits acute myocardial infarction induced by permanent coronary artery occlusion[J]. Am J Physiol Heart Circ Physiol,2011, 300 (6) : H2261-71. DOI: 10.1152/ajpheart.01056.2010. |
 2015, Vol. 35
2015, Vol. 35

