丙酮醛是一种葡萄糖代谢的中间产物[1],糖尿病时丙酮醛在体内含量显著增高[2]。丙酮醛不仅能导致晚期糖基化终产物(AGEs)在体内大量聚集,还能对多种细胞造成直接损害[1-4]。有研究报道丙酮醛可以抑制血管新生[5],但是其机制仍未完全阐明。整合素β3与细胞迁移密切相关[6-7],而丙酮醛对β3 表达的影响未见文献报道。因此本研究拟采用丙酮醛直接刺激体外培养的人脐静脉内皮细胞(HUVECs),观察HUVECs迁移的变化;另外检测整合素β3的表达,并采用β3的特异性抗体LM609进行干预,旨在查明丙酮醛对HUVECs迁移的影响,并从β3的角度探讨其机制。
1 材料与方法 1.1 材料 1.1.1 细胞与试剂HUVECs(Cascade Biologics)、DMEM培养液(Hyclon)、胎牛血清(杭州四季青)、胰蛋白酶消化液(碧云天)、丙酮醛(Sigma)、LM609(Merkmillipore)、抗β3一抗(Cell signaling Technology)、抗β-actin一抗(Cell signaling Technology)、CCK-8试剂盒(碧云天)。
1.1.2 仪器CO2恒温培养箱(日本SANYO)、EVOS倒置显微镜(美国AMG)、多功能酶标仪(美国MolecularDevices)、超高灵敏度化学发光成像系统(美国Bio-Rad)、净化工作台(苏州净化)、冷冻高速离心机(美国Thermo Scientific)。
1.2 方法 1.2.1 细胞培养冻存的HUVECs 从液氮中取出后,37 ℃恒温水浴箱中迅速融化,1000 r/min离心5 min,弃上清,加入6 mL含10%胎牛血清的DMEM培养基,接种到25 cm2细胞培养瓶中,置于37 ℃、5% CO2的孵箱中静置24 h,隔天换液,显微镜下可见HUVECs不断生长分化,呈鹅卵石样不断铺满培养瓶底。当细胞长至90%融合时进行细胞传代。
1.2.2 细胞划痕实验HUVECs接种于12孔板,待细胞长至90%融合,无血清DMEM饥饿12 h,用200 μL枪头对细胞作划痕后,PBS清洗3次。分别加入0、25、50、100和200 μmol/L的丙酮醛,并于划痕后0和24 h于倒置显微镜下拍照,测量迁移距离。
1.2.3 细胞迁移实验采用Transwell皿(孔径8 μm)进行。HUVECs接种于transwell 皿顶室,然后分别加入0、25、50、100、200 μmol/L的丙酮醛刺激,24 h后,用棉签将transwell膜上层未迁移的细胞擦去,1%的结晶紫染色,显微镜下随机选取3~5个视野观察拍照并计算迁移到transwell膜底层的细胞数目。在采用LM609干预时,HUVECs接种于transwell皿后,分别加入LM609和IgG刺激细胞,24 h后计算迁移的细胞数目。迁移实验重复4次,以4次实验的结果进行统计分析。
1.2.4 免疫印迹HUVECs接种于直径3.5 cm平皿中,长至90%融合后,无血清DMEM培养基饥饿12 h,分别加入0、25、50、100、200 μmol/L的丙酮醛刺激24 h,或丙酮醛(100 μmol/L)分别刺激0、12、24和48 h,刺激完毕后,提取细胞总蛋白。采用5%积层胶和10%的分离胶进行聚丙烯酰胺凝胶电泳后,将蛋白转至PVDF膜,5%的脱脂奶粉室温下封闭1 h,加入抗β3 抗体(1∶1000)4 ℃孵育过夜,加入辣根过氧化物酶(HRP)偶联的二抗(1∶1000),室温下孵育1 h,ECL化学发光法检测。1.2.5 细胞毒性检测HUVECs接种于96孔板,待细胞长至90%融合后无血清DMEM饥饿12 h,分别加入0、25、50、100和200 μmol/L的丙酮醛刺激细胞,24 h后使用CCK-8试剂盒检测细胞活力。
1.3 统计学方法数据均以均数±标准差表示。采用SPSS19.0软件分析。所有数据进行单向方差分析(One-Way ANOVA)后,再进行Post Hoc检验(方差齐性时采用LSD法;方差不齐时采用Dunnett's T3法),P<0.05为差异有统计学意义。
2 结果 2.1 丙酮醛抑制细胞迁移分别采用浓度梯度的丙酮醛(0、25、50、100 和200 μmol/L)刺激HUVECs,结果发现,与正常对照组相比,当丙酮醛浓度达到100 μmol/L时,就可以显著降低HUVECs的迁移数目(P<0.05,图 1)和迁移距离(P<0.05,图 2)。这表明丙酮醛以浓度依赖的方式降低HUVECs的迁移。
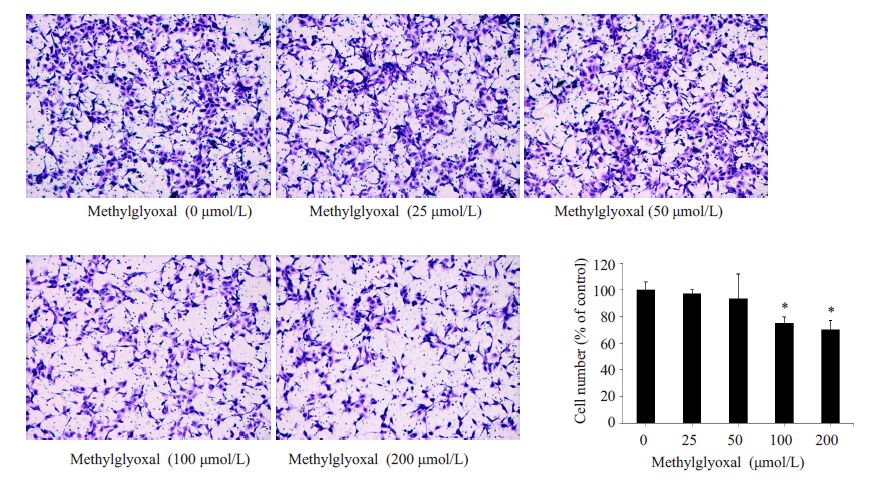
|
图 1 丙酮醛抑制HUVECs的迁移数目 Figure 1 Number of migrated HUVECs treated with different concentrations of methylglyoxal (Original magnification: ×100). *P<0.05 vs control |
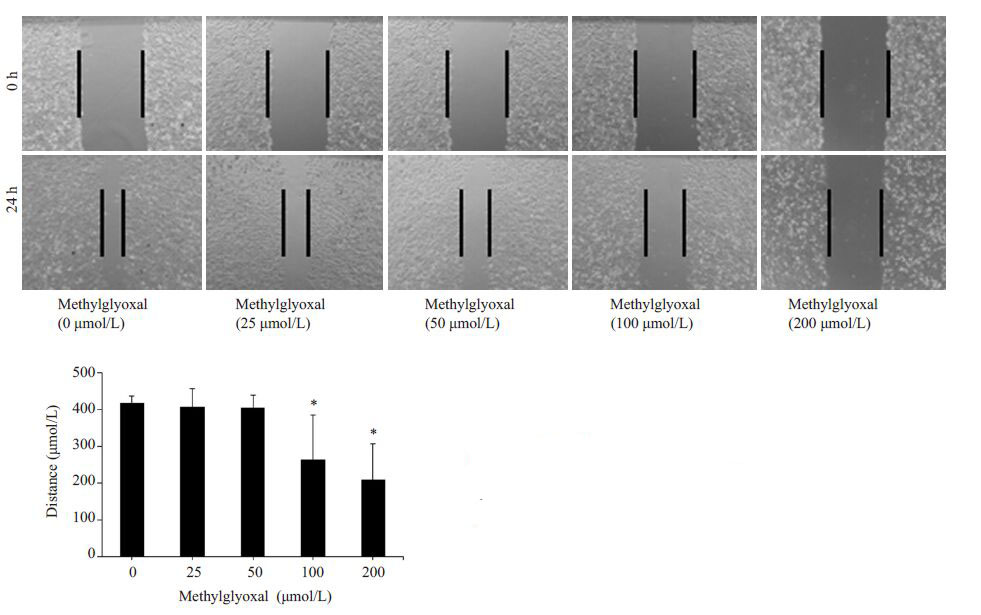
|
图 2 丙酮醛抑制HUVECs的迁移距离 Figure 2 Migration distance of HUVECs treated with different concentrations of methylglyoxal (Original magnification: ×100). *P<0.05 vs control. |
分别采用浓度梯度的丙酮醛(0、25、50、100 和200 μmol/L)刺激HUVECs 24 h,结果发现,与正常对照组相比,当丙酮醛浓度为50、100和200 μmol/L时,显著降低了整合素β3的表达(P<0.05,图 3)。而采用100 μmol/L丙酮醛分别刺激细胞12、24 和48 h 发现,丙酮醛刺激12 h就可以显著降低β3的表达(P<0.05,图 4)。这表明丙酮醛以时间依赖和浓度依赖的方式介导β3表达降低。
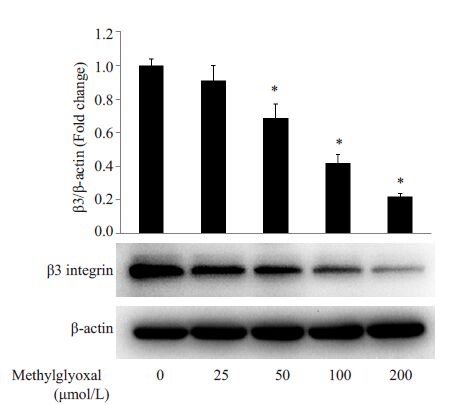
|
图 3 丙酮醛以浓度依赖的方式降低整合素β3的表达 Figure 3 Methylglyoxal decreased the expression of β3 in HUVECs in a concentration-dependent manner. *P<0.05 vs control |
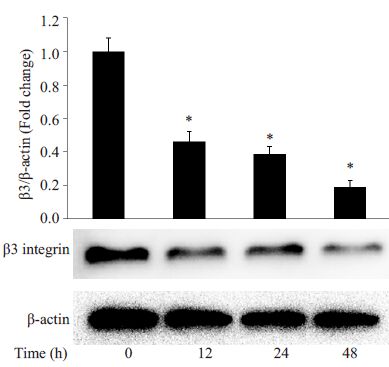
|
图 4 丙酮醛以时间依赖的方式降低整合素β3的表达 Figure 4 Methylglyoxal decreased the expression of β3 integrin in HUVECs in a time-dependent manner. *P<0.05 vs control |
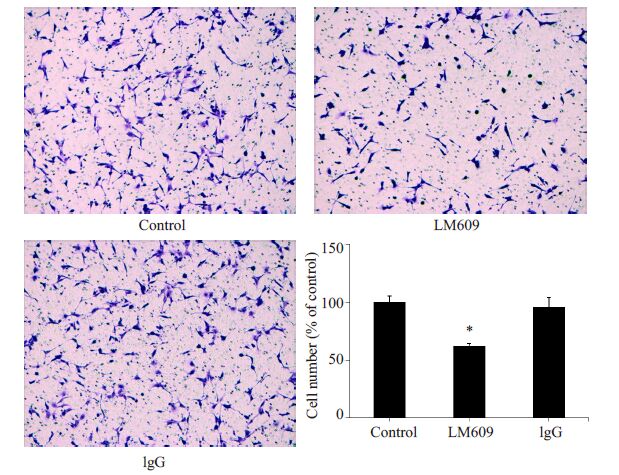
为了观察β3对细胞迁移的影响。我们采用β3的特异性抗体LM609刺激细胞,结果发现,与空白对照组和IgG对照组相比,LM609显著抑制了HUVECs迁移(P<0.05,图 5)。
|
图 5 LM609抑制HUVECs迁移 Figure 5 LM609 inhibited HUVEC migration (Original magnification: ×100). *P<0.05 vs control |
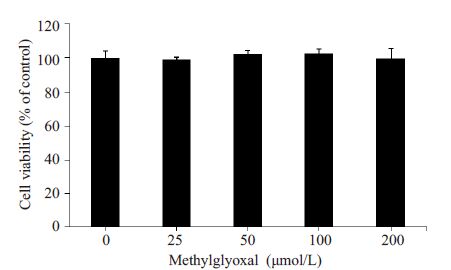
为了排除HUVECs细胞活力改变对迁移造成的影响,本研究采用丙酮醛(0、25、50、100和200 μmol/L)刺激HUVECs 24 h,然后采用CCK-8试剂盒检测细胞活力,结果发现各个组之间HUVECs细胞活力无显著性差异(P>0.05,图 6)。
|
图 6 丙酮醛对HUVECs细胞活力的影响 Figure 6 Effect of methylglyoxal on HUVEC viability |
本研究发现丙酮醛作为糖尿病时显著增加的糖代谢中间产物,可以直接降低HUVECs整合素β3的表达,并因此抑制HUVECs迁移。这可能为糖尿病血管新生受损提供了新的机制。
血管新生是在原有血管结构上形成新血管的生物学行为。内皮细胞在血管新生的发生发展中起到关键作用,内皮细胞的迁移、增殖和粘附是血管新生必不可少的过程。血管新生受损与糖尿病血管并发症密切相关[8-9]。血管新生受损后,缺血后的血流灌注减少,这导致2 型糖尿病患者冠心病和外周血管疾病预后不良[10-11];另外,血管新生不足也是伤口修复异常和糖尿病皮肤溃疡的重要原因[12]。尽管已知糖尿病时血管新生受损,但是其机制仍未完全阐明。
越来越多的证据表明,AGEs及其主要的前体成分——丙酮醛在糖尿病血管并发症发生发发展中发挥重要作用。因为丙酮醛既是介导AGEs形成的重要物质[1],也可以直接作用于细胞导致内皮细胞损伤[5],所以丙酮醛对血管新生的影响日益引起人们的重视。本研究发现丙酮醛以浓度依赖性的方式显著抑制HUVECs的迁移。也有其他文献报道丙酮醛可以抑制血管新生[5],这与我们的研究结果一致。虽然发现丙酮醛可能通过介导细胞自噬,增加VEGFR-2降解抑制血管新生,但血管新生是受多种细胞因子调控,涉及多条细胞内信号转导通路的复杂过程,其他因子或信号通路在丙酮醛抑制血管新生中的作用仍需进行深入研究。
整合素为细胞黏附分子家族的重要成员之一,通常由α和β两个亚基构成异二聚体。整合素主要介导细胞与细胞、细胞与细胞外基质(ECM)之间的相互黏附,并介导细胞与ECM 之间的双向信号传导[13]。其中,整合素αvβ3可以表达于内皮细胞等多种细胞类型,是玻连蛋白最重要的受体[13]。研究发现整合素αvβ3参与血管新生的调节[14],αvβ3 与其配体玻连蛋白的结合,对VEGF介导的血管新生至关重要。整合素αvβ3目前已成为许多抗肿瘤血管生成药物的靶点[15]。本研究发现,丙酮醛以浓度依赖和时间依赖的方式显著降低了β3的表达,而β3的特异性抗体LM609显著抑制了HUVECs的迁移。这提示丙酮醛可能通过降低β3的表达抑制了HUVECs的迁移。Manes等[6]已经证明整合素αvβ3通过上调cdc2的表达介导细胞迁移,也有研究报道下调整合素β3之后,显著抑制了肺癌小细胞的迁移[7],这些研究都与我们的结果一致。
我们还发现,本研究中所使用的丙酮醛浓度(0、25、50、100和200 μmol/L)对细胞活力都无显著性影响,这就排除了细胞活力改变对HUVECs迁移造成的影响。另外值得注意的是,50 μmol/L的丙酮醛作用24 h即可显著降低β3的表达,但是50 μmol/L的丙酮醛并未引起HUVECs迁移数目和迁移距离的显著下降,这可能是因为β3 的降低对HUVECs迁移造成影响需要一定的时间。而对于丙酮醛具体是通过怎样的细胞通路改变β3的表达仍然需要进一步的研究。
综上所述,本研究发现丙酮醛显著降低了HUVECs 整合素β3 的表达,并因此抑制了细胞的迁移。这为阐释糖尿病时血管新生受损提供了新的机制,有助于为防治糖尿病血管并发症寻找新的治疗靶点。
| [1] | Brownlee M. The pathobiology of diabetic complications-A unifying mechanism[J]. Diabetes,2005, 54 (6) : 1615-25. DOI: 10.2337/diabetes.54.6.1615. |
| [2] | Voziyan P, Brown KL, Chetyrkin S, et al. Site-specific AGE modifications in the extracellular matrix: a role for glyoxal in protein damage in diabetes[J]. Clin Chem Lab Med,2014, 52 (1) : 39-45. |
| [3] | Bennmann D, Horstkorte R, Hofmann B, et al. Advanced glycation endproducts interfere with adhesion and neurite outgrowth[J]. PLoS One,2014, 9 (11) : e112115. DOI: 10.1371/journal.pone.0112115. |
| [4] | Hegab Z, Gibbons S, Neyses L, et al. Role of advanced glycation end products in cardiovascular disease[J]. World J Cardiol,2012, 4 (4) : 90-102. DOI: 10.4330/wjc.v4.i4.90. |
| [5] | Liu H, Yu S, Zhang H, et al. Angiogenesis impairment in diabetes: role of methylglyoxal-induced receptor for advanced glycation endproducts, autophagy and vascular endothelial growth factor receptor 2[J]. PLoS One,2012, 7 (10) : e46720. DOI: 10.1371/journal.pone.0046720. |
| [6] | Manes T, Zheng DQ, Tognin S, et al. Alpha(v)beta3 integrin expression up-regulates cdc2, which modulates cell migration[J]. J Cell Biol,2003, 161 (4) : 817-26. DOI: 10.1083/jcb.200212172. |
| [7] | Li N, Zhang JP, Guo S, et al. Down-regulation of β3-integrin inhibits bone metastasis of small cell lung cancer[J]. Mol Biol Rep,2012, 39 (3) : 3029-35. DOI: 10.1007/s11033-011-1065-y. |
| [8] | Kononenkov VI, Klimontov VV, Kuznetsova IV. Impaired angiogenesis and lymphangiogenesis in diabetes mellitus[J]. Arkh Patol,2014, 76 (2) : 55-9. |
| [9] | Ishikura K, Misu H, Kumazaki M, et al. Selenoprotein P as a diabetes-associated hepatokine that impairs angiogenesis by inducing VEGF resistance in vascular endothelial cells[J]. Diabetologia,2014, 57 (9) : 1968-76. DOI: 10.1007/s00125-014-3306-9. |
| [10] | LimaEG, Hueb W, Garcia RM, et al. Impact of diabetes on 10-year outcomes of patients with multivessel coronary artery disease in the Medicine, Angioplasty, or Surgery Study II (MASS II) trial[J]. Am Heart J,2013, 166 (2) : 250-7. DOI: 10.1016/j.ahj.2013.04.017. |
| [11] | RheeSY, Kim YS. Peripheral arterial disease in patients with type 2 diabetes mellitus[J]. Diabetes Metab J,2015, 39 (4) : 283-90. DOI: 10.4093/dmj.2015.39.4.283. |
| [12] | ProsdocimiM, Bevilacqua C. Impaired wound healing in diabetes: the rationale for clinical use of hyaluronic acid plus Silver sulfadiazine[J]. Minerva Med,2012, 103 (6) : 533-9. |
| [13] | DeFranceschi N, Hamidi H, Alanko J, et al. Integrin traffic-the update[J]. J Cell Sci,2015, 128 (5) : 839-52. DOI: 10.1242/jcs.161653. |
| [14] | SomanathPR, Malinin NL, Byzova TV. Cooperation between integrin alphavbeta3 and VEGFR2 in angiogenesis[J]. Angiogenesis,2009, 12 (2) : 177-85. DOI: 10.1007/s10456-009-9141-9. |
| [15] | Paolillo M, Russo MA, Serra M, et al. Small molecule integrin antagonists in cancer therapy[J]. Mini Rev Med Chem,2009, 9 (12) : 1439-46. DOI: 10.2174/138955709789957404. |
 2015, Vol. 35
2015, Vol. 35

