变应原刺激吸入气道可诱发支气管哮喘(简称哮喘)的急性发作,气道痉挛,管腔狭窄,管内压力随之升高。从病理上来说,气道重塑是哮喘的重要特征,气道结构受到慢性炎症反复刺激亦可产生气道的重塑[1-2],进而使气道内压力进一步慢性持续性升高。近年来多种研究发现,气道内高压可作为机械刺激作用于支气管周围组织,进一步产生正压力及牵张力激活细胞膜上的机械敏感性离子通道(MSC)[3],此类通道是种可被声音、触觉、重力、振动等外源性刺激所激活的受体。有研究证明[4],一些哺乳动物的MSC通道由瞬时感受器电位(transient receptor potential,TRP)基因编码。此类TRP离子通道之亚型瞬时受体电位C1通道(TRPC1)是感受机械刺激的重要通道,激活开放可导致胞外Ca2+内流,在肺泡巨噬细胞、气道平滑肌细胞等均有表达[1, 5],但目前尚不清楚在呼吸系统表达的确切意义,且集中于基础研究。因此,本次实验在动物个体上,筛选出了TRP家族中可感知机械应力介导气道重塑的TRPC1通道,客观呈现了其在支气管肺组织中的分布部位、表达含量及其与气道重塑程度的关联度,同时证实了布地奈德与TRPC1表达可能有相关性。因TRPC1尚无有效的特异性阻断剂,验证TRPC1与气道重塑之间的关系显然成为影响学术界的一大障碍。国外Sun 等[5]通过喷洒siRNA溶液至气管,成功实现了TRPC1基因沉默。故本实验通过塑造气道内高压的氛围,采用siRNA靶基因沉默技术[5],观察豚鼠体内中TRPC1 分布及表达情况,探究偶联气道内压力与气道重塑演变间的关键元件,以及布地奈德如何干预TRPC1的表达及其后续的效应。
1 材料与方法 1.1 主要材料与试剂50只6~8周龄、体质量150±20 g、普通级健康雄性豚鼠(购买于重庆医科大学实验动物中心,动物许可证号:SCXK(渝)2007-0001);有关动物操作及实验流程均符合实验动物护理及使用指南中国际公认的标准(国家研究委员会公布,1996版)。
压缩空气式雾化器(型号:403C型,江苏鱼跃医疗设备公司);鸡卵清蛋白(OVA,美国Sigma公司,Ⅲ级);氢氧化铝干粉(成都科龙化工试剂厂);布地奈德溶液1 mg/支(澳大利亚阿斯利康公司);80-2离心沉淀器(上海手术器械厂);TRPC1 siRNA、荧光素酶siRNA(均购自广州锐博公司);减血清培养基Opti-MEM(上海信帆生物科技有限公司);Penn century 动物给药系统(IA-1B-GP上海华歌生物科技有限公司);鼠IL-5、IL-13ELISA试剂盒(美国Repidbio公司);兔抗TRPC1多克隆抗体(美国Abcam公司);兔SP试剂盒(SP9001);兔抗GAPDH 单克隆抗体、山羊抗兔IgG抗体(均购自碧云天生物技术研究所);PrimeScript RT reagent Kit试剂盒SYBR Premix EX TaqTM、DL2000 marker、TriZol试剂盒(均购于日本TaKaRa Biotechnology)。
1.2 方法 1.2.1 豚鼠哮喘模型的制备及处理 1.2.1.1 豚鼠模型分组及构建将豚鼠随机分为5组,每组10只,按随机数字表法分为:空白对照组(A组)、卵蛋白刺激组(B组)、卵蛋白刺激+TRPC1 siRNA干扰组(C组)、卵蛋白刺激+荧光素酶siRNA干预组(D组)、卵蛋白刺激+布地奈德干扰组(E组)。建模及给药方法同[8]。其中C组首先予以戊巴比妥(60 mg/kg)麻醉,固定动物,penn century动物给药系统气道内注TRPC1 siRNA溶液[5](每周1次),2 h后予以雾化OVA溶液。D组气道注射荧光素酶siRNA溶液,方法同C组。E组OVA雾化前吸入布地奈德溶液0.5 mg/kg,持续15 min。各组豚鼠处理过程中均无死亡脱失。第8周末次雾化后戊巴比妥麻醉处死豚鼠。
1.2.1.2 siRNA 的制备及处理[5, 7]查询豚鼠TRPC1[6](基因库序列编号AY572429.1),通过使用小干扰RNA(siRNA)模板设计公司制定mRNA靶向序列。TRPC1mRNA编码序列:正义链5'-AAAAGAGCAGAAAGACTGTGTAGGTATCT-3',反义链5'-AAGCAAGTGCCAATGAACGAA-3'。将60 pmol TRPC1 siRNA 及60pmol 荧光素酶siRNA分别同5 μL脂质体溶于100 μL减血清培养基(Opti-MEM)。给药前麻醉豚鼠固定于操作板,压舌板打开下颚,钝钳拉出舌体,最大限度暴露口咽部。装有试剂的penn century(IA-1B-GP)尖端通过喉部插入喷射入气管。拔出喷雾器,竖起操作板使药物浸润肺部。每周1次直至处死动物。其中,第1次注射72 h 后取肺组织行Real-time PCR 法测定TRPC1mRNA表达量进一步验证转染是否成功。
1.2.2 气道慢性炎症指标的收集 1.2.2.1 BALF的收集及Eos计数方法参照文献[8]。
1.2.2.2 BALF中IL-5、IL-13测定ELISA法待测IL-5、IL-13表达水平,按参考文献[9]进行。
1.2.3 气道重塑相关指标的采集肺组织病理标本观察及指标检测:右主支气管肺组织经4%多聚甲醛固定后梯度酒精脱水、包埋、切片染色。测定基底膜胶原沉积面积/单位基底膜长度、平滑肌厚度/单位基底膜长度、支气管壁厚度/单位基底膜长度、支气管周围炎症细胞浸润评分[8]。
1.2.4 TRPC1表达测定 1.2.4.1 Real-timePCR法检测TRPC1 mRNA表达水平左主支气管肺组织中总RNA的浓度、纯度鉴定按参考文献[9] 方法进行。TRPC1 上游引物序列为5'-GCCAGTTTTGTCACTTTGTTATTT-3',下游引物序列为5'-CCCATTGTGTTTTTCTTATCCTCA-3';GAPDH 上游引物序列为5'-CGCTGAGTACGTCGTGGAGTC-3',下游引物序列为5'-GCTGATGATCTTGAGGCTGTTGTC-3'。
1.2.4.2 免疫组化法检测TRPC1蛋白表达取多聚甲醛固定的右肺组织,参照SP Kit试剂盒说明书进行免疫组化(兔抗TRPC1 多克隆抗体为1∶25 稀释)。用Imagepro-plus 6.0软件进行图像分析[9]。
1.2.5 统计学处理应用SPSS 12.0软件包对结果进行统计学分析,根据方差齐性与否分别采用参数检验和非参数检验,即齐性资料用单因素方差分析(ANOVA),数据均以均数±标准差表示,样本均数间比较采用t检验,非齐性资料采用秩和检验。以P<0.05为差异有统计学意义。
2 结果 2.1 动物一般情况A组豚鼠无明显异常反应。B组、D组豚鼠激发后均出现易激怒,呼吸急促,打喷嚏,腹部痉挛,大小便失禁等症状。C组、E组亦出现类似反应,但程度较轻。
2.2 气道慢性炎症程度的比较 2.2.1 BALF中Eos计数百分比图 1结果所示:B组Eos占总细胞数的百分比明显高于A组;C组、E组较B组显著下调,P<0.05,比较均有统计学意义,。D组较B组差异无统计学意义(P>0.05)。
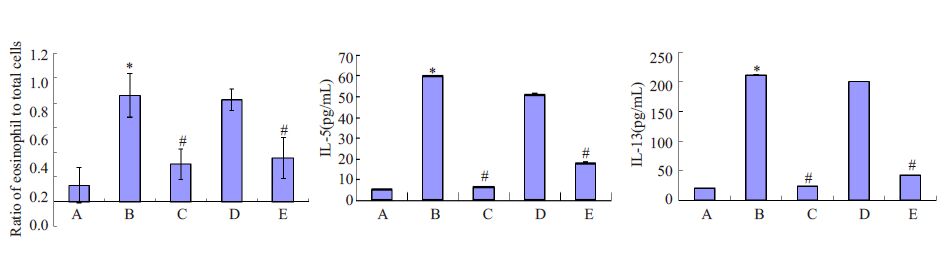
|
图 1 各组气道慢性炎症指标的表达情况及对比 Figure 1 Eosinophil percentage and contents of IL-5 and IL-13 in the bronchoalveolar lavage from the guinea pigs in different groups |
B组炎症因子较A组显著高水平表达,C组及E组较B组明显的下调,差异有统计学意义(P<0.05,图 1)。
2.3 气道结果病理性改变如图 2,3所显示病理形态改变:A组支气管粘膜上皮均完整,气道壁、气管周围结构形态正常,气管周围平滑肌增生、基底膜胶原沉积均不明显,周围无明显炎细胞浸润;与A组比较,B组可见管腔内大量粘液栓形成,气管、肺间质中有明显的炎细胞浸润,气管周围显著平滑肌增生/肥大,基底膜周围有大量胶原沉积(P 均<0.05);C组上述变化不明显,E组次之。采用炎症细胞浸润评分、支气管壁厚度比、平滑肌厚度比比较,B组肺部病理改变较A组显著(P<0.05);与B组相比,C组变化明显(P<0.05)。D组较B 组变化无统计学意义(P>0.05)。
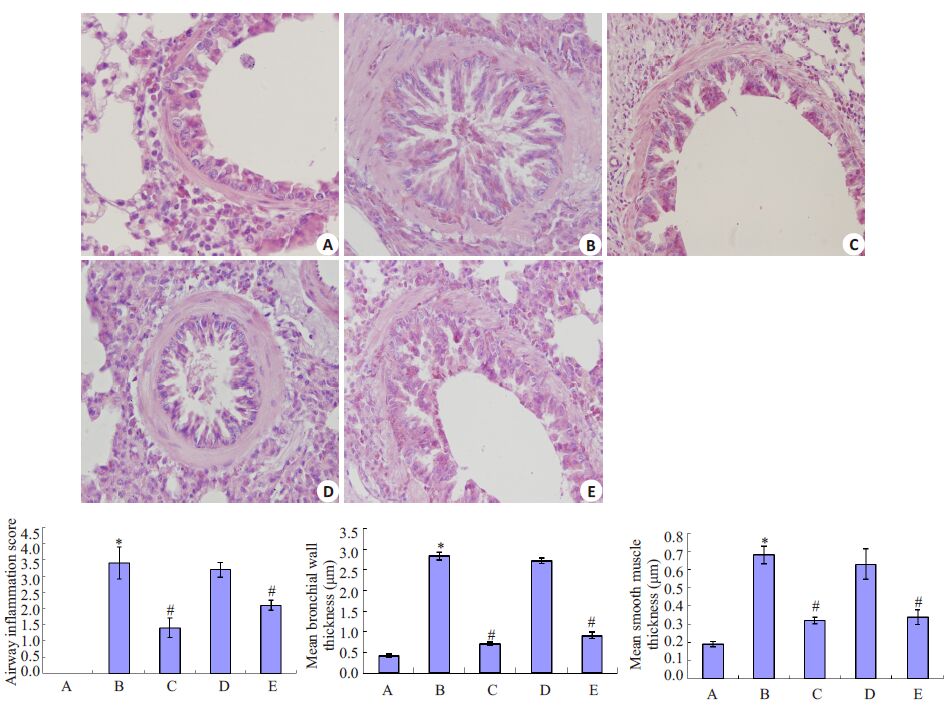
|
图 2 豚鼠支气管肺HE染色及炎症评分、支气管壁厚度、平滑肌增殖程度的比较 Figure 2 HE staining of the bronchial tissues and analysis of airway inflammation, mean epithelial thickness and smooth muscle hypertrophy in the guniea pigs (Original magnification: ×400, n=10). A: Blank control group; B: Ovalbumin group; C: Ovalbumin+ TRPC1 siRNA group; D: Ovalbumin+luciferase siRNA group; E: Ovalbumin+budesonide group. *P<0.05 vs group A; #P<0.05 vsgroup B. |
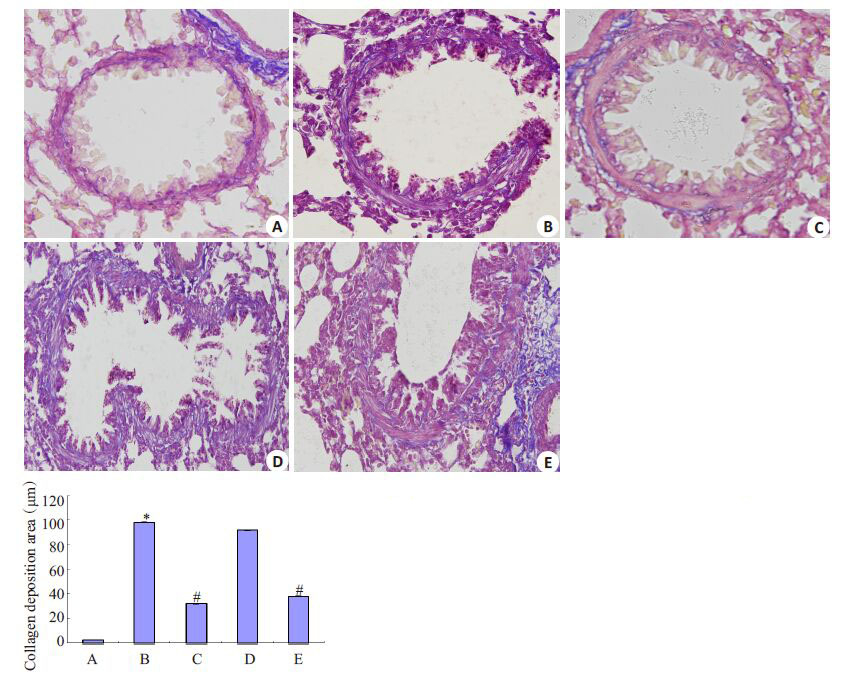
|
图 3 各组豚鼠支气管肺组织Maasion染色及基底膜胶原沉积评估 Figure 3 Massion staining of the bronchial tissues and evaluation of collagen deposition in the basement membrane (Original magnification: × 400, n=10). A: Blank control group; B: Ovalbumin group; C: Ovalbumin + TRPC1 siRNA group; D: Ovalbumin + luciferase siRNA group; E: Ovalbumin+budesonide group. *P<0.05 vs group A; #P<0.05 vs group B. |
TRPC1 蛋白在A、B组支气管肺组织中均表达,位于支气管上皮粘膜层,主要分布于支气管粘膜上皮基底细胞、柱状细胞胞膜及胞核。少许分布于气管周围平滑肌、肺泡上皮细胞层(见黑箭头标记)。且B组较A组显著高表达(P<0.05)。C、E组(IOD/area值)较B组减少(P<0.05)。D组较B组变化不大(P>0.05)。由此说明TRPC1蛋白表达在哮喘个体显著高表达(图 4,表 1)。
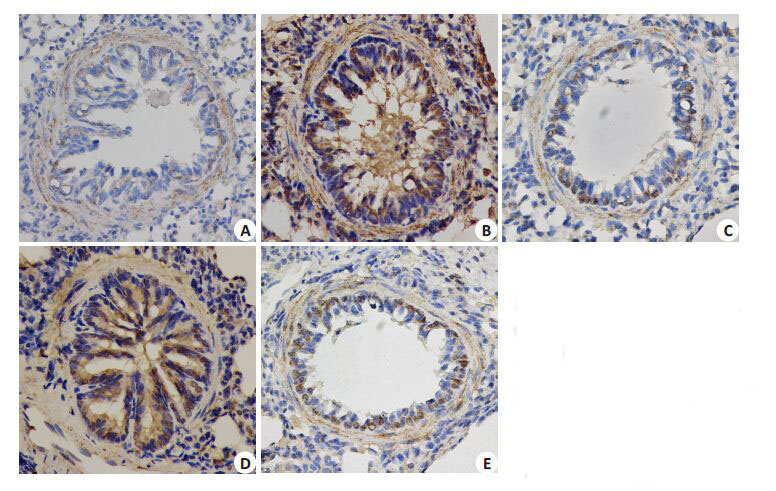
|
图 4 支气管肺组织中TRPC1 蛋
白的分布情况
Figure 4 Distribution of TRPC1
protein in the bronchial tissue
(Original magnification: × 400). A:
Blank control group; B |
| 表 1 各组支气管肺组织中TRPC1的表达水平的差异 Table 1 Comparison of the expression levels of TRPC1 in the bronchial lung tissue between the groups (Mean±SD) |
TRPC1及GAPDH基因的PCR产物熔解曲线显示为单特异峰,说明没有引物二聚体及非特异性扩增产物。结果显示:72 h后测定肺组织发现,C组TRPC1/GAPDHmRNA 含量较B 组减少,D 组则下调不明显,说明siRNA成功转染支气管肺组织。8周后提取肺组织发现,B组TRPC1/GAPDH mRNA相对表达量较A组显著高表达(P<0.05)。C、E组TRPC1/GAPDH mRNA相对表达量(P<0.05),说明TRPC1 siRNA 有效阻断了TRPC1 mRNA的表达,布地奈德可下调TRPC1 mRNA的表达(表 1)。
3 讨论众所周知,哮喘是一类气道慢性炎性疾病,反复接触变应原刺激后可诱发急性发作,管强内压力随之升高,加之后续炎性因子浸润、黏液分泌、各种因子(如基质金属蛋白酶MMPs,转化生长因子TGF-β等)的分泌等一系列事件则使疾病最终呈现出更复杂的气道重塑,愈发导致管腔压力持续性的升高。近年来发现,哺乳动物胞膜上普遍存在的MSC[3],被激活后可调控胶原蛋白、MMPs及各种生长因子、MUC5AC等分泌[10-12]。而隶属于MSC 的TRPC1是一类公认的可感知机械应力的钙离子通道[4],除胞膜受到压力牵张外,胞质中钙离子通道的消耗、受体的激活均可直接或间接激活此通道[5],转导胞外Ca2+入胞,其后续产生的效应因子与气道重塑的形成具有密切相关性[1, 10, 13-14]。本实验显示,免疫组化法示卵蛋白刺激组TRPC1蛋白表达量即IOD/area值显著高于空白对照组,呈现高表达状态,主要位于支气管上皮粘膜层的基底细胞及柱状上皮细胞的胞膜及胞核内;Real-time PCR显示支气管粘膜内TRPC1 mRNA相对高表达,此部分显著提示,TRPC1与气道重塑有着密切相关性。因TRPC1系压力敏感通道的本质,且高表达于腔内侧,说明腔内机械应力刺激可持续反复的作用于气道上皮细胞层,进而激活胞膜及胞内TRPC1通道,可诱导Ca2+入胞。
哮喘激发后,痰栓增多、气管壁增厚、管周围显著平滑肌增生/肥大、基底膜区有大量胶原沉积。TRPC1基因沉默后,相应的mRNA及蛋白表达减少,气道病理结构改变同时受到削弱,荧光素酶siRNA对此抑制作用则不明显,充分证明了TRPC1的高水平表达密切关联着肺组织气道再塑的演变。故推断衔接TRPC1与气道重塑环节的“靶位点”如下[10-14]:(1)机械刺激持续牵张胞膜TRPC1 通道,胞外Ca2+入胞,渗透入核膜,结合钙调蛋白、激活肌球蛋白轻链激酶及肌动球蛋白,引起支气管收缩诱发哮喘发作;(2)胞质及核内Ca2+可加速有丝分裂静止期→DNA合成期的过渡状态,推动有丝分裂,导致平滑肌增殖/肥大、成纤维细胞增殖迁移等;(3)胞内Ca2+ 浓度升高,通过豆蔻酰化富丙氨酸C 激酶底物(MARCKS)磷酸化途径导致MUC颗粒释放出胞,诱导粘液高分泌,痰量增多;Ca2+依赖性PKC上调MMPs,胶原沉积;在基因水平调控TGF-β1相应的受体及配体的表达。最终导致气管周围平滑肌增殖迁移及杯状细胞增生、胶原沉积等病理改变,演变为气道重构。
目前认为,气道受到慢性炎症反复刺激导致气道不可逆结构改变[1-2]。TRPC1可能为致炎症因子,并在Th2细胞活化及反应中起着关键性作用[16-17]。我们也发现,哮喘豚鼠呈现出BALF中Eos显著高表达,IL-5、IL-13亦显著上调,且支气管周围、肺间质中有明显炎细胞浸润,施加TRPC1 siRNA后上述病理反应较前有削弱,故明确证实了这一点。布地奈德是卤化糖皮质激素之一,其防止气道重塑上也有一定作用但未完全阐述。布地奈德可下调高水平表达的TRPC1,故推断其阻碍气道重塑的进展可能与TRPC1有关。
由此总结,作为机械应力敏感通道的TRPC1在哮喘个体显著高表达,并与气道重塑程度、慢性气道炎症密切联系,很可能与其诱导的胞内高浓度Ca2+有关,但仍需进一步探索相关的下游信号机制;布地奈德可能在一定程度上通过下调TRPC1干预气道重塑演变。故本实验以TRPC1通道为突破点,新颖的推敲气道内高压环境与气道重塑存在的信号链锁基础及其中关键信号分子,有望成为预防、控制气道重塑的新型靶蛋白。
| [1] | Sweeney M, Mcdaniel SS, Platoshyn O, et al. Role of capacitative Ca2 + entry in bronchial contraction and remodeling[J]. J Appl Physiol (1985),2002, 92 (4) : 1594-602. DOI: 10.1152/japplphysiol.00722.2001. |
| [2] | Ong HL, Brereton HM, Harland ML, et al. Evidence for the expression of transient receptor potential proteins in Guinea pig airway smooth muscle cells[J]. Respirology,2003, 8 (1) : 23-32. DOI: 10.1046/j.1440-1843.2003.00424.x. |
| [3] | Bowman CL, Gottlieb PA, Suchyna TM, et al. Mechanosensitive ion channels and the peptide inhibitor GsMTx-4: history, properties, mechanisms and pharmacology[J]. Toxicon,2007, 49 (2) : 249-70. DOI: 10.1016/j.toxicon.2006.09.030. |
| [4] | Maroto R, Raso A, Wood TG, et al. TRPC1 forms the stretch-activated cation channel in vertebrate cells[J]. Nat Cell Biol,2005, 7 (2) : 179-85. DOI: 10.1038/ncb1218. |
| [5] | Sun CK, Zhen YY, Lu HI, et al. Reducing TRPC1 expression through Liposome-Mediated siRNA delivery markedly attenuates Hypoxia-Induced pulmonary arterial hypertension in a murine model[J]. Stem Cells Int,2014 : 316214. |
| [6] | Morales S, Diez A, Puyet A, et al. Calcium controls smooth muscle TRPC gene transcription via the CaMK/calcineurin-dependent pathways[J]. Am J Physiol Cell Physiol,2007, 292 (1) : C553-63. |
| [7] | Kim TH, Kim SH, Seo JY, et al. Blockade of the Wnt/β-catenin pathway attenuates bleomycin-induced pulmonary fibrosis[J]. Tohoku J Exp Med,2011, 223 (1) : 45-54. DOI: 10.1620/tjem.223.45. |
| [8] | 李娟, 沈奕, 钱艳, 等. 转化生长因子β-1Ⅰ型受体拮抗剂对支气管 哮喘小鼠气道炎症及气道重塑的影响[J]. 中华哮喘杂志: 电子版,2013, 7 (3) : 25-31. |
| [9] | Li MC, Yang G, Zhou XD, et al. The pathophysiological mechanisms underlying mucus hypersecretion induced by cold temperatures in cigarette smoke-exposed rats[J]. Int J Mol Med,2014, 33 (1) : 83-90. |
| [10] | Furutani Y, Murakami M, Funaba M. Differential responses to oxidative stress and Calcium influx on expression of the transforming growth factor-beta family in myoblasts and myotubes[J]. Cell Biochem Funct,2009, 27 (8) : 578-82. DOI: 10.1002/cbf.v27:8. |
| [11] | Zong W, Jallah ZC, Stein SE, et al. Repetitive mechanical stretch increases extracellular collagenase activity in vaginal fibroblasts[J]. Female Pelvic Med Reconstr Surg,2010, 16 (5) : 257-62. DOI: 10.1097/SPV.0b013e3181ed30d2. |
| [12] | Hawwa RL, Hokenson MA, Wang Y, et al. Differential expression of MMP-2 and -9 and their inhibitors in fetal lung cells exposed to mechanical stretch: regulation by IL-10[J]. Lung,2011, 189 (4) : 341-9. DOI: 10.1007/s00408-011-9310-7. |
| [13] | Kohn EC, Jacobs W, Kim YS, et al. Calcium influx modulates expression of matrix metalloproteinase-2 (72-kDa type IV collagenase, gelatinase A)[J]. J Biol Chem,1994, 269 (34) : 21505-11. |
| [14] | 钟甜, 皮尔曼尤列, 科罗索夫维克多, 等. 张力敏感性阳离子通道在 机械牵张引起气道黏液高分泌中的作用[J]. 中华医学杂志,2010, 90 (33) : 2328-33. |
| [15] | Zhong T, Perelman JM, Kolosov VP, et al. The effects of stretch sensitive positive ion Channel on the high externalization of MUC5AC in airway epithelial cells by mechanical stretching[J]. Zhonghua Yi Xue Za Zhi,2010, 90 (33) : 2328-33. |
| [16] | Yildirim E, Carey MA, Card JW, et al. Severely blunted allergen-induced pulmonary Th2 cell response and lung hyperresponsiveness in type 1 transient receptor potential channel-deficient mice[J]. Am J Physiol Lung Cell Mol Physiol,2012, 303 (6) : L539-49. DOI: 10.1152/ajplung.00389.2011. |
| [17] | 扶招弟, 周丽芬, 黄建荣, 等. 瞬时感受器电位通道1在臭氧致小鼠肺 组织炎症中的表达[J]. 南方医科大学学报,2015, 35 (2) : 284-7. |
 2015, Vol. 35
2015, Vol. 35

