瞬时感受器电位离子通道香草素受体亚家族4(TPRV4)是一种非选择通透性阳离子通道,其广泛分布在神经系统、肺、肾、睾丸、皮肤等多种组织[1]。TRPV4能被低渗、机械变形、高温、炎症介质(花生四烯酸)、细胞内外钙离子浓度变化等多种理化刺激激活,从而参与神经细胞信号传导、细胞生长与调控等多种生物学功能[2]。最新研究表明TRPV4在细胞连接的形成与修复过程中亦发挥着重要作用。皮肤免疫性大疱病是一组以皮肤大疱为基本损害,继而出现大疱、渗出、糜烂,皮肤屏障功能受到严重破坏的疾病,其发病机制则主要由于自身免疫反应损害表皮细胞间或表皮与真皮间的粘连功能,导致细胞分离松解所致[3]。然而关于皮肤免疫性大疱病与TRPV4蛋白的关系研究国内外尚未见报道。本实验首次通过检测分析TRPV4在皮肤免疫性大疱病皮损组织中的表达情况,从而探讨TRPV4在此类疾病发生、发展中的作用。
1 资料与方法 1.1 材料收集西安交通大学第二附属医院皮肤科2009~2013年间临床及病理确诊的手术及活检标本,其中寻常型天疱疮21例,男10例,女11例;年龄38~78岁,平均年龄63岁;大疱性类天疱疮22例,男10例,女12例;年龄35~81岁,平均年龄62.3岁;大疱性表皮松解症19例,男10例,女9例;年龄34~79岁,平均年龄65.4岁;疱疹样皮炎18例,男9例,女9例;年龄35~73岁,平均年龄61岁。正常人组织15例,均来自于外科手术切下的胸腹部皮肤,其中男8例,女7例,年龄32~78岁,平均63.5岁。上述各组病例在性别及年龄分布上均无明显差异。兔抗人TRPV4多克隆抗体购自Abcam公司,工作浓度1∶150;免疫组化检测试剂盒购自Zymed 公司,工作浓度1∶50。
1.2 方法 1.2.1 免疫组织化学SP(streptavidin-perosidase)法染色组织蜡块切片(约5 μm),常规脱蜡、水化;高温高压抗原修复;3% H2O2室温孵育10 min灭活内源性过氧化物酶;10%血清,室温封闭20 min;加入一抗,4 ℃过夜;生物素化二抗,室温孵育20 min;DAB显色,阳性显色为棕黄色;苏木素复染,常规脱水、透明及封片。
1.2.2 结果判定以角质形成细胞染色呈棕黄色为阳性标志。在400倍镜视野下,每张切片随机挑选5个视野进行观察,按照阳性细胞平均数量比例分为4 级:阳性细胞数≤5%为阴性(-),5%~25%为弱阳性(+),25%~50%为阳性(+ +),>50%为强阳性(+ + +)。各个疾病的TRPV4 阳性率=各个疾病的(总例数-阴性例数)/总例数×100%。
1.2.3 统计学处理采用SPSS 11.0做秩和检验分析,P< 0.05为差异有统计学意义。
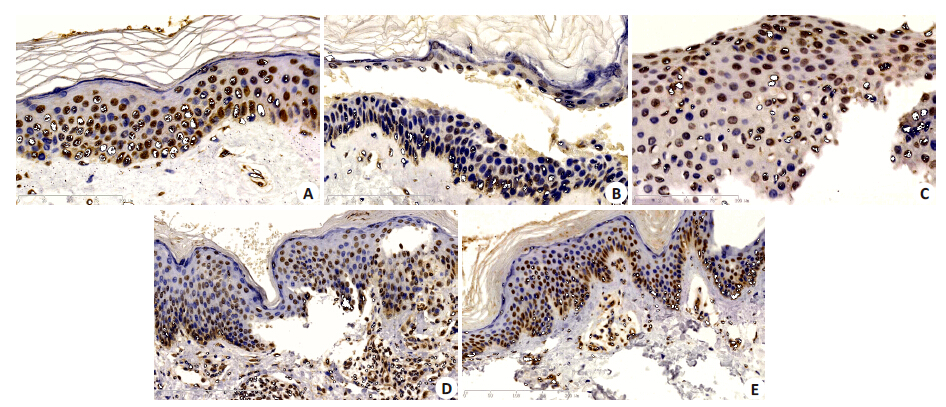
2 结果 2.1 不同皮肤组织TRPV4蛋白的表达正常皮肤组织TRPV4 阳性率为93.33%,PV、BP、DH、EBA 皮损组织中TRPV4 阳性率为61.90%、81.81% 、72.22% 、68.42% ,均低于正常对照组(Mann-Whitney检验Z值分别为-3.902、-2.526、-2.731、-3.512,P值分别为0.000、0.012、0.006、0.000<0.05,差异有统计学意义)(表 1,图 1)
| 表 1 TRPV4蛋白在正常皮肤、PV、BP、DH、EBA皮损组织中的表达 Table 1 Positive expression of TRPV4 protein in the lesions of normal skin, PV, BP, DH and EBA |
|
图 1 TRPV4蛋白在不同表皮组织中的表达 Figure 1 Expression of TRPV4 protein in different lesions (Original magnification: ×400). A: Normal skin; B: PV; C: BP; D: DH; E: EBA. |
各类型免疫性大疱病中TRPV4蛋白表达阳性率最低为PV(61.90%),最高为BP(81.81%),各组之间阳性表达率高低为PV<EBA<DH<BP(Kruskal-Wallis 检验Hc=20.11,P=0.000,差异有统计学意义)(表 1,图 1A~1D)。
3 讨论TRPV4最早是作为能被低渗透压激活的渗透压感受器被发现的,早期研究多集中于其在调节渗透压敏感性和机械敏感性中的作用[4]。然而作为一种非选择性阳离子通道,其对钙离子有着中等通透性,而在收缩、传导、分泌、分裂等复杂生命活动过程中均需要有钙离子的参与和调节,所以TRPV4的多重生物学功能逐步被发掘和证实[5-9]。近来,TRPV4在皮肤屏障中的重要角色便备受关注[10-14],特别是Sokabe 等[11]的研究表明TRPV4一方面通过与β-链蛋白、E-钙粘素相互作用形成复合体直接参与粘连连接的形成,另一方面通过调节钙离子流动强化细胞间连接的稳定性,从而进一步阐释了TRPV4在细胞连接中的分子机制。TRPV4的缺失导致皮肤组织的屏障功能明显降低,经皮水分丢失(TEWL)明显增加,并且干扰肌动蛋白纤维的形成,对细胞粘连连接及所有细胞连接的动态变化均有着重要的影响。
本实验发现TRPV4在PV、BP、DH及EBA皮损中的表达量均低于正常皮肤组织,表明TRPV4的缺失可能与皮肤免疫性大疱病的发生、发展有着密切的联系。细胞间连接的构成成分是皮肤免疫性大疱病的主要抗原靶点,并且各类型皮肤免疫性大疱病的特定抗原成分也逐渐被明确。其中寻常性天疱疮抗原(PVA)主要位于桥粒、大疱性类天疱疮抗原(包括BPAg1和BPAg2)位于基底膜处的半桥粒,获得性大疱性表皮松解症抗原为基底膜带致密下层的Ⅶ型胶原,疱疹样皮炎的损害靶点为真皮乳头的连接结构[3]。本研究显示,TRPV4 在PV皮损中的表达量下降最为明显,虽然PVA主要位于桥粒而不是TRPV4直接参与维持的粘连连接,但新的研究表明粘连连接在PV的发病过程中同样发挥着重要的作用。一方面是因为粘连连接本身也可能是PV的潜在致病靶点,Bédane等[15]发现PVA不仅仅局限于桥粒,还可能分布在粘连连接中。另一方面是由于桥粒与粘连连接在结构和功能上有着密切的联系:桥粒的完整性将影响粘连连接的分子结构及功能状态,Sumigray等[16]发现桥粒的缺失虽然不能导致粘连连接功能的明显丧失,但可能影响其成熟或形态;缺乏粘连连接的介导,桥粒斑蛋白将无法在细胞连接间累积,直接干预桥粒的形成。所以TRPV4表达量的降低对细胞粘连连接的影响亦势必干扰着桥粒的正常构成,但其是由于作为潜在靶点直接导致细胞连接的破坏,还是由于继发损害后影响表皮层细胞钙离子平衡间接影响表皮层细胞连接的稳定状态,仍然需要更多的实验研究深入分析。DH、BP、EBA的损害靶点主要位于皮肤基底膜带或真皮,水疱的形成也主要发生在表皮下,而在这3类皮肤免疫性大疱病皮损中TRPV4表达的降低并非仅仅集中在基底膜带区域,而是同PV一样发生在除角质层以外的表皮细胞全层。这可能说明在DH、BP、EBA的疾病过程中TRPV4并非作为直接的损害靶点,但TRPV4的降低与水疱的形成总是伴随出现,这也许会影响整个表皮细胞间的连接状态或干扰细胞连接的修复。另外,各类免疫性大疱病皮损中TRPV4 的表达量也存在差异(PV<EBA<DH<BP),这些差异是否与各类疾病的发展及预后相关仍然需要进一步研究。
TRPV4在皮肤屏障方面的研究仍然缺少丰富的实验和临床资料,皮肤免疫性大疱病的研究亦在不断深入。本实验首次探索了二者之间的联系,观察分析了TRPV4在皮肤免疫性大疱病中的表达情况,发现其均有不同程度的降低,可能影响着皮肤连接的形成或修复,参与皮肤免疫性大疱病的发生、发展,或许会成为此类疾病新的研究靶点。
| [1] | Garcia-Elias A, Mrkonjić S, Jung C, et al. The TRPV4 channel[J]. Handb Exp Pharmacol,2014, 222 : 293-319. DOI: 10.1007/978-3-642-54215-2. |
| [2] | Vergnolle N. TRPV4: new therapeutic target for inflammatory bowel diseases[J]. Biochem Pharmacol,2014, 89 (2) : 157-61. DOI: 10.1016/j.bcp.2014.01.005. |
| [3] | Baum S, Sakka N, Artsi O, et al. Diagnosis and classification of autoimmune blistering diseases[J]. Autoimmun Rev,2014, 13 (4/5) : 482-9. |
| [4] | Nilius B, Voets T. The puzzle of TRPV4 channelopathies[J]. EMBO Rep,2013, 14 (2) : 152-63. DOI: 10.1038/embor.2012.219. |
| [5] | Sokabe T, Tominaga M. The TRPV4 cation Channel: A molecule linking skin temperature and barrier function[J]. Commun Integr Biol,2010, 3 (6) : 619-21. DOI: 10.4161/cib.3.6.13461. |
| [6] | Rahaman SO, Grove LM, Paruchuri S, et al. TRPV4 mediates myofibroblast differentiation and pulmonary fibrosis in mice[J]. J Clin Invest,2014, 124 (12) : 5225-38. DOI: 10.1172/JCI75331. |
| [7] | Zhan L, Yang Y, Ma TT, et al. Transient receptor potential vanilloid 4 inhibits rat HSC-T6 apoptosis through induction of autophagy[J]. Mol Cell Biochem,2015, 402 (1/2) : 9-22. |
| [8] | Pochynyuk O, Zaika O. O'Neil RG,mamenko M[J]. Pflugers Arch,2013, 465 (2) : 177-86. DOI: 10.1007/s00424-012-1190-z. |
| [9] | Thorneloe KS, Cheung M, Bao W, et al. An orally active TRPV4 Channel blocker prevents and resolves pulmonary edema induced by heart failure[J]. Sci Transl Med,2012, 4 (159) : 159ra148. |
| [10] | Kida N, Sokabe T, Kashio M, et al. Importance of transient receptor potential vanilloid 4 (TRPV4) in epidermal barrier function in human skin keratinocytes[J]. Pflügers Archiv-European Journal of Physiology,2012, 463 (5) : 715-25. DOI: 10.1007/s00424-012-1081-3. |
| [11] | Sokabe T, Fukumi-Tominaga T, Yonemura S, et al. The TRPV4 Channel contributes to intercellular junction formation in keratinocytes[J]. J Biol Chem,2010, 285 (24) : 18749-58. |
| [12] | Fusi C, Materazzi S, Minocci D, et al. Transient receptor potential vanilloid 4 (TRPV4) is downregulated in keratinocytes in human non-melanoma skin cancer[J]. J Invest Dermatol,2014, 134 (9) : 2408-17. DOI: 10.1038/jid.2014.145. |
| [13] | Liedtke W, Zhang JY, Hall RP, et al. Keratinocyte growth regulation TRP-ed up over downregulated TRPV4[J]. J Invest Dermatol,2014, 134 (9) : 2310-2. DOI: 10.1038/jid.2014.250. |
| [14] | Moore C, Cevikbas F, Pasolli HA, et al. UVB radiation generates sunburn pain and affects skin by activating epidermal TRPV4 ion channels and triggering endothelin-1 signaling[J]. Proc Natl Acad Sci USA,2013, 110 (34) : E3225-34. |
| [15] | Bédane C, Prost C, Thomine E, et al. Binding of autoantibodies is not restricted to desmosomes in pemphigus vulgaris: comparison of 14 cases of pemphigus vulgaris and 10 cases of pemphigus foliaceus studied by western immunoblot and immunoelectron microscopy[J]. Arch Dermatol Res,1996, 288 (7) : 343-52. DOI: 10.1007/BF02507101. |
| [16] | Sumigray K, Zhou K, Lechler T. Cell-cell adhesions and cell contractility are upregulated upon desmosome disruption[J]. PLoS One,2014, 9 (7) : e101824. DOI: 10.1371/journal.pone.0101824. |
 2015, Vol. 35
2015, Vol. 35

