2. 湖南省娄底市中心医院神经外科, 湖南 娄底 417000
2. Department of Neurosurgery,the Central Hospital of Loudi City,Hunan Province,Loudi 417000,China
脑血管疾病(cerebrovascular disease,CVD)是神经系统常见病及多发病,严重威胁人民的身体健康[1],缺血性脑血管病(ischemic cerebrovascular disease,ICVD)占CVD的70%左右。脑缺血梗死后血液再通会出现脑缺血-再灌注损伤(cerebral ischemia-reperfusioninjury,CIRI),其机制十分复杂。Apelin是一种小分子内源性神经肽,是血管紧张素受体样蛋白J受体的天然配体,不仅参与了神经系统的生理功能调节,也与其发生、发展密切相关,具有神经保护作用[2-4]。Apelin可被肽酶分解成多种相对分子量不同的成熟活性肽,以Apelin-13 的生物活性最强。本研究拟观察Apelin-13对大鼠局灶性脑缺血-再灌注损伤的作用,探讨其作用机制,为CIRI的防治提供新的方法和策略。
1 资料与方法 1.1 材料Apelin-13为美国Sigma公司产品,MDA测试盒和SOD 测试盒购自武汉博士德生物工程公司;兔抗ERK1/2多克隆抗体和兔抗p-ERK1/2多克隆抗体为美国Cell Signaling Biotechnology 公司产品。Apelin-13溶解于0.9%的生理盐水中,配置成不同浓度的溶液(单位μg/kg)。
1.2 实验动物与分组选取8 周龄的健康S-D 雄性大鼠100 只,体质量250~300 g(中南大学实验动物学部提供)。随机分为5 组:假手术组(只分离血管20只)、缺血再灌注模型组(20只)、Apelin-13干预组(10 μg/kg为干预A组、50 μg/kg为B组、100 μg/kg为C组,每组20只),再灌注前15 min侧脑室注射Apelin-13溶液5 μL。假手术组和模型组注射相同剂量的生理盐水。每组随机取5只大鼠,断头处死取出整个脑组织,进行2,3,5-氯化三苯基四氮唑(TTC)染色,观察梗死的体积;5只大鼠取全脑组织,称取大脑湿质量,然后108 ℃烘烤72 h后,再称干质量;5只大鼠进行TUNEL染色;余下5只大鼠在断头处死后取出全脑组织后,取缺血半暗带脑组织,用于MDA和SOD以及Western blotting检测。
1.3 侧脑室埋管与动物模型制备所有实验S-D大鼠在实验室恒温、恒湿动物房中适应环境一周,12 h昼夜交替,自由饮食,避免不良刺激。术前禁食12 h,自由饮水,腹腔注射10%水合氯醛麻醉后固定在脑立体定位仪上,矢状缝和冠状缝愈合处向后3~4 mm,中线旁开1.5 mm 处,深度为3.5 mm,钻孔埋入插管套管,骨蜡封闭固定。每次注药3 min并留针l min[5]。埋管后,参照zea-Longa线栓法[6],并略加改进制备大鼠大脑中动脉局灶性脑缺血模型。颈部正中切口,分离右侧颈总、颈内、外动脉,在动脉分叉处结扎颈外动脉,颈总动脉剪一小口,插入头端呈圆钝形的尼龙鱼线(直径0.28 mm),插入长度约18 mm,在大脑中动脉起始端堵塞动脉。将颈总动脉和尼龙鱼线一起结扎,缝合皮肤。在阻断血流2 h后,通过拔出尼龙鱼线实现再灌注72 h。假手术组只分离血管,不结扎动脉,不插入尼龙鱼线。大鼠苏醒后左侧肢体瘫痪,站立不稳,左上肢屈曲、行走时向左侧转圈的大鼠为造模成功,用于后续实验[7]。
1.4 临床症状观察、肌力检查、神经功能评分观察肢体瘫痪,站立,肢体屈曲,行走情况。采用Longa[6]的5级4分法进行神经功能评分:无明显神经功能缺损记为0分;左前肢伸展障碍记为1分;行走时向左侧旋转打圈记为2分;行走时向左侧倾倒记为3分;不能自发行走,意识丧失,昏迷记为4 分;动物死亡记为5分。评分为0分、4分和5分的大鼠均被剔除,剔除的大鼠在后续实验中得到补充[8]。
1.5 含水量、脑梗死体积计算和TUNEL染色大鼠脑缺血2 h再灌注72 h后,断头取出全脑,去掉低位脑干、嗅球和小脑,用电子称称取大脑湿质量,然后108 ℃烘烤72 h后,再称取大脑的干质量。脑组织含水量的计算公式为:(湿质量-干质量)/湿质量×100%。大鼠断头处死后完整取出脑组织,将大脑均匀切成5片冠状切片。脑片浸入2% TTC溶液,37 ℃恒温水浴中孵育15 min染色,染色后取出于4%多聚甲醛中固定24 h后,数码相机摄像,红色区域为正常脑组织,苍白色区域为梗死区,相机微距拍摄,Image pro plus 5.1图像分析软件分析并计算脑梗死体积。TUNEL染色时先行缺血再灌注后,麻醉后剪开胸腔,暴露心脏,从左心室快速灌注生理盐水100 mL,然后以4%多聚甲醛200 mL左右灌注固定,石蜡包埋,切片,片厚约为5 μm,相邻切片分别予以TUNEL 染色,中性树胶封片,观察脑组织凋亡情况。
1.6 缺血周边区脑组织的MDA、SOD、ERK1/2检测大鼠断头取出脑组织,然后取缺血周边半暗带脑组织,低温粉碎、高速离心提取脑组织匀浆上清液,按照试剂盒说明书进行操作,采用分光光度法检测脑组织匀浆上清液中丙二醛(MDA)含量和超氧化物歧化酶(SOD)的活性。提取脑组织总蛋白进行Western Blotting,采用蛋白裂解液试剂盒,按说明书进行操作,远红外荧光扫描成像系统扫描并测定目标带单位密度,β-actin做为参照,以ERK1/2、p-ERK1/2 对β-actin 的比值代表各组蛋白相对表达水平。
1.7 统计学方法采用SPSS 13.0统计学软件进行数据分析,计量资 料数据用均数±标准差来表示,多组间差异的比较采用 单因素方差分析,然后组间差异的两两比较采用LSD-T 检验,以P<0.05为差异有统计学意义。
2 结果 2.1 Apelin-13对大鼠脑缺血再灌注损伤后神经功能缺损的影响如表 1结果所示,模型组神经功能评分明显高于评分为0的假手术组,表明缺血再灌注造成了明显的神经功能缺损。Apelin-13处理后,肌力明显增强,干预B,C组神经功能评分明显低于模型组(P<0.05),干预A组与模型组差异均无统计学意义(P>0.05),提示较大剂量Apelin-13能够改善局灶性脑缺血再灌注损伤后的神经功能缺失。
| 表 1 不同组大鼠Longa神经功能评分 Table 1 Longa neurological function score in different groups |
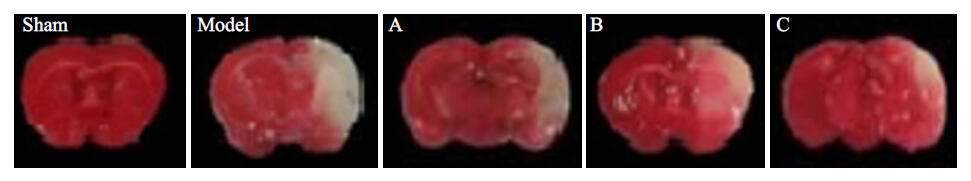
如图 1结果所示,假手术组大鼠脑组织TTC染色表现为均匀一致的红色,模型组缺血再灌注侧脑组织TTC染色出现大范围苍白色梗死区域。缺血损伤的体积中模型组为236±21 mm3,A 组187±19 mm3、B 组175±17 mm3、C组152±15 mm3,Apelin-13干预后梗死区域体积缩小(P<0.05),提示Apelin-13能够减轻局灶性脑缺血再灌注损伤后的梗死体积,从而产生神经保护作用。
|
图 1 肉眼所见不同组别大鼠的梗死脑组织 Figure 1 Infarcted brain tissue of rats in different groups under the naked eye. |
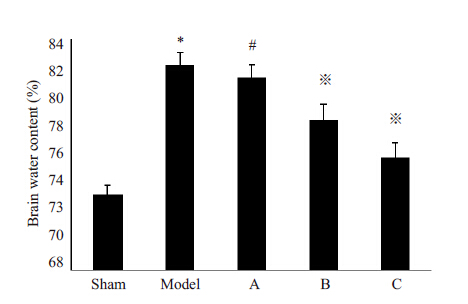
如图 2 结果所示,模型组脑组织含水量(82.34±0.83)%明显高于假手术组(73.27±0.63)%(P<0.05),提示大脑中动脉缺血再灌注后造成了明显的脑水肿。不同剂量的Apelin-13 处理后,B组含水量(78.36±1.14)%、C 组含水量(75.78±1.01)%明显低于模型组(82.23±0.83)%(P<0.05),A组含水量(81.32±0.91)%与模型组差异无统计学意义(P>0.05),提示中、大剂量Apelin-13能够减轻局灶性脑缺血再灌注损伤后脑组织水肿。
|
图 2 各组脑组织含水量 Figure 2 Brain water content of different groups (%). *P< 0.05vs Sham group; #P>0.05 vs Model group; *P<0.05 vsModel group. |
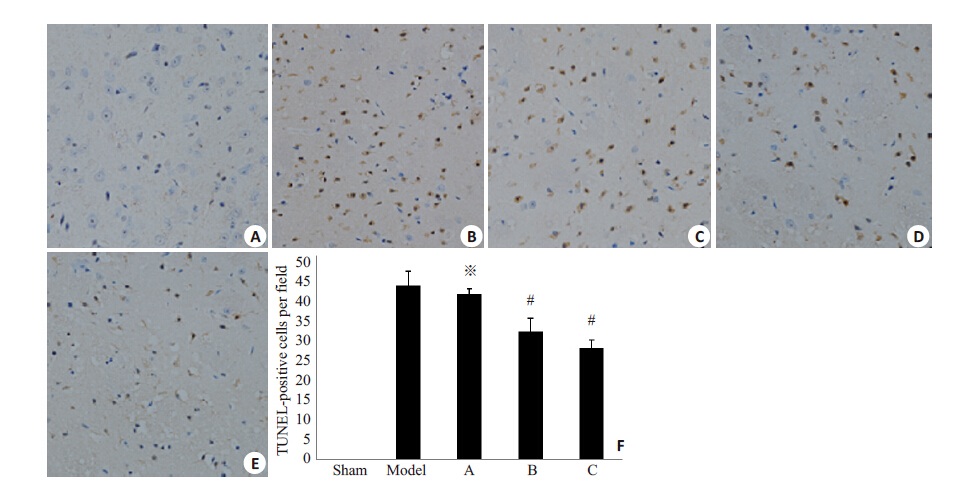
如图 3结果所示,光镜下观察,假手术组脑组织切片见细胞形态完整,未见TUNEL阳性细胞。模型组梗死周围组织明显水肿、坏死,可见深染、固缩核细胞。运用Apelin-13 干预后,C组TUNEL阳性细胞数(27.30±2.028/每高倍视野)、B组TUNEL 阳性细胞数(31.48±3.178/每高倍视野)明显低于模型组(42.67±3.458/每高倍视野)(P<0.05);A 组TUNEL 阳性细胞数(40.74±1.158/每高倍视野)与模型组差异无统计学意义(P>0.05),提示中、大剂量Apelin-13能够减轻局灶性脑缺血再灌注损伤后的细胞凋亡。
|
图 3 不同组别大鼠TUNEL阳性细胞观察 Figure 3 Observation of TUNEL-positivecells in different rats (A-E, Originalmagnification: × 200). Sham group; B:Model group; C: A group; D: B group;E: C group; F: TUNEL-positive cells perfield (*P>0.05 vs Model group, #P<0.05vsModel group). |
如表 2结果所示:与假手术组比较,模型组大鼠缺血周边区脑组织中MDA含量显著性增加,SOD活性显著性降低(均P<0.05);与模型组比较,干预B、C组大鼠缺血周边区脑组织中MDA水平均显著降低,SOD活性均显著增加,以C组更加明显(P<0.05);干预A组脑组织中MDA含量及SOD活性与模型组比较没有显著性差异(P>0.05)。
| 表 2 不同组别大鼠脑组织MDA含量和SOD活性 Table 2 MDAcontent and SOD activity in different groups (n=5) |
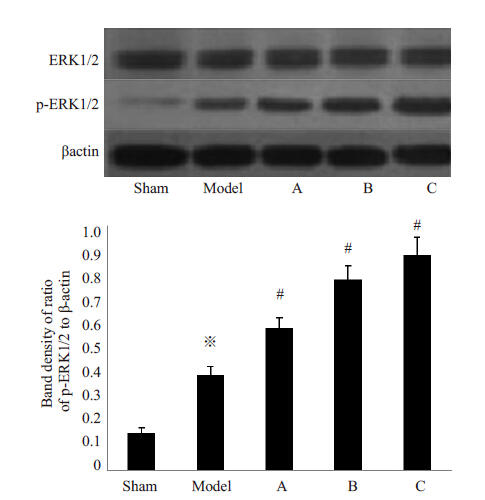
如图 4结果所示,Western blotting结果显示,各实验组均有ERK1/2蛋白表达,模型组与假手术组相比,表达无统计学差异(P>0.05),提示局灶性脑缺血再灌注损伤对脑组织中ERK1/2 蛋白总量无明显影响。Apelin-13 干预后结果显示,各干预组与假手术组ERK1/2表达差异无统计学意义(P>0.05)。另外各实验组均有p-ERK1/2表达,模型组和干预组p-ERK1/2蛋白表达高于假手术组(P<0.05),而且干预组高于模型组(P<0.05);提示局灶性脑缺血再灌注损伤后脑组织中ERK1/2蛋白磷酸化水平增强,Apelin-13干预后ERK1/2蛋白磷酸化水平增强更加明显。表明Apelin-13对局灶性脑缺血再灌注损伤后脑组织ERK1/2蛋白总量无明显影响,但能促进ERK1/2蛋白磷酸化。
|
图 4 不同组别大鼠ERK1/2和p-ERK1/2蛋白电泳情况 Figure 4 Expression of ERK1/2 and p-ERK1/2 in differentrats. *P<0.05 vs Sham group, #P<0.05 vs Model group. |
动脉粥样硬化所致的心肌梗塞、脑梗塞等缺血性组织损伤是导致病人死亡的主要原因,研究表明缺血-再灌注损伤加重了脑缺血疾病对机体的损害[9],增加了死亡率和致残率。其机理十分复杂,氧化应激、过量自由基的产生是重要原因[10-12]。再灌注神经损伤的严重程度主要取决于缺血梗死面积、持续时间以及内源性神经保护机制的启动。寻找一种新的安全有效的防治脑缺血-再灌注损伤的方法具有十分重要的意义。
Apelin是由Tatemoto等从牛的胃分泌物中分离纯化的一种小分子内源性神经肽,是血管紧张素受体样蛋白J 受体(putative receptor protein related to theangiotensin receptor ATl,APJ)的天然配体。Apelin/APJ系统在神经元的胞体和神经纤维中均有大量的表达[13-14],具有神经保护作用,能对抗兴奋性毒性损伤、氧化应激损伤,抑制神经细胞的凋亡等,是一种内源性神经保护因子。不同长度的Apelin多肽片段在体内的分布、与APJ的结合能力、体内外生理与药理作用都不尽相同。Apelin能抑制大脑皮质细胞中活性氧的产生、细胞色素C 的释放以及caspase-3 的激活,促进Akt 和ERKl/2的磷酸化,抑制大脑皮质细胞凋亡,减少Ca2+积聚,降低钙蛋白酶calpain的活化,保护大脑皮质神经元抵抗谷氨酸的兴奋性毒性损伤[15]。
Apelin前体肽在蛋白水解酶的作用下可分解为长度不同的多肽片段,以Apelin-13 生物活性最强[16-17]。Apelin-13在神经系统的表达水平较高,与神经系统疾病的关系非常密切。本研究采用Apelin-13对脑缺血-再灌注损伤大鼠进行治疗,其结果显示,Apelin-13改善了脑缺血-再灌注损伤大鼠模型的临床症状、神经功能缺损,增强肌力,显著性降低了脑组织的含水量和脑水肿的程度,也显著性降低神经功能评分和脑梗死体积和比例。同时本研究通过TUNEL染色对缺血周边脑组织神经细胞凋亡进行观察发现,中、大剂量Apelin-13干预后,TUNEL阳性细胞明显减少,表明Apelin-13可抑制局灶性脑缺血再灌注损伤后神经细胞凋亡。
机体在遭受有害刺激时出现氧化应激反应,产生了大量的活性氧自由基,超出了机体对其清除能力,从而对细胞的DNA、蛋白质和脂质等造成巨大的损伤。MDA是活性氧发生脂质过氧化的终产物,是衡量机体内细胞发生氧化应激的指标之一。SOD是清除体内活性氧自由基的主要自由基清除剂,通过催化超氧化物发生岐化反应而清除自由基[18]。本研究结果显示干预B组和C组通过Apelin-13处理明显抑制了缺血周边脑组织中氧化应激的产生,降低了MDA含量,显著增加了SOD的活性。结果表明Apelin-13 抑制了氧化应激反应达到保护脑缺血-再灌注损伤。与以往的研究发现Apelin能通过抗氧化应激[19],对抗肌萎缩性侧索硬化症的进展,发挥神经保护作用相一致
ERK介导的细胞信号转导通路可能是多种刺激的共同通路。本实验研结果显示,脑缺血再灌注后,脑组织中ERK1/2总量并未发生明显的改变,而ERK1/2磷酸化水平增强,说明ERK1/2的活化在脑缺血再灌注中扮演了重要角色。本实验对Apelin-13的研究中发现,Apelin-13处理对缺血再灌注脑组织有保护作用,表现在减轻神经功能缺损、脑水肿以及抑制细胞凋亡。同时发现Apelin-13处理后进一步增加了脑组织ERK1/2的磷酸化水平,提示p-ERK1/2可能在脑缺血再灌注后扮演着一个保护性的角色;同时也提示,Apelin-13干预在脑缺血再灌注后发挥一系列保护作用可能与ERK1/2蛋白活化相关。
总之,本研究表明Apelin-13对大鼠局灶性脑缺血-再灌注损伤有保护作用,其机制可能与Apelin-13抑制氧化应激有关。Apelin-13是防治脑缺血-再灌注损伤的一种有效途径和新的方法,为脑缺血-再灌注损伤提供了新的治疗靶点和策略。
| [1] | Bell ML. Comment: temperature and risk of stroke mortality inChina[J]. Neurology,2013, 81 (12) : 1064-70. DOI: 10.1212/WNL.0b013e3182a4a43c. |
| [2] | 武菲, 张秋玲. Apelin/APJ系统的神经保护作用及其机制[J]. 生理科学进展,2013, 44 (1) : 39-44. |
| [3] | Pope GR, Roberts EM, Lolait SJ, et al. Central and peripheral apelinreceptor distribution in the mouse: species differences with rat[J]. Peptides,2012, 33 (1) : 139-48. DOI: 10.1016/j.peptides.2011.12.005. |
| [4] | Zeng XJ, Yu SP, Zhang L, et al. Neuroprotective effect of theendogenous neural peptide apelin in cultured mouse cortical neurons[J]. Exp Cell Res,2010, 316 (11) : 1773-83. DOI: 10.1016/j.yexcr.2010.02.005. |
| [5] | Drougard A, Duparc T, Brenachot X, et al. Hypothalamic apelin/reactive Oxygen species signaling controls hepatic glucosemetabolism in the onset of diabetes[J]. Antioxid Redox Signal,2014, 20 (4) : 557-73. DOI: 10.1089/ars.2013.5182. |
| [6] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middlecerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20 (1) : 84-91. DOI: 10.1161/01.STR.20.1.84. |
| [7] | Yulu? E, Türedi S, Karagüzel E, et al. The short term effects ofresveratrol on ischemia-reperfusion injury in rat testis[J]. J PediatrSurg,2014, 49 (3) : 484-9. |
| [8] | Dachir S, Shabashov D, Trembovler V, et al. Inosine improvesfunctional recovery after experimental traumatic brain injury[J]. Brain Res,2014, 1555 (1) : 78-88. |
| [9] | Cong WT, Ling J, Tian HS, et al. Proteomic study on the protectivemechanism of fibroblast growth factor 21 to ischemia-reperfusioninjury[J]. Can J Physiol Pharmacol,2013, 91 (11) : 973-84. DOI: 10.1139/cjpp-2012-0441. |
| [10] | Tie R, Ji L, Nan Y, et al. Achyranthes bidentata polypeptidesreduces oxidative stress and exerts protective effects againstmyocardial ischemic/reperfusion injury in rats[J]. Int J Mol Sci,2013, 14 (10) : 19792-804. DOI: 10.3390/ijms141019792. |
| [11] | Xue L, Wu Z, Ji XP, et al. Effect and mechanism of salvianolic acidB on the myocardial ischemia-reperfusion injury in rats[J]. AsianPac J Trop Med,2014, 7 (4) : 280-4. DOI: 10.1016/S1995-7645(14)60038-9. |
| [12] | Kurtoglu T, Basoglu H, Ozkisacik EA, et al. Effects of cilostazol onoxidative stress,systemic cytokine release,and spinal cord injury ina rat model of transient aortic occlusion[J]. Ann Vasc Surg,2014, 28 (2) : 479-88. DOI: 10.1016/j.avsg.2013.08.005. |
| [13] | Carpéné C, Dray C, Attané C, et al. Expanding role for the apelin/APJ system in physiopathology[J]. J Physiol Biochem,2007, 63 (4) : 359-73. |
| [14] | Lang L, Ingorokva S, Hausott B, et al. Selective up-regulation ofthe vasodilator peptide apelin after dorsal root but not after spinalnerve injury[J]. Neuroscience,2010, 170 (3) : 954-60. DOI: 10.1016/j.neuroscience.2010.07.054. |
| [15] | Cook DR, Gleichman AJ, Cross SA, et al. NMDA receptormodulation by the neuropeptide apelin: implications for excitotoxicinjury[J]. J Neurochem,2011, 118 (6) : 1113-23. DOI: 10.1111/j.1471-4159.2011.07383.x. |
| [16] | Hosoya M, Kawamata Y, Fulmsumi S, et al. Molecular andfunctional characteristics of APJ[J]. J Biol Chem,2000, 275 (28) : 2106-7. |
| [17] | Lee DK, Saldivia VR, Nguyen T, et al. Modification of the terminalresidue of apelin-13 antagonizes its hypotensive action[J]. Endocrinology,2005, 146 (1) : 231-6. DOI: 10.1210/en.2004-0359. |
| [18] | Hagar H, Al Malki W. Betaine supplementation protects againstrenal injury induced by Cadmium intoxication in rats: role ofoxidative stress and caspase-3[J]. Environ Toxicol Pharmacol,2014, 37 (2) : 803-11. DOI: 10.1016/j.etap.2014.02.013. |
| [19] | Kasai A, Kinjo T, Ishihara R, et al. Apelin deficiency accelerates theprogression of amyotrophic lateral sclerosis[J]. PLoS One,2011, 6 (8) : e23968. DOI: 10.1371/journal.pone.0023968. |
 2015, Vol. 35
2015, Vol. 35

