2. 中山大学附属第五医院神经内科, 广东 珠海 519000 ;
3. 湖南省长沙市第一医院, 湖南 长沙 410005
2. Department of Neurology,Fifth Affiliated Hospital,Sun Yat-sen University,Zhuhai 519000,China ;
3. Department of Neurology,First Hospital of Changsha,Changsha 410005,China
阿尔茨海默病(Alzheimer's disease,AD)是一种以进行性认知障碍和记忆能力损害为主的中枢神经系统退行性疾病,其病因和发病机制尚不完全清楚,可能与环境和遗传等多因素相关。血管紧张素转化酶(ACE)与心脑血管疾病的关系早已受到关注,可能参与了认知功能减退的多因素进程[1]。有研究发现,在AD患者脑脊液中ACE活性与正常对照组相比明显增高[2];还有研究表明:ACEI 类药物可改善AD患者的认知功能[3],在AD动物模型中,脑内ACE活性显著升高,给予能透过血脑屏障的ACEI 培哚普利2 d(1 mg·kg-1)即可降低ACE活性、改善AD 模型小鼠认知损害[4],其可能的机制为ACE活性升高能够使血管紧张素Ⅱ生成增多,后者具有抑制乙酰胆碱释放的作用,而乙酰胆碱与学习、记忆功能有关。这些均说明ACE与AD的发生发展可能存在某种关联。
在国内外,ACE基因多态性与AD的相关研究已有一些研究报道,主要在ACE 基因的rs4291、rs4309、rs4343位点[5-7],但结论不一致,也无上述3个位点多态性同时与某一地区AD人群的相关性研究。本实验采用飞行时间质谱(MALDI-TOF MS)技术对ACE基因的rs4291、rs4309、rs4343位点进行基因分型检测,分析AD患者及健康人群中上述位点基因型、等位基因频率的分布,从而探讨ACE基因的改变与AD发病的相关性,从基因水平探讨AD的遗传背景及发病机制,为AD的基因诊断及早期治疗提供一定的线索。
1 资料和方法 1.1 研究对象AD组为2009年7月~2013年7月在中南大学湘雅三医院神经内科临床确诊的AD患者,对照组来自于同期该院健康管理中心的非痴呆体检人群,收集上述人群的临床资料和外周血标本。AD 组共201 例,其中男性90 例、女111 例,年龄76.79±5.65 岁,病程1~15 年;MMSE 评分15.36±3.48分,ADL评分54.24±7.82分,改良长谷川痴呆量表评分14.52±4.26分。对照组共257例,其中男性121例,女性136例,年龄75.88±6.50岁,智能及日常生活能力均正常,并排除有心梗、心衰、脑卒中、2型糖尿病、动脉粥样硬化、自身免疫性疾病等的患者。本实验获得中南大学湘雅三医院伦理委员会批准(2012伦审第(S177)号),本人或家属签署知情同意书。
1.2 基因组DNA的提取把收集好的血液样品从-20 ℃冰箱取出,置于常温下解冻,采用由北京康为世纪生物科技有限公司提供的血液基因组试剂盒提取外周血DNA。将得到的DNA溶液分装于1.5 mL EP管,并由专人进行标记,保存于-20 ℃冰箱备用。
1.3 鉴定DNA浓度及纯度取DNA样本2 μL,同时加入98 μL双蒸水,加入比色杯后混匀,用装有无菌无酶Tip头的移液器来回搅拌吸附数次,再放入紫外分光光度计中检测DNA浓度,每一次检测均以100 μL去离子水校准调零。记录紫外分光光度计A260/A28比值。结果显示该比值在1.7~2.0 之间,说明所得的DNA样本纯度较好,可进行下一步的分型研究。
1.4 引物设计采用Sequenom公司的软件Assay Design 3.1 进行引物设计并由北京智云捷生物技术有限公司(BeijingGene-Cloud.BiotechnologyCo.,Ltd)合成。其PCR 特异性扩增引物及单碱基延伸引物为见表 1。
| 表 1 SNP位点扩增引物及延伸引物序列 Table 1 Amplification primers and extension primers of the SNPs |
利用SequenomMassARRAY系统对基因位点进行基因分型(委托北京智云捷生物技术有限公司完成),具体步骤如下:(1)PCR 扩增位点所在的DNA片段:将提取纯化后的基因组DNA样品定量稀释,按设计顺序加1 μL DNA样品于384 孔板上,然后添加4 μL PCR 扩增体系,使反应物的终浓度为1 U 的Taq聚合酶,10 ng 基因组DNA,各0.1 μmol/L 的PCR 引物,500 μmol/LdNTP。PCR 反应条件:94 ℃ 15 min,(94 ℃ 20 s,56 ℃30 s,72 ℃ 60 s)进行45 个循环,72 ℃ 3 min;(2)虾碱性磷酸酶(Shrimp alkaline phosphatase,SAP)反应:添加0.5 U 的SAP 去除未反应完的dNTP,反应条件为37 ℃ 40 min,85 ℃ 5 min;(3)经过PCR产物纯化和延伸引物单碱基延伸反应后获得待检测样本,将待检测样本经过树脂除盐纯化,芯片点样、质谱检测,应用TYPER4.0软件分析实验结果,获得分型数据。
1.6 统计方法运用SPSS19.0统计软件包进行统计分析。两组间基因型与等位基因频率比较用χ2检验。运用SHEsis(http://analysis2.bio-x.cn/myAnalysis.php)软件进行Hardy-weinberg检验、连锁不平衡及单体型分析。定义P<0.05差异具有统计学意义。
2 结果 2.1 AD组与对照组一般资料比较本研究一共纳入了201名AD患者及257名非AD患者,两组人员的一般资料见表 2。AD组与对照组之间年龄及性别差异没有统计学意义(P>0.05),说明两组之间人均资料均衡。两组在丧偶、头部外伤史、高血压病史、体质量指数(BMI)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、甘油三酯(TG)、空腹血糖(FBS)方面差异均无统计学意义(P>0.05),在文化程度及血胆固醇方面差异有统计学意义(P<0.05,表 2)。
| 表 2 AD组与对照组的一般资料及生化指标比较 Table 2 Clinical characteristics in AD group and control group |
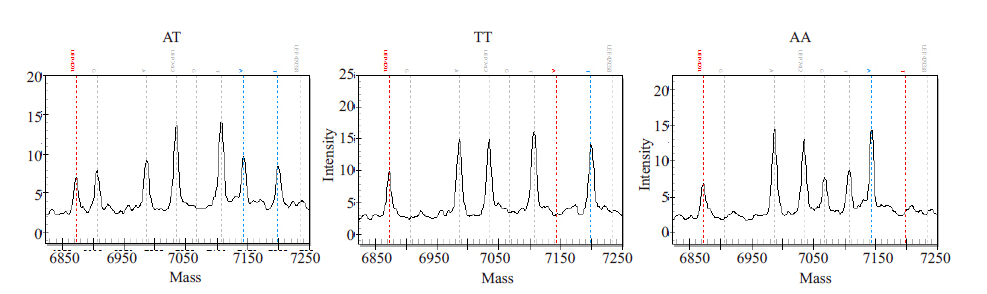
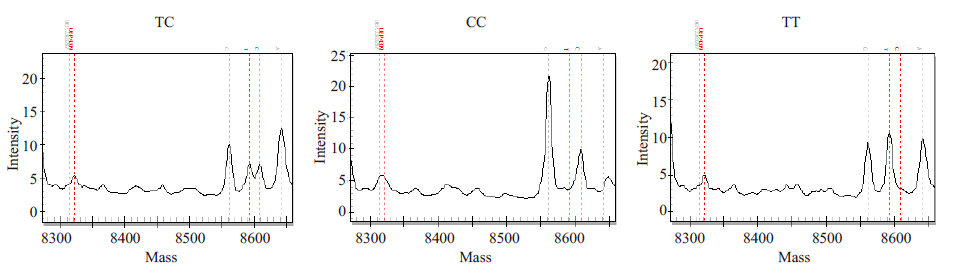
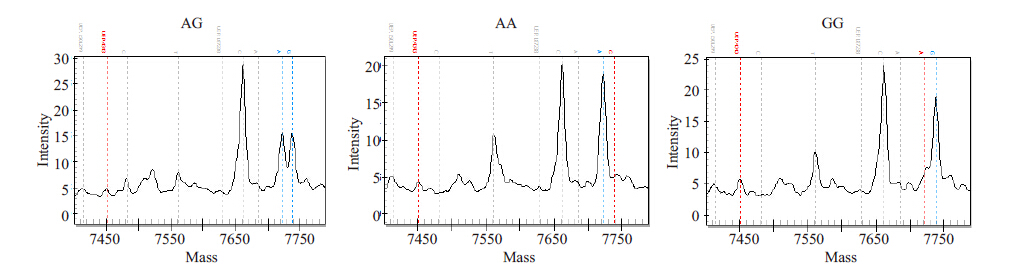
MassArray 检测结果显示rs4291 在AD组和对照组都有AT、AA、TT三种基因型,rs4309在AD组和对照组都有CC、CT、TT三种基因型,rs4343在AD组和对照组都有AA、AG、GG 三种基因型。rs4291、rs4309、rs4343位点质谱特征基因型峰图分别(图 1~3)。
|
图 1 rs4291质谱特征基因型峰图 Figure 1 Spectrometric genotype-feature peak charts of rs4291(AT, TT, AA). |
|
图 2 rs4309质谱特征基因型峰图 Figure 2 Spectrometric genotype-feature peak charts of rs4309(TC, CC, TT). |
|
图 3 rs4343质谱特征基因型峰图 Figure 3 Spectrometric genotype-feature peak charts of rs4343(AG, AA, GG). |
对AD组和对照组rs4291、rs4309、rs4343位点基因型进行Hardy-Weinberg检验,结果显示P>0.05,表明上述位点均符合H-W平衡。
2.4 AD组与对照组rs4291、rs4309、rs4343位点多态性分布情况AD组和对照组的ACE基因rs4291、rs4309、rs4343位点多态性分布见表 3。与对照组比较,AD组rs4291位点等位基因分布无统计学差异(χ2=3.490,P=0.062),基因型分布无统计学差异(χ2=3.903,P=0.142);AD组rs4309 位点等位基因分布有统计学差异(OR=1.917,95% CI=1.431-2.568,χ2=19.288,P<0.001),基因型分布有统计学差异(χ2=20.690,P<0.001);AD组rs4343位点等位基因分布有统计学差异(OR=0.714,95% CI=0.532-0.957,χ2=5.104,P=0.024),而基因型分布无统计学差异(χ2=5.685,P=0.058)。
| 表 3 ACE基因SNPs在AD组及对照组的分布情况 Table 3 Distribution of SNPs in the two groups |
运用SHEsis 软件对ACE 基因rs4291、rs4309 及rs4343位点进行连锁不平衡及单体型分析。连锁不平衡分析结果显示上述3 个位点两两间的D'值如下:rs4291、rs4309 D'值为0.70,rs4291、rs4343 D'值为0.87,rs4309、rs4343 D'值为0.65,见图 4。单体型分析显示其内部构成ATA、ACA、TCA、TCG、TTG五个单体型。其中ATA单体型可能与AD发病负相关(OR=0.558,95%CI=0.420-0.741,P<0.05),即携带这种单体型的个体AD发病风险较低;ACA、TCA单体型可能与AD发病正相关(ACA:OR=4.883,95% CI=2.267-10.518,P<0.05;TCA:OR=2.269,95%CI=1.083-4.754,P<0.05),即携带这种单体型的个体AD发病风险较高,见表 4。

|
图 4 ACE基因rs4291、rs4309、rs4343 SNPs位点LDPlot图 Figure 4 Linkage disequilibrium of ACE SNPs (rs4291,rs4309 and rs4343). The number in each box indicatesthe pairwise LD as assessed by the D' value. |
| 表 4 ACE基因rs4291、rs4309及rs4343位点的单体型分析 Table 4 Estimated haplotypes in the case-control samples in ACE |
虽然传统观点认为:Aβ在脑内过量沉积形成老年斑、神经原纤维缠结、神经元大量脱失是导致AD患者进行性记忆减退等认知功能下降的病理基础,但近年来血管因素在AD发病中的作用越来越受到重视[8-10],改善脑血液循环可降低AD发病的风险和改善预后[11-12]。ACE是肾素-血管紧张素系统中缓激肽代谢的关键酶,它通过降解缓激肽使缓激肽失去活性,从而导致缓激肽在肾素-血管紧张素系统中作用减弱或消失。当ACE基因突变时,ACE对缓激肽的作用减弱,导致血管收缩,从而影响脑血液循环,增加AD的发病风险。我们的研究通过对458个样本(201例AD患者和257例对照者)ACE基因rs4291、rs4309、rs4343三个位点进行检测,并排除了血压等心血管因素造成实验结果偏差的可能性,以明确ACE基因与AD发病的可能关系,为研究血管因素在AD发病中的可能作用提供依据。
3.1 ACErs4291与AD的相关性分析Helbecque等[5]的研究表明在大于73岁的人群中,rs4291等位基因T为AD的保护因素。但是本研究并未发现该rs4291与AD的发病相关,这一结果与Belbin[13]、Meng等[14]的研究一致。由等位基因频率分布可以看出在对照组健康人群中,rs4291T等位基因频率为27.6%,与Meng 等[14]33%无显著差异,但与Helbecque 等[5]的45.9%、Belbin 等[13]及Irvin 等[15]的37%、Miners 等[16]的48%有显著区别,提示该基因位点等位基因频率存在明显的种族或地域差异,也可能造成试验结果的不一致。
3.2 ACErs4309与AD的相关性分析目前rs4309与AD关联的研究未见文献报道,本研究首次发现rs4309 与AD相关。在AD组和对照组中rs4309C等位基因频率分别为35.1%和22.0%,AD组C等位基因频率明显高于对照组,AD组与C等位基因呈显著正关联,OR=1.917,说明携带C等位基因者患AD的可能性比未携带C等位基因者高1.917倍。可能的机制考虑为rs4309位点的突变影响了ACE的生物活性,从而进一步调控了RAS及KKS的生物学活性等多个途径参与AD。
3.3 ACErs4343与AD相关性分析既往关于ACE基因rs4343位点多态性与AD的相关性研究并未达成一致结论:Belbin 等[13]研究表明rs4343位点多态性与高加索人群AD的发病无相关性;Ning等[6]研究表明rs4343等位基因为中国上海地区人群AD发病的危险因素。然而,Helbecque N等[5]的研究对象为来自法国、英国、荷兰、西班牙和意大利等欧洲国家,将年龄进行分层后发现在大于73 岁的人群中,rs4343 等位基因为AD的保护因素;另有研究表明,rs4343等位基因是以色列的阿拉伯人群AD发病的危险因素[14]。本研究结果显示,AD组rs4343A等位基因频率显著降低(OR=0.714,95%CI=0.532-0.957,P=0.024),亦支持A等位基因是AD的保护性因素。由等位基因频率分布可以看出在对照组中,rs4343G等位基因频率为23.9% ,与Meng 等[14]18% 无显著差异,但与Helbecque 等[5]的48.1%、Belbin 等[13]的49%、Irvin 等[15]的44%、Miners等[16]的59%有显著区别,提示该基因位点等位基因频率存在明显的种族或地域差异,可能是造成临床研究结果各异的原因之一。
3.4 ACE单体型与AD的相关性分析关于ACE单体型与AD的相关性已有报道,Helbecque等[5]的研究表明在大于73 岁的人群中,由rs4343/rs4291/rs1799752 组成的单体型中,ATI 为保护因素。Meng等[14]的研究结果显示rs4343/rs4351组成的GA单体型是AD 的危险因素。在上海地区选取的144LOAD患者和476对照者进行的一项病例对照研究结果表明,由rs1800764/rs4343/rs1799752 三个位点构成CAI、CGD、TAI、TGD、TGI 五种单体型,其中CGD是AD的保护性因素,CAI、TGD、TGI为危险因素[6]。本研究结果提示ATA、ACA、TCA单体型可能与AD发病相关。但ACA、TCA单体型增加AD发病风险应该被慎重看待,因为在我们的样本中上述单体型携带者数量比较少。尽管单体型分析样本量较少,但仍为今后的研究提供了可能的方向。
本研究首次发现ACE基因rs4309位点与AD 存在相关,而ACE基因rs4291、rs4343位点与AD的相关性研究,目前国内外的试验结果并不一致。不一致性可能与样本量大小以及种族的不同有关,也不排除样本选择、统计、人群分层对研究结果的影响。另外,目前AD的临床诊断标准也可能会对试验结果造成影响。有一部分试验采用的标本是临床诊断和病理诊断相结合的方式,这可能也会对试验研究的结果产生影响。有关上述三个多态性位点与AD关系的研究,尚需进一步进行,如它们与环境因素的作用以及和其他的多态性位点的相互作用,对相应蛋白产物的影响等。
| [1] | Yang L, Zhou HH, Yf Y, et al. Association of PS1 1/2,ACE I/D,and LRP C/T polymorphisms with disease in the Chinesepopulation:a meta-analysis of case-control studies[J]. Genet MolRes,2015, 14 (1) : 1017-24. |
| [2] | Jochemsen HM, Van Der Flier WM, Ashby EL, et al. Angiotensinconvertingenzyme in cerebrospinal fluid and risk of brain atrophy[J]. J Alzheimers Dis,2015, 44 (1) : 153-62. |
| [3] | Hebert PL, Mcbean AM, O'connor HA, et al. Time until incidentdementia among Medicare beneficiaries using centrally acting ornon-centrally acting ACE inhibitors[J]. Pharmacoepidemiol DrugSaf,2013, 22 (6) : 641-8. DOI: 10.1002/pds.v22.6. |
| [4] | Dong YF, Kataoka K, Tokutomi Y, et al. Perindopril,a centrallyactive angiotensin-converting enzyme inhibitor,prevents cognitiveimpairment in mouse models of Alzheimer's disease[J]. FASEB J,2011, 25 (9) : 2911-20. DOI: 10.1096/fj.11-182873. |
| [5] | Helbecque N, Codron V, Cottel D, et al. An age effect on theassociation of common variants of ACE with Alzheimer's disease[J]. Neurosci Lett,2009, 461 (2) : 181-4. DOI: 10.1016/j.neulet.2009.06.006. |
| [6] | Ning M, Yang Y, Zhang Z, et al. Amyloid-β-related genes SORL1and ACE are genetically associated with risk for late-onsetAlzheimer disease in the Chinese population[J]. Alzheimer DisAssoc Disord,2014, 24 (4) : 390-6. |
| [7] | Wang XB, Cui NH, Gao JJ, et al. Angiotensin-converting enzymegene polymorphisms and risk for sporadic Alzheimer's disease: ameta-analysis[J]. J Neural Transm,2015, 122 (2) : 211-24. DOI: 10.1007/s00702-014-1235-x. |
| [8] | Regalado Doña PJ1, Azpiazu Artigas P, Sánchez Guerra ML, et al. Vascular risk factors and Alzheimer's disease[J]. Rev Esp GeriatrGerontol,2009, 44 (2) : 98-105. DOI: 10.1016/j.regg.2008.12.004. |
| [9] | Bidzan M, Bidzan L, Pachalska M. Neuropsychiatric symptoms inpatients with Alzheimer's disease with a vascular component[J]. Ann Agric Environ Med,2014, 21 (2) : 412-5. DOI: 10.5604/1232-1966.1108615. |
| [10] | Barker R, Ashby EL, Wellington D, et al. Pathophysiology of whitematter perfusion in Alzheimer's disease and vascular dementia[J]. Brain,2014, 137 (5) : 1524-32. DOI: 10.1093/brain/awu040. |
| [11] | Lobanova I, Qureshi A. The association between cardiovascular riskfactors and progressive hippocampus volume loss in persons withAlzheimer's disease[J]. J Vasc Interv Neurol,2014, 7 (5) : 52-5. |
| [12] | de Bruijn RF, Ikram MA. Cardiovascular risk factors and future riskof Alzheimer's disease[J]. BMC Med,2014, 12 : 130. DOI: 10.1186/s12916-014-0130-5. |
| [13] | Belbin O, Brown K, Shi H, et al. A multi-center study of ACE andthe risk of late-onset Alzheimer's disease[J]. J Alzheimers Dis,2011, 24 (3) : 587-97. |
| [14] | Meng Y, Baldwin CT, BowirratA, et al. Association of polymorphismsin the Angiotensin-converting enzyme gene withAlzheimer disease in an IsraeliArabcommunity[J]. Am J HumGenet,2006, 78 (5) : 871-7. DOI: 10.1086/503687. |
| [15] | Irvin MR, Lynch AI, Kabagambe EK, et al. Pharmacogeneticassociation of hypertension candidate genes with fasting glucose inthe GenHAT Study[J]. J Hypertens,2010, 28 (10) : 2076-83. DOI: 10.1097/HJH.0b013e32833c7a4d. |
| [16] | Miners S, Ashby E, Baig S, et al. Angiotensin-converting enzymelevels and activity in Alzheimer's disease: differences in brain andCSF ACE and association with ACE1 genotypes[J]. Am J TranslRes,2009, 1 (2) : 163-77. |
 2015, Vol. 35
2015, Vol. 35

