近年来,分子影像已成为医学影像技术新的研究领域,而基因显像是其中重要组成部分,其中基因显像又包括直接基因显像和间接基因显像,即反义基因显像和报告基因显像,前者即将放射性核素标记的反义探针转染进靶细胞,利用核素显像仪器使得靶细胞内目标基因得到显像,从而达到在基因水平对疾病的定性、定位诊断的目的[1]。最近的研究表明,miRNA208b在未发生形态学改变的早期肥大心肌细胞内高表达,且具有高度心肌特异性[2],而现行的检查方法只能探查已发生形态学改变后的肥大心肌细胞,依然缺乏一种早期的检查手段,根据反义显像原理,若能将核素标记的AMO转染进高表达miRNA208b的心肌细胞内,并与之杂合,就有可能达到早期肥大心肌细胞显像的目的。本实验过程以期为下一步在体早期肥大心肌细胞显像提供实验基础。
1 材料与方法 1.1 材料Sep-PakC18 反相层析柱,美国Waters;GeneQuant DNA/RNA calculator,美国Pharmacia Biotech公司;SN-682型放射免疫γ计数器,上海核福光电仪器有限公司;KDC-2044低温冷冻离心机,科大创新股份有限公司中佳分公司;高锝酸盐99TcmO4-淋洗液,原子高科股份有限公司;阳离子脂质体转染剂(Lipofectamine2000),美国Invitrogen公司;1~3 d龄雄性SD小鼠,购自南方医科大学动物实验中心,动物批号SCXK(粤)2011-0015。
1.2 方法过程 1.2.1 LNA- AMO的设计和制备首先从Genbank 中搜索到大鼠心肌细胞miRNA208b 的基因序列为5'-ATAAGACGAACAAAAGGTTTGT-3',根据碱基配对原则,合成针对miRNA208b的AMO,并经LNA修饰。
1.2.2 NHS-MAG3-LNA-AMO的制备将NHS-MAG3溶于无水二甲基甲酰胺(DMF)中,配成浓度为10 mg/mL的溶液。取150 μg的LNA- AMO于60 ℃水浴中静置10 min,溶解于150 mmol/L 的无菌NaHCO3 缓冲液(pH=8.5)中,最终浓度为5 μg/μL。将NHS-MAG3以摩尔比为20∶1的比例逐滴加入LNA-AMO溶液中,边滴加边震荡。最终配比液室温静置1 h后经Sep-Pak C18反相层析柱洗脱,洗脱液为30%的乙腈溶液(溶于0.1 mol/L乙酸胺),收集洗脱液,按每管10 μg 分装,经GeneQuant DNA/RNA calculator测定各收集管在260 nm波长处的吸光度值,冷冻干燥后-20 ℃储存备用。
1.2.3 99Tcm标记NHS-MAG3-LNA-AMO及标记物的纯化取一管NHS-MAG3-LNA- AMO溶液溶解于50 μL0.25 mol/L的碳酸氢盐缓冲液中,快速依次加入100 μL的N-三甲基甘氨酸(tricine)溶液(70 mg/mL)、3 μL溶于0.1 mmol/L 盐酸的SnCl2.2H2O溶液以及高锝酸盐99TcmO4-淋洗液(约185 MBq),室温下摇匀3 h,标记完毕。标记物经Sep-Pak C18反相层析纯化,用生理盐水洗脱,经SN-682型放射免疫γ计数器测定洗脱液的放射性计数,经快速小型纸层析法测得纯化后标记率大于84%,放化纯度大于86%。纸层析法的固定相为whatmanNo.1层析纸,展开剂为V(丙酮):V(2 mol/L Hcl)=4∶1。
1.2.4 标记物稳定性及分子杂交活性测定取等量纯化后的标记物,分别溶解于2倍体积的新鲜人血清、生理盐水中,孵育12 h,用快速小型纸层析法分别测定在2、4、6、8、12 h的放化纯度,根据不同孵育时间放化纯度的改变以评估标记物的稳定性。而分子杂交活性的测定是将纯化后标记物与miRNA208b 靶向基因核酸在室温下反应1 h后测定放射性计数,与未杂合的标记物对比,比较两者放射性峰值位置分布的改变。
1.2.5 建立AngⅡ诱导离体心肌肥大细胞模型并测定心肌细胞大小将新生SD乳鼠经颈椎脱臼法处死,迅速取出心脏,预冷生理盐水清洗血迹,滤纸吸干后,剪去心房及右心室,用眼科剪剪碎左心室组织,加入消化液(胰蛋白酶及I型胶原酶),于培养振荡器中消化20 min,弃去上清液,重复多次消化后,最终沉淀用RPMI 1640培养液分散成单细胞悬液,经差速贴壁后富集心肌细胞,调节细胞密度均匀种于培养皿,加入RPMI 1640培养液以及AngⅡ10-9 mol/L,在37 °C、5% CO2饱和湿度条件下培养,分别在培养0、12、24 h时取细胞于6孔培养板上,每孔1×105细胞,在相差显微镜下用测微器测量心肌细胞直径,每孔观察10个视野,每个视野观察10个细胞,测平均值。
1.2.6 qRT-PCR 扩增技术测定早期肥大心肌细胞miRNA208b表达将AngII诱导培养了0、12、24 h的心肌细胞分别转移至EP管中,加Trizol提取总RNA,步骤按RT-PCR试剂盒示:体系包括待测RNA1 μg,RT产物1 μL、Realtime PCR Master Mix(SYBR Green)5 μL、上游引物0.4 μL、下游引物0.4 μL及RNase-free H2O 混合至10 μL。PCR循环反应参数为:95 ℃,10 s;60 ℃,20 s;72 ℃,30 s,以U6为内参,测定miRNA208b相对表达量。
1.2.7 脂质体包裹99Tcm-NHS-MAG3-LNA- AMO后转染早期肥大心肌细胞将4.0 μg 99Tcm-NHS-MAG3-LNAAMO及10 μL阳离子脂质体转染剂Lipofectamine分别稀释于25 μL不含血清及抗生素的RPMI 1640培养液,前者即为a液,后者于室温下孵育10 min,即为b液。将a液与b液混合均匀,室温下放置30 min后,将混合液加入有心肌细胞(培养12 h时)的培养板各孔内,轻轻震荡混匀,置入培养箱内,在37 ℃、5% CO2饱和湿度条件下培养,分别于3、6、9 h检测细胞的放射性计数,计算细胞内放射性滞留率。
1.2.8 统计学方法所有数据用均数±标准差表示,使用统计软件SPSS 19.0,组间比较用两独立样本t检验,P<0.05有显著意义。
2 结果 2.1 目标产物收集NHS-MAG3-LNA-AMO经Sep-Pak C18反相层析柱洗脱后的洗脱液,利用核酸在260 nm处具有增色效应的特点,经Gene Quant DNA/RNA calculator测定其在此波长区域的吸光度,结果图谱中显示两处波峰,分别在第12及30管处出现,即由洗脱液中核酸所引发,这亦说明了收集的产物为目标产物。
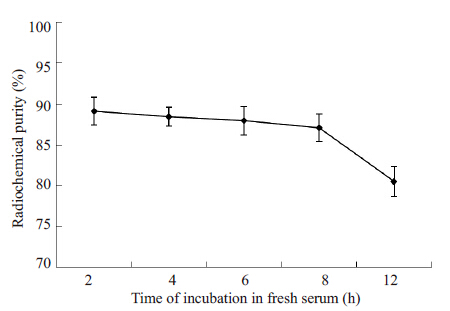
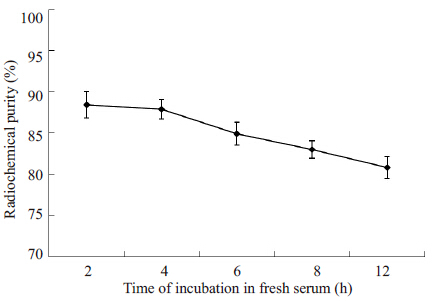
2-2 标记物稳定性的检测标记纯化后的标记物,分别在新鲜人血清、生理盐水中孵育12 h,测定在2、4、6、8、12 h 的放化纯度,检测放化纯度如图 1、2,由图可看出标记物在新鲜人血清、生理盐水中,孵育12 h后,其放化纯度均大于80%,稳定性良好。
|
图 1 标记物在新鲜血清中孵育后放化纯度的改变 Figure 1 Changes of radiochemical purities of the labeledcompounds after incubation in fresh serum. |
|
图 2 标记物在生理盐水中孵育后放化纯度的改变 Figure 2 Change of radiochemical purities of labeledcompounds after incubation in normal saline. |
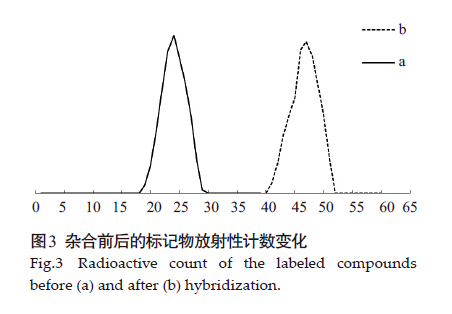
标记物经Sep-Pak C18反相层析纯化后测量洗脱液放射性计数如图 3a,标记物与miRNA208b靶基因杂合,纯化后检测洗脱液放射性计数,如图 3b。根据Sep-Pak C18反相层析的原理,不同物质按照极性由强至弱的顺序先后被洗脱。杂合后的标记物极性变弱,被洗脱的顺序靠后,致其放射性峰值向后推移,间接说明了制备的标记物具有与靶基因杂合的能力。
|
图 3 杂合前后的标记物放射性计数变化 Figure 3 Radioactive count of the labeled compoundsbefore (a) and after (b) hybridization. |
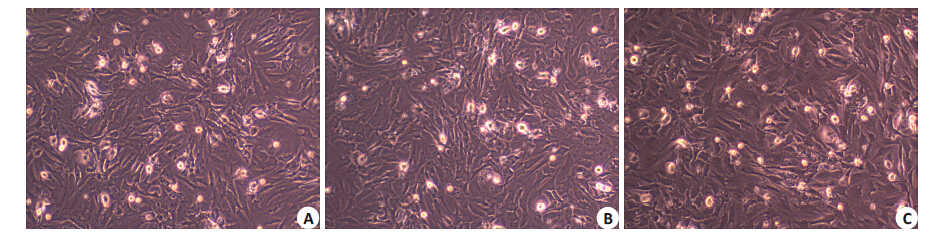
通过AngⅡ诱导心肌肥大模型,于0、12、24 h时测定心肌细胞直径分别为19.252±1.80、20.761±1.76、27.176±1.28 μm,后两组差异有统计学意义(P<0.05),而前两组差异无统计学意义(P>0.05),表明心肌细胞于24 h时已发生肥大的形态学改变,而12 h时心肌细胞尚处于早期肥大阶段。镜下心肌细胞形态(图 4)。
|
图 4 经AngⅡ诱导不同时间后镜下心肌细胞形态 Figure 4 Morphology of AngII-induced cardiac myocytes at 0 (A), 12 h (B), and 24 h (C) during induction (Original magnification: ×100). |
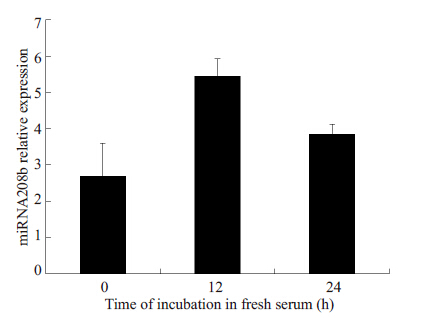
利用qRT-PCR扩增技术测定经AngⅡ诱导培养0、12、24 h的心肌细胞内miRNA208b的相对量,如图 5,可见12 h时miRNA208b相对表达量高于其他时段,且由2.4结果可知,此时心肌细胞正处于早期肥大阶段。
|
图 5 qRT-PCR 扩增技术测定心肌细胞内miRNA208b的相对表达量 Figure 5 The relative expression of miRNA208b in thecardiac myocytes detected by qRT-PCR. |
脂质体-99Tcm-NHS-MAG3-LNA-AMO复合物与经AngⅡ诱导培养12 h时的离体肥大心肌细胞作用后分别于3、6、9 h检测细胞放射性滞留率,结果分别为13.48±2.59、26.73±1.84及15.62±2.96,两者作用6 h时放射性滞留率达到最高,且大于20%,表明复合物在细胞内停留时间较长,这为后续细胞的显影提供更大的可能性。
3 讨论核素显像是一种成熟显像技术,被研究较多的核素有125I、18F、111In、113In、188Re、99mTc等,其中99mTc是核医学领域应用最广的核素,如Hnatowith等[3]成功将99Tcm标记于DNA,Kang等[4]将99Tcm标记于siRNA,通过无创性方式使得siRNA在体的信息传递过程可视化,且标记物放化纯度大于92%。99mTc可通过99Mo/99Tcm发生器产生,较其他核素,其放射剂量较小,具有较高的探测率[5],除此之外,其半衰期适中、显像清晰、价格实惠更是其优势,因而被越来越多的学者应用于分子影像领域。miRNA是近年在真核生物细胞中发现的一种小的高度保守非编码RNA分子,主要通过与靶基因mRNA的碱基配对来调节基因表达[6-7],从而在细胞增殖、分化、凋亡等过程中起重要作用。miRNA208包括miRNA208a和miRNA208b,是目前发现唯一在心脏特异性表达的miRNA,分别由α-心肌肌球蛋白(α-MHC)重链基因(Myh6)和β-心肌肌球蛋白(β-MHC)重链基因(Myh7)编码,两者的比重变化对心肌肥大的进展起到重要作用[8]。
未经修饰的AMO不稳定,容易降解,为增强其细胞通透性、膜内稳定性以及亲和力,需对其进行修饰,修饰物如LNA(带锁核酸)、2'-OMe(2'-0-甲基)、2'-MOE(2'-0-甲基乙基)、2'-氟(2'-F)、MORF(吗啡样结构)[9]、PNA(肽核酸)等,本研究选用LNA修饰AMO,因为其具有高亲和力,且结合物具有更好的细胞通透性、稳定性和特异性[10]。同时又因裸AMO无法直接携带金属离子,因此进行核素标记时必须借助双功能螯合剂介导,常见的螯合剂例如二亚乙基三胺五乙酸(DTPA)、肼基联氨基烟酰胺(HYNIC)以及N-羟基琥珀酰亚胺-巯基乙酰基三甘氨酸(NHS-MAG3),早在1985年Hnatowith等[11]便用DTPA作为抗体蛋白核素标记的螯合剂,后于1997年Winnard等[12]应用二步法合成巯基被乙酰基保护的S-acetyl-NH3-MAG3,成功将99mTc 标记于DNA,2008年Li等[13]证明NHS-MAG3的标记产物的标记率和稳定性显著高于HYNIC,同时与血浆蛋白的结合率远低于HYNIC,故本研究选用NHS-MAG3作为螯合剂。寡核苷酸作为亲水性阴离子多聚体,难以通过带负电荷的细胞膜且易被胞浆内的核酸酶水解,带正电荷的脂质体作为基因载体,因其可以提高转染率,并保护其内的核酸免遭核酸酶分解,而得到广泛应用[14-15]。
本实验证明了早期心肌肥大阶段约于模型建立12 h左右,此时心肌细胞尚未发生明显形态改变且miRNA208b表达特异性升高,奠定了早期心肌肥大核素显像的理论基础。我们最终通过双功能螯合剂NHS-MAG3的介导以及LNA的修饰,成功将99mTc标记于反义miRNA208b的寡核苷酸(AMO),并通过脂质体载体将AMO复合物转染进早期肥大心肌细胞,这为后续以miRNA208b 为靶点的早期肥大心肌细胞核素显像提供了重要的实验基础。
| [1] | Skotland T. Molecular imaging: challenges of bringing imaging of intracellular targets into common clinical use[J]. Contrast Media Mol Imaging,2012, 7 (1) : 1-6. DOI: 10.1002/cmmi.458. |
| [2] | 吴菊清, 欧阳伟, 冯会娟, 等. miRNA-208b在SD大鼠腹主动脉缩窄 心肌肥厚中的表达[J]. 广东医学,2014, 35 (14) : 2141-4. |
| [3] | Hnatowich DJ, Winnard P, Virzi F, et al. Technetium-99m labeling of DNA oligonucleotides[J]. J Nucl Med,1995, 36 (12) : 2306-14. |
| [4] | Kang L, Wang RF, Yan P, et al. Noninvasive visualization of RNA delivery with 99mTc-radiolabeled small-interference RNA in tumor xenografts[J]. J Nucl Med,2010, 51 (6) : 978-86. DOI: 10.2967/jnumed.109.069906. |
| [5] | Banerjee S, Pillai MR, Ramamoorthy N. Evolution of Tc-99m in diagnostic radiopharmaceuticals[J]. Semin Nucl Med,2001, 31 (4) : 260-77. DOI: 10.1053/snuc.2001.26205. |
| [6] | Wu L, Belasco JG. Examining the influence of microRNAs on translation efficiency and on mRNA deadenylation and decay[J]. Methods Enzymol,2008, 449 (8) : 373-93. |
| [7] | Feng HJ, Ouyang W, Liu JH, et al. Global microRNA profiles and signaling pathways in the development of cardiac hypertrophy[J]. Braz J Med Biol Res,2014, 47 (5) : 361-8. DOI: 10.1590/1414-431X20142937. |
| [8] | Callis TE, Pandya K, Seok HY, et al. MicroRNA-208a is a regulator of cardiac hypertrophy and conduction in mice[J]. J Clin Invest,2009, 119 (9) : 2772-86. DOI: 10.1172/JCI36154. |
| [9] | Martello G, Zacchigna L, Inui M, et al. MicroRNA control of Nodal signalling[J]. Nature,2007, 449 (7159) : 183-8. DOI: 10.1038/nature06100. |
| [10] | Lennox KA, Behlke MA. Chemical modification and design of anti-miRNA oligonucleotides[J]. Gene Ther,2011, 18 (12) : 1111-20. DOI: 10.1038/gt.2011.100. |
| [11] | Hnatowich DJ, Virzi F, Doherty PW. DTPA-coupled antibodies labeled with yttrium-90[J]. J Nucl Med,1985, 26 (5) : 503-9. |
| [12] | Winnard P, Chang F, Rusckowski M, et al. Preparation and use of NHS-MAG3 for technetium-99m labeling of DNA[J]. Nucl Med Biol,1997, 24 (5) : 425-32. DOI: 10.1016/S0969-8051(97)80010-8. |
| [13] | Li YC, Tan TZ, Zheng JG, et al. Anti-sense oligonucleotide labeled with technetium-99m using hydrazinonictinamide derivative and N-hydroxysuccinimidyl S-acetylmercaptoacetyltriglycline: a comparison of radiochemical behaviors and biological properties[J]. World J Gastroenterol,2008, 14 (14) : 2235-40. DOI: 10.3748/wjg.14.2235. |
| [14] | Felgner PL, Gadek TR, Holm M, et al. Lipofection: a highly efficient,lipid-mediated DNA-transfection procedure[J]. Proc Natl Acad Sci USA,1987, 84 (21) : 7413-7. DOI: 10.1073/pnas.84.21.7413. |
| [15] | Akhtar S, Hughes MD, Khan A, et al. The delivery of antisense therapeutics[J]. Adv Drug Deliv Rev,2000, 44 (1) : 3-21. DOI: 10.1016/S0169-409X(00)00080-6. |
 2015, Vol. 35
2015, Vol. 35

