2. 南方医科大学南方医院神经内科 广东 广州 510515
2. Department of Neurology,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China
Duchenne 型肌营养不良症(Duchenne musculardystrophy,DMD)是临床常见的以骨骼肌损害为主要表现的致死性X-连锁隐性遗传病。DMD基因大片段缺失是导致该病的主要突变类型[1-3]。DMD迄今无有效的治疗方法,进行携带者检测和产前诊断防止患儿的出生,从而在患病家族中阻断该病的逐代遗传就成为目前对该病防控最为有效的一个途径[4]。由于DMD女性携带者基因组中有野生型DMD基因的存在和干扰[5],作携带者检测时通常需要采用定量的方法进行分析检测。
在以往的研究中我们通过PCR步移法已实现了对多例患者DMD基因缺失连接片段进行PCR扩增和测序[6-7]。基于这段新修复连接而成的连接片段序列具有其独自的特异性,本研究提出在进行缺失型DMD携带者检测时对连接片段直接进行PCR扩增检测,即可直接达到诊断女性携带者的目的。这也是与当前常用的DMD携带者定量检测方法有所区别的一种常规PCR检测方法。
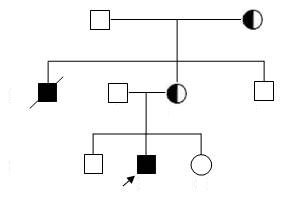
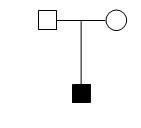
1 资料和方法 1.1 病例资料经过知情同意后分别对1个DMD家系和1例散发病例进行研究。DMD家系来自广东深圳市(图 1),以该家系中确诊的DMD患者Ⅲ2和待查携带者Ⅱ3为研究对象。DMD散发病例来自广西南宁地区(图 2),以患者Ⅱ1及其母亲Ⅰ2为研究对象。以上2例患者均为肌电图表现典型肌源性损害,血清肌酸激酶异常增高。采集上述所有研究对象的外周血样并抽提制备基因组DNA。
|
图 1 DMD患者家系图 Figure 1 Genetic map of the DMD family. |
|
图 2 DMD散发病例 Figure 2 The sporadic case of DMD. |
Ex Taq DNA聚合酶、2.5 mmol/L dNTP Mixture、100 bp DNA Ladder Marker 购自大连宝生物工程有限公司,琼脂糖为西班牙Biowest Agarose进口分装,其它试剂为国产分析纯。
1.3 引物设计 1.3.1 外显子引物设计外显子引物设计常规18对DMD基因外显子检测引物参照Chamberlain等和Beggs等的文献设计,增加第31、第32、第33、第34、第35、第46、第49、第55这8对外显子引物参照莱顿肌营养不良网页(http://www.dmd.nl)提供的引物序列进行设计。经外显子检测确定DMD家系中患者Ⅲ2为DMD基因第31~43外显子缺失,DMD散发病例Ⅱ1为DMD基因第45~54外显子缺失。
1.3.2 内含子上缺失断裂点定位引物设计采用PCR步移定位方法的原理设计断裂点所在内含子的检测引物,即在内含子上每间隔一定距离设计1对PCR引物,以比较精确地定位内含子上的断裂位点。结合实验步骤的难易和经济角度考虑,我们在内含子上平均约每3 kb序列设计1对引物来寻找缺失断裂点。对于第43和第44这2个大内含子上采取分次步移法设计引物定位断裂点的策略[6]。引物设计通过在线程序http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_www.cgi完成,每条引物平均长度20 bp,每对引物均限定其PCR产物长度在301~400 bp范围。断裂点所在的第30、第43、第44、第54内含子的序列从http://www.dmd.nl/seqs获取。
1.3.3 扩增连接片段的引物设计经PCR确定内含子缺失断裂区域后,最后设计1对扩增连接片段的引物。即选取一条尽量靠近断裂连接点上游的F向引物和一条尽量靠近断裂连接点下游的R向引物对连接片段进行PCR扩增。引物的PCR产物长度尽量限定在几百bp的范围,并要有良好的扩增特异性,以提高常规PCR扩增连接片段的成功率,达到准确和快速进行检测的目的。本实验设计对前述DMD家系病例连接片段进行扩增检测的引物为:
D31-F:5'-TGCTTGTGTGGTATGGTTCA-3'
D31-R2:5'-GCAAGCAAACCTTTCACCAG-3'
对前述散发病例连接片段进行扩增检测的引物为
D6-F:5'-CGTGCTAAACAGTTGGGGTA-3'
D6-R:5'-GGCAAAGATTCACACCACAGT-3'
以上所有引物均由上海英骏生物技术有限公司合成。
1.4 携带者检测 1.4.1 以PCR步移法进行PCR反应确定内含子上断裂点的区域PCR反应条件:96 ℃ 2 min;94 ℃ 30 s,退火(具体温度依据各引物Tm值确定)30 s,72 ℃ 1 min,35循环;72 ℃ 10 min。随后以邻近断裂连接点设计的上下游引物对DMD基因缺失连接片段进行PCR扩增。
1.4.2 DMD家系的携带者检测以引物D31-F/R2对家系中的1 例女性Ⅱ3 的基因组DNA进行连接片段的PCR扩增,同时扩增先证者Ⅲ2的连接片段作为对照。PCR反应条件:96 ℃ 2 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃1 min,35循环;72 ℃ 10 min。
1.4.3 对散发病例的女性亲属进行携带者排查检测以引物D6-F/R对患者Ⅱ1母亲的基因组DNA进行连接片段的PCR 扩增,同时扩增该患者的连接片段作为对照。PCR反应条件:96 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35循环;72 ℃ 10 min。
1.4.4 测序并验证对以上待检测女性中扩增获得阳性结果的PCR产物予纯化后测序,并与先证者的DMD基因缺失连接片段序列结果进行比较验证。
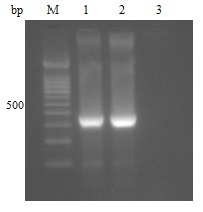
2 结果 2.1 DMD家系的携带者检测结果对上述家系中的女性Ⅱ3的基因组DNA进行连接片段的PCR检测,结果扩增出365 bp的产物片段,与本家系的患者Ⅲ2的连接片段产物长度一致(图 3)。同时测序后比较Ⅱ3 与患者Ⅲ2 的连接片段序列结果无差异,基因型一致。因此诊断家系中的Ⅱ3为DMD女性携带者。
|
图 3 DMD家系连接片段的PCR扩增 Figure 3 PCR amplification of the junction fragmentof the DMD family. M: 100 bp Ladder Marker;Lanes 1, 2: Results of Ⅱ3 and patient Ⅲ2 of thefamily, respectively; Lane 3: Normal control. |
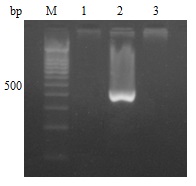
对另一DMD散发病例母亲的基因组DNA进行连接片段的PCR检测,结果为阴性,而作为对照的该患者扩增出436 bp的连接片段产物(图 4)。因此可以排除该患者的母亲为DMD携带者。
|
图 4 散发病例家庭连接片段的PCR扩增 Figure 4 PCR amplifications of the junctionfragment of the sporadic case's family. M: 100bp Ladder Marker; Lanes 1, 2: Results ofpatient's mother and the patient, respectively;Lane 3: Normal control. |
临床上要实施DMD产前遗传学咨询,准确地检测出家族中的女性携带者是首要的一步[8]。在基因诊断方面,常规PCR技术用于检测男性DMD患者大片段基因缺失一直以来是非常有效的[9],但女性携带者因为有野生型DMD基因的存在,PCR技术对于检测出其基因缺失却显得无能为力。为了解决这一难题,需要对基因进行定量检测[10]。DMD携带者检测传统采用定量Southern blotting分析、定量PCR和FISH等技术进行分析,但这些技术由于容易出现误差结果,以及操作繁琐、价格昂贵等原因,使得其推广应用受到了限制。近年来快速发展的多重连接依赖式探针扩增(MLPA)技术可以准确有效地用于DMD基因缺失和重复突变分析检测,成为一种新的富有希望的DMD携带者检测技术[11-12]。当然MLPA技术也并非完美无缺,有研究者同样评价其技术比较繁琐[13]。
DMD基因缺失连接片段是基因发生断裂缺失后断端重接形成的一段变异的DNA序列。我们通过克隆DMD基因缺失连接片段的研究并综合分析国内外连接片段序列资料后发现,尽管不同家系患者的DMD基因缺失情况各异[14],但一般而言同一家系DMD基因缺失的基因型相同。因而这种连接片段序列具有样本个体独自的特异性,它是同一DMD家族中患者和女性携带者所特有的一段DNA序列。基于以上认识,本研究在以往通过设计PCR步移法对连接片段进行准确定位并对其实现直接PCR扩增的基础上,进一步将扩增DMD患者连接片段的引物应用于DMD家族中的女性携带者,同样可以将其携带的致病的DMD基因连接片段扩增出来。本研究利用此方法确诊前述DMD家系中的1例女性为携带者,并排除另一散发DMD病例的母亲为携带者,确诊其为正常女性,达到了进行缺失型DMD携带者检测的目的。
当前普遍的观点认为常规PCR技术无法对DMD女性携带者进行检测,通常需要采用定量检测的方法对携带者进行分析[10, 15]。本研究第一次成功实现仅使用常规PCR技术对DMD女性携带者进行检测,该方法与目前通常使用的DMD携带者检测技术的重大区别是不对DMD 基因进行定量分析,而直接以PCR 检测DMD家族中的女性是否携带致病的突变基因片段,即只要对女性被检者检测出与先证者一致的DMD基因缺失连接片段即可确认为携带者,方法直观且特异性高。
由于常规PCR技术不能检测重复突变和点突变[16],本方法仅适用于缺失型DMD女性携带者的检测。此外本方法需要在内含子上设计合成较多的定位引物,因此如何在DMD基因内含子尤其是两个缺失热区的内含子上建立一个完善且方便适用的内含子定位引物体系是目前简化该方法和使其得以推广应用的前提。本研究对设计缺失热区上第43、第44这2个庞大内含子以及第30、第54内含子定位引物进行了有益尝试。
| [1] | Chen C, Ma HW, Zhang F, et al. Screening of duchenne musculardystrophy (DMD) mutations and investigating its mutationalmechanism in Chinese patients[J]. PLoS One,2014, 9 (9) : e108038. DOI: 10.1371/journal.pone.0108038. |
| [2] | Juan-Mateu J, Gonzalez-Quereda L, Rodriguez MJ, et al. DMDmutations in 576 dystrophinopathy families: a step forward in Genotype-Phenotype correlations[J]. PLoS One,2015, 10 (8) : e0135189. DOI: 10.1371/journal.pone.0135189. |
| [3] | Guo R, Zhu G, Zhu H, et al. DMD mutation spectrum analysis in613 Chinese patients with dystrophinopathy[J]. J Hum Genet,2015, 60 (8) : 435-42. DOI: 10.1038/jhg.2015.43. |
| [4] | Lee T, Takeshima Y, Kusunoki N, et al. Differences in carrierfrequency between mothers of Duchenne and Becker musculardystrophy patients[J]. J Hum Genet,2014, 59 (1) : 46-50. DOI: 10.1038/jhg.2013.119. |
| [5] | Gatta V, Scarciolla O, Gaspari AR, et al. Identification of deletionsand duplications of the DMD gene in affected males and carrierfemales by multiple ligation probe amplification (MLPA)[J]. HumGenet,2005, 117 (1) : 92-8. |
| [6] | 钟敏, 潘速跃, 陆兵勋, 等. Dystrophin基因第45 ~54外显子缺失连接片段的克隆和测序(英文)[J]. 中华医学遗传学杂志,2006, 23 (2) : 138-41. |
| [7] | 钟敏, 潘速跃, 陆兵勋, 等. Dystrophin基因3~5号外显子缺失连接片段的克隆和测序[J]. 南方医科大学学报,2006, 26 (6) : 757-9. |
| [8] | Velazquez-Wong AC, Hernandez-Huerta CA, Hernandez-AguilarFO, et al. Identification of duchenne muscular dystrophy femalecarriers by fluorescence in situ hybridization and RT-PCR[J]. GenetTest,2008, 12 (2) : 221-3. |
| [9] | Barzegar M, Habibi P, Bonyady M, et al. Exon deletion pattern induchene muscular dystrophy in North West of Iran[J]. Iranianjournal of child neurology,2015, 9 (1) : 42-8. |
| [10] | Murugan SS, Arthi C, Thilothammal N, et al. Carrier detection inDuchenne muscular dystrophy using molecular methods[J]. IndianJournal of Medical Research,2013, 137 (6) : 1102-10. |
| [11] | Zimowski JG, Massalska D, Holding MA, et al. MLPA baseddetection of mutations in the dystrophin gene of 180 Polish familieswith Duchenne/Becker muscular dystrophy[J]. Neurol NeurochirPol,2014, 48 (6) : 416-22. |
| [12] | Manjunath M, Kiran P, Preethish-Kumar V, et al. A comparativestudy of mPCR,MLPA,and muscle biopsy results in a cohort ofchildren with Duchenne muscular dystrophy: a first study[J]. Neurol India,2015, 63 (1) : 58-62. DOI: 10.4103/0028-3886.152635. |
| [13] | Borun P, Kubaszewski L, Banasiewicz T, et al. Comparative-highresolution melting: a novel method of simultaneous screening forsmall mutations and copy number variations[J]. Hum Genet,2014, 133 (5) : 535-45. DOI: 10.1007/s00439-013-1393-1. |
| [14] | 钟敏, 潘速跃, 陆兵勋. 假肥大型肌营养不良患者dystrophin基因缺失断裂点的分子结构特点[J]. 中华神经科杂志,2007, 40 (8) : 521-4. |
| [15] | Lee BL, Nam SH, Lee JH, et al. Genetic analysis of dystrophingene for affected male and female carriers with Duchenne/Beckermuscular dystrophy in Korea[J]. J Korean Med Sci,2012, 27 (3) : 274-80. DOI: 10.3346/jkms.2012.27.3.274. |
| [16] | Esterhuizen AI, Wilmshurst JM, Goliath RG, et al. Duchennemuscular dystrophy: High-resolution melting curve analysis as anaffordable diagnostic mutation scanning tool in a South Africancohort[J]. S Afr Med J,2014, 104 (11) : 779-84. DOI: 10.7196/SAMJ.8257. |
 2015, Vol. 35
2015, Vol. 35

